Есть основания считать цитоплазматические микротрубочки и микрофиламенты тесно взаимосвязанными структурами одной и той же системы. Они играют сходную роль в генерации движения, встречаются в одних и тех же клетках в роли опорных структур, ведут себя сходным образом в зависимости от фазы клеточного цикла и образуют морфологически похожие структуры. К сожалению, приходится отметить, что, несмотря на приведенные выше соображения, у нас нет прямых доказательств взаимосвязи между микротрубочками и микрофиламентами. Многие данные, полученные различными методами, косвенно, но с большой вероятностью указывают на то, что между этими двумя системами есть связь, так что почти все признают, что такая связь на самом деле существует.
Например, с морфологической точки зрения исследовали распределение в клетке микротрубочек и микрофиламентов, особенно в процессе митоза. Фудживара и Поллард с помощью антител к тубулину, меченных флуоресцеином, и антител к миозину, меченных родамином, сравнили распределение микротрубочек и микрофиламентов в одной и той же клетке. В полностью распластанных клетках они не обнаружили морфологических связей между этими двумя типами волокон. Однако в митотическом веретене обусловленная миозином флуоресценция так сочеталась с флуоресценцией микротрубочек, что это указывало на тесную взаимосвязь между микрофиламентами и микротрубочками.
Более косвенные данные получены в опытах с ингибиторами микротубулярных структур (колхицин или его производное колцемид) и ингибиторами микрофиламентов (цитохалазин В). В качестве примера такого подхода мы рассмотрим влияние ингибиторов микротрубочек и микрофиламентов на явление образования «шапки» (capping), наблюдаемое в клетках млекопитающих. Реакция образования «шапки» возникает после обработки клетки бивалентными антителами или другими лигандами, способными взаимодействовать с белками на клеточной мембране. Она заключается в том, что связываемые молекулы лиганда скапливаются на ограниченном участке клеточной поверхности, образуя как бы шапку. Образование такой шапки угнетается цитохалазином-В, откуда следует, что микрофиламенты играют активную роль в перемещении молекул в мембране клетки. Во многих системах угнетение образования шапки удается снять колхицином или другими веществами, вызывающими деполимеризацию микротрубочек. Если разрушить и микротрубочки, и микрофиламенты комбинированным действием колхицина и цитохалазина-В, образовавшаяся шапка, которая обычно довольно стабильна, распадается, так что молекулы, из которых она состояла, распределяются по всей поверхности клетки. Эти результаты указывают на то, что и микротрубочки, и микрофиламенты участвуют в регуляции перемещения молекул в клеточной мембране: микрофиламенты проявляют сократительную активность, а микротрубочки служат для них опорой. Можно также предполагать, что для латерального перемещения белков в липидном бислое мембраны необходимо прямое взаимодействие между микрофиламентами и мембранными белками.
Есть, однако, и более прямые данные о том, что микрофиламенты соединены с поверхностными белками, т. е. с клеточными мембранами. В разных лабораториях различными методами показано, что непосредственно под шапкой, образующейся на лимфоцитах (после обработки антителами) или на клетках гранулезы яичников (после обработки конканавалином А), собирается много микрофиламентов. Там же накапливаются миозин и тубулин. В более поздней работе применили метод осаждения актина из лизатов клеток мышечным миозином, после чего идентифицировали вещество, преципитирующее вместе с актином; показано, что актин осаждается вместе с молекулами, обычно находящимися на внешней поверхности клеточных мембран, такими, как антигены Н-2 и иммуноглобулины. Количество иммуноглобулинов, связанных с актином, больше в клетках с «шапками», чем в клетках с неизмененным распределением антигенов по поверхности. Исходя из полученных результатов, можно предположить, что агрегация поверхностных белков в «шапку» вызывается возникновением новых связей с актином. Это может служить дополнительным свидетельством в пользу того представления, что микрофиламенты контролируют, по крайней мере, некоторые типы перемещения компонентов мембраны.
Приведенные выше данные демонстрируют также, что актиновые филаменты прямо связаны с мембранами. Результаты, полученные с помощью других методов и на других объектах, также указывают на это. Например, микрофиламенты часто выделяются при очистке цитоплазматических мембран. Впервые это показано для Acanthamoeba caslellani, а впоследствии подтвердилось практически для всех типов клеток. В очищенных препаратах мембран микрофиламенты можно увидеть в электронный микроскоп (причем они прикреплены к внутренней поверхности мембраны); кроме того, при электрофорезе препаратов мембран в полиакриламидном геле в присутствии додецилсульфата натрия обнаруживается актин.
Далее, есть прямые микроскопические наблюдения примембранных областей, в которых много микрофиламентов. Иногда, например, в случае ворсинок, очень четко видно, что микрофиламенты прикреплены к мембране на конце ворсинки. На электронных микрофотографиях поперечных сколов ворсинок центральный пучок микрофиламентов соединен с мембраной ворсинки как бы спицей.
Как микрофиламенты прикрепляются к мембране, пока неясно. Непосредственно ли присоединены микрофиламенты к мембранам или же их связь осуществляется через какие-то другие белки? Второе предположение кажется более правдоподобным; наиболее вероятные кандидаты на роль такого связующего белка — а-актинин или подобные ему белки. Показано, что а-актинин присутствует в кончике ворсинки — там, где микрофиламенты прикрепляются к ее мембране; кроме того, он обнаружен в цитоплазматической мембране и в мембранах секреторных везикул вблизи микрофиламентов. Таким образом, предполагается, что α-актинин играет одну и ту же роль и в мышечных волокнах (где он связывает актиновые нити с Ζ-мембранами) и в немышечных клетках. Возможно, микрофиламенты взаимодействуют с мембранами также через посредство миозина, и есть данные, указывающие на то, что миозин может выступать как трансмембранный белок.
Менее убедительны эксперименты, поставленные с целью выявить прямое взаимодействие, между микротрубочками и мембранами. По данным многих исследователей, колхицин связывается с мембранами, однако из-за того, что такому связыванию могут способствовать самые разные факторы, это нельзя расценивать как доказательство присутствия тубулина в клеточной мембране. Более прямые данные, указывающие на то, что тубулин входит в состав мембран, получены на синаптосомах головного мозга и на мембранах ресничек некоторых моллюсков. Во всяком случае, связь с мембранами для тубулина, по-видимому, не столь обычное явление, как для актина.
Кратко рассмотрев данные о взаимодействиях между микротрубочками, микрофиламентами и мембранами, и помня о распределении элементов цитоскелета в животной клетке, мы можем обсудить роль цитоскелета и клеточной мембраны (рис. 11).
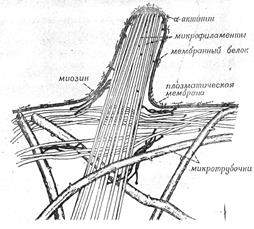
Рисунок 11. «Предполагаемые взаимоотношения между микротрубочками, микрофиламентами и клеточной мембраной».
Согласно предполагаемой модели, в интерфазных клетках микротрубочки образуют внутренний каркас, расходясь от центра к периферии клетки. Этот каркас не участвует непосредственно в генерации движения, а служит опорой для расположенных ближе, к поверхности клетки структур.
Дата: 2019-07-24, просмотров: 426.