В 1911г. Резерфорд предложил модель строения атома, согласно которой атом имеет положительно заряженное ядро 10^-14 – 10^-15м вокруг которого по круговым орбитам вращаются e  (напр. в атоме Н 1 электрон). Согласно классич. модели, при таком вращении
(напр. в атоме Н 1 электрон). Согласно классич. модели, при таком вращении 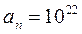 м/с. Атом в такой модели должен непрерывно излучать в пространство энергию, терять ее и переставать существовать.
м/с. Атом в такой модели должен непрерывно излучать в пространство энергию, терять ее и переставать существовать.
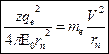 (1)
(1)
Классич. теория не могла объяснить устойчивость атома, а также не могла объяснить существование линейчатых спектров водородоподобных атомов (ВПА).
Опытным путем были изучены спектры ВПА и предложена эмпирическая формула, которая позволила рассчитать спектр ВПА: 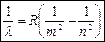 - формула Бальмера, где постоянная Ридберга R=1,1*10^7 1/м, m и n – целые числа m=1, 2, 3… n=m+1 Когда m=2, то это видимый спектр (свет), m=1 – ультрофиолетовая область, m=3 – инфрокрасная область.
- формула Бальмера, где постоянная Ридберга R=1,1*10^7 1/м, m и n – целые числа m=1, 2, 3… n=m+1 Когда m=2, то это видимый спектр (свет), m=1 – ультрофиолетовая область, m=3 – инфрокрасная область.
В 1913г. Нильс Бор предложил свои квантовые постулаты (они являются переходом от классич. к квантовой физике):
1) Бор выдвинул постулат о том, что в ВПА существуют определенные стационарные состояния (орбиты), при нахождении электрона на которых момент импульса электрона квантуется: (2) 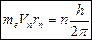 , где n=1, 2, 3… – главное квантовое число.
, где n=1, 2, 3… – главное квантовое число.
При вращении e  по стационарным орбитам атома не излучается и не поглощает энергии.
по стационарным орбитам атома не излучается и не поглощает энергии.
2) Излучение или поглощение энергии атомом происходит при переходе электрона с одной стационарной орбиты на другую. 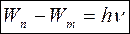
При использовании постулатов Бора и формулы Резерфорда: 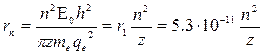
ТУТ ЕЩЁ РИС. И МНОГО ПРИПИСОК
Зная радиус стационарных орбит можно определить энергию этих стационарных состояний: 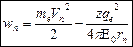 (3)
(3)
Используя (1), (2) и (3) получаем: 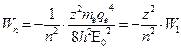 , где W1=|13,6| эВ
, где W1=|13,6| эВ
W1 – потенциал ионизации атома водорода
Теория ВПА созданная Бором позволила объяснить устойчивость атомов, а также она позволила объяснить существование линейчатых спектров ВПА.
Расчеты с использованием 2-ого постулата и формулы Бальмера дали очень хорошее совпадение. R, рассчитанная теоретически, совпала с экспериментальным значением до 4-ого знака после запятой.
Однако, несмотря на явные успехи теории Бора, не удалось рассчитать энергетический спектр He, Ne, Li и не удалось объяснить различие интенсивности спектральных линий.
Все противоречия были ликвидированы с помощью применения и решения ур-ия Шр. для модели ВПА.
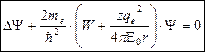 – ур-ие Шр.
– ур-ие Шр.
Решение ур-ия Шр. дает возможность найти собственные значения энергии (Wn), которое может иметь атом. Эти значения энергии совпадают со значениями энергии, рассчитанными с использованием постулатов Бора.
При этом для каждого квантового значения энергии (собственное значение энергии) из решения ур-ия Шр. получается набор собственных значений волновых функций.
Если одному Wn соответствует только одна Ψn, l, m то это невырожденное состояние; а если несколько, то вырожденное.
n, l и m – квантовые числа, кот. появились из решения ур-ия W.
n – главное квантовое число, кот. определяет квантовое значение энергии
l – орбитальное квантовое число l=n-1 (где n=1, 2, 3…)
Орбитальное квантовое число позволяет рассчитать квантовые значения момента импульса – в химии это формула орбиты.
m – магнитное квантовое число
При нахождении атома во внешнем магнитном поле орбита электрона может быть ориентирована только четко определенным образом, так чтобы проекция импульса на направление внешнего магнитного поля принимали определенное положение.
СМ. ТЕТР.
Кроме этих трех квантовых чисел в 1925г. была выдвинута гипотеза о том, что электрон имеет собственные механические и магнитные моменты.
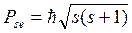
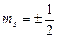
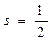
Элементарные частицы, для кот. спиновое число =1/2 называются фермионы; однако существует класс частиц, у кот. s=1, это фотоны, пиметоны и др. они называются вазоны.
Дата: 2019-07-24, просмотров: 274.