Взаимодействие организма и среды
Фундаментальные свойства живых систем. Уровни биологической организации. Организм как дискретная самовоспроизводящаяся открытая система, связанная со средой обменом веществ, энергии и информации.
Разнообразие организмов. Источники энергии для организмов. Автотрофы и гетеротрофы. Фотосинтез и дыхание: кислород атмосферы как продукт фотосинтеза. Основные группы фотосинтезирующих организмов (планктонные цианобактерии и водоросли в морях и высшие растения на суше). Хемосинтез, жизнь в анаэробных условиях. Основные группы гетеротрофов (бактерии, грибы, животные). Трофические отношения между организмами: продуценты, консументы и редуценты.
Геометостаз (сохранение постоянства внутренней среды организма); принципы регуляции жизненных функций. Возможности адаптации организмов к изменениям условий среды. Генетические пределы адаптации. Эврибионты и стенобионты. Гомойо – и пойкилотермность. Принципы воспроизведения и развития различных организмов. Особенности зависимости от среды на разных стадиях жизненного цикла. Критические периоды развития.
Условия и ресурсы среды
Представление о физико-химической среде обитания организмов:
особенности водной, почвенной и воздушной сред. Абиотические и биотические факторы. Экологическое значение основных абиотических факторов: тепла, освещённости, влажности, солёности, концентрации биогенных элементов. Заменимые и незаменимые ресурсы. Сигнальное значение абиотических факторов. Суточная и сезонная цикличность.
Лимитирующие факторы. Правило Либиха. Взаимодействие экологических факторов. Распределение отдельных видов по градиенту условий. Представление об экологической нише; потенциальная и реализованная ниша. Организмы – индикаторы качества среды.
Популяции Определение понятий «биологический вид» и «популяция». Иерархическая структура популяций; расселение организмов и межпопуляционные связи. Популяция как элемент экосистемы.
Статистические характеристики популяции: численность, плотность, возрастной и половой состав. Биомасса и способы её выражения: сырой и сухой вес, энергетический эквивалент. Методы оценки численности и плотности популяции. Характер пространственного размещения особей и его выявление. Случайное и агрегированное распределение. Механизмы поддержания пространственной структуры. Территориальность, скопления животных и растений, причины их возникновения.
Динамические характеристики популяции: рождаемость, смертность, скорость популяционного роста. Таблицы и кривые выживания.
Характер распределения смертности по возрастам в разных группах животных и растений. Специфическая скорость роста популяции, «плотность насыщения» как показатель ёмкости среды. Динамика биомассы.
Понятие о биопродуктивности.
Сообщества
Биоценозы (сообщества), их таксономический состав и функциональная структура. Типы взаимоотношений между организмами: симбиоз, мутуализм, комменсализм, биотрофия (хищничество в широком смысле слова).
Межвидовая конкуренция. Эксплуатация и интерференция. Принцип конкурентного исключения. Условия существования конкурирующих видов. Конкуренция и распределение видов в природе.
Отношения «хищник-жертва». Сопряжённые колебания численности хищника и жертвы. Сопряжённая эволюция.
Видовая структура сообществ и способы её выявления. Видовое разнообразие как специфическая характеристика сообщества. Динамика сообществ во времени. Сериальные и климаксовые сообщества.
Определение понятия «Экосистема». Экосистемы как хорологические единицы биосферы. Составные компоненты экосистем, основные факторы, обеспечивающие их существование. Развитие экосистем: сукцессия.
Человек в биосфере
Человек как биологический вид. Его экологическая ниша. Экология и здоровье человека. Популяционные характеристики человека.
Экология человечества: проблемы демографии, развитие технологической цивилизации, ресурсы биосферы.
Преднамеренное и непреднамеренное, прямое и косвенное воздействие человека на природу. Экологический кризис. Ограниченность ресурсов и загрязнение среды как фактор, лимитирующий развитие человека.
Экологические принципы охраны природы и рациональное использование её ресурсов Рост народонаселения, научно-технический прогресс и природа в современную эпоху. Охрана биосферы как одна из важнейших современных задач человечества.
Классификация природных ресурсов: особенности использования и охраны почерпаемых (возобновимых, относительно возобновимых и невозобновимых) и неисчерпаемых ресурсов.
Пищевые ресурсы человечества. Проблемы питания и производства сельскохозяйственной продукции. Сельскохозяйственное производство как экологически обусловленный биосферный процесс. Агроэкосистемы, их основные особенности и условия существования. Особенности охраны чистоты атмосферного воздуха, водных ресурсов, почвы, растительного и животного мира.
Глобальное загрязнение биосферы, его масштабы, последствия и принципиальные пути борьбы с ним.
«Зелёная революция» и её последствия. Значение и экологическая роль применения удобрений и пестицидов. Формы и масштабы сельскохозяйственного загрязнения биосферы. Нехимические методы борьбы с видами, распространение и рост численности которых нежелательны для человека.
Воздействие промышленности и транспорта на окружающую среду. Загрязнение биосферы токсическими и радиоактивными веществами. Основные пути миграции и накопления в биосфере радиоактивных изотопов и других веществ, опасных для человека, животных и растений. Опасность ядерных катастроф.
ЗАДАНИЕ №3
Теоретические сведения.
Антропогенные факторы среды — это факторы, возникновение которых обусловлено хозяйственной или иной деятельностью человека.
Наибольшую опасность для человека и животных представляют экотоксиканты. Экотоксиканты — вредные химические вещества, загрязняющие окружающую среду и отравляющие находящиеся в ней живые организмы. Основными источниками их поступления являются: предприятия химической, нефтеперерабатывающей, металлургической, деревообрабатывающей, топливной и других промышленных отраслей; различные виды транспорта (особенно автомобильный); ТЭЦ и другие энергетические установки; сельскохозяйственное производство (минеральные удобрения, пестициды); АЭС и предприятия, использующие атомную энергию и т. д.
В современном обществе ежедневно используются сотни тысяч химических веществ. Среди десяти наиболее опасных веществ и факторов воздействия следует назвать тяжелые металлы (Hg, Co, Mo, Pb, Cd, As, Zn, Си, и др.), летучие органические соединения, формальдегид, пестициды, побочные продукты сгорания (СО, СО2, N02, SO2 и др.), ядовитые и канцерогенные вещества в продуктах питания, пыль, асбест, бактерии, радиацию. Невозможно контролировать множество химических реакций между этими веществами, их индивидуальные и комбинированные токсические эффекты.
В настоящее время автотранспорт является одним из основных загрязнителей атмосферы оксидами азота и угарным газом, содержащимися в выхлопных газах. Доля транспортного загрязнения воздуха составляет более 60% по СО и более 50% по NOX от общего загрязнения атмосферы этими газами. Повышенное содержание СО и NOX можно обнаружить в выхлопных газах неотрегулированного двигателя, а также двигателя в режиме прогрева. Концентрация оксида углерода (II) в выхлопных газах автомобиля составляет 0,3-10 %, углеводородов (несгоревшего топлива) — до 3% и оксидов азота — до 0,8%.
Последствия отрицательного воздействия на организм человека основных загрязнителей воздуха, попадающих в атмосферу из выхлопных газов, приведены в табл.12.
Таблица 12 – Влияние выхлопных газов автомобиля на здоровье человека (по Х.Ф.Френчу, 1992)
| Вредные вещества | Последствия действия на организм человека |
| Окись углерода | Препятствует адсорбированию кровью кислорода, что ослабляет мыслительные способности, замедляет рефлексы, вызывает сонливость и может быть причиной потери сознания и смерти |
| Окислы азота | Увеличивают восприимчивость организма к вирусным заболеваниям (типа гриппа), раздражают легкие, вызывают бронхит и пневмонию. |
| Озон | Раздражает слизистую оболочку органов дыхания, вызывает кашель, нарушает работу легких, снижается сопротивляемость к простудным заболеваниям, может обострять хронические болезни сердца, а также вызывать астму и бронхит. |
| Токсичные выбросы (тяжелые металлы) | Вызывают рак, нарушение половой системы и дефекты у новорожденных |
Экспериментальная часть.
Задание 1. Выберите участок автотрассы вблизи учебного заведения (места жительства, отдыха) длиной 0,5-1 км, имеющий хороший обзор (из окна, из парка, с прилегающей территории).
Измерьте шагами длину участка (в м), предварительно определив среднюю длину своего шага.
Определите число единиц автотранспорта, проходящего по участку в течение 20 минут, 1 часа. При этом заполняйте табл. 13.
Таблица 13 – Учетная таблица
| Тип автотранспорта | Кол-во, шт. | Всего за 20 мин. | За 1 час, Ni | Общий путь за 1 час, L, км. |
| Легковые автомобили | ||||
| Грузовые автомобили | ||||
| Автобусы | ||||
| Дизельные грузовые автомобили |
Количество выбросов вредных веществ, поступающих от автотранспорта в атмосферу, может быть оценено расчетным методом. Исходными данными для расчета количества выбросов являются:
— число единиц автотранспорта, проезжающего по выделенному участку автотрассы в единицу времени;
— нормы расхода топлива автотранспортом (средние нормы расхода топлива автотранспортом при движении в условиях города приведены в табл.14).
Таблица 14 – Нормы расхода топлива
| Тип автотранспорта | Средние нормы расхода топлива (л на 100 км) | Удельный расход топлива Yi (л на 1 км) |
| Легковые автомобили | 11-13 | 0,11-0,13 |
| Грузовые автомобили | 29-33 | 0,29-0,33 |
| Автобусы | 41-44 | 0,41-0,44 |
| Дизельные грузовые автомобили | 31-34 | 0,31-0,34 |
Значения эмпирических коэффициентов (К), определяющих выброс вредных веществ от автотранспорта в зависимости от вида горючего, приведены в табл.15.
Таблица 15 – Коэффициенты выброса
| Вид топлива | Значение коэффициента (К) | ||
| Угарный газ | углеводороды | Диоксид азота | |
| Бензин | 0,6 | 0,1 | 0,04 |
| Дизельное топливо | 0,1 | 0,03 | 0,04 |
Коэффициент К численно равен количеству вредных выбросов соответствующего компонента при сгорании в двигателе автомашины количества топлива, равного удельному расходу (л/км).
Задание 2. Обработка результатов.
Рассчитайте общий путь, пройденный выявленным числом автомобилей каждого типа за 1 час (L, км), по формуле:
Li = Ni x L, (6)
где i — обозначение типа автотранспорта; L — длина участка, км;
Ni — число автомобилей каждого типа за 1 час.
Рассчитайте количество топлива (Qi, л) разного вида, сжигаемого при этом двигателями автомашин, по формуле:
Qi = Li x Yi (7)
Определите общее количество сожженного топлива каждого вида (SQ) и занесите результаты в табл.16.
Таблица 16 – Расход топлива
| Тип автомобиля | Ni | Qi | |
| Бензин | Дизельное топливо | ||
| Легковые автомобили | |||
| Грузовые автомобили | |||
| Автобусы | |||
| Дизельные грузовые автомобили | |||
| Всего | S Qi | ||
Рассчитайте объем выделившихся вредных веществ в литрах при нормальных условиях по каждому виду топлива и всего, занесите результат в табл.17.
Таблица 17 – Объем выбросов
| Вид топлива | S Qi, л | Количество вредных веществ, л | ||
| Угарный газ | Углеводороды | Диоксид азота | ||
| Бензин | ||||
| Дизельное топливо | ||||
| Всего | (V, л) | |||
Рассчитайте массу выделившихся вредных веществ (г) по формуле:
 (8)
(8)
где М — молекулярная масса.
Рассчитайте количество чистого воздуха, необходимое для разбавления выделившихся вредных веществ для обеспечения санитарно допустимых условий окружающей среды. Результаты запишите в табл.18:
Таблица 18 – Количество чистого воздуха, необходимого для разбавления газообразных продуктов сгорания топлива
| Вид вредного вещества | Кол-во (л) (объем) | Масса, г | Объем воздуха для разбавления (м3) | Значение ПДК, мг/ м3 |
| Угарный газ | 20 | |||
| Углеводороды | 300000 | |||
| Диоксид азота | 0,2 |
Сопоставьте полученные результаты с количеством выбросов вредных веществ, производимых находящимися в вашем районе заводами, фабриками, котельными, автопредприятиями и другими загрязнителями воздуха. При этом пользуйтесь соответствующими данными по экологической оценке качества выбросов от этих предприятий (такие данные можно получить, например, в районном или городском комитете по экологии и т. п.).
Требование к содержанию отчета. Отчеты по каждому заданию оформляются в произвольной форме. Принимая во внимание близость к автомагистрали жилых и общественных зданий, сделайте вывод об экологической обстановке в районе исследованного вами участка автомагистрали, о качестве изученного бензина и спрогнозируйте возможные негативные последствия его использования.
Контрольные вопросы.
1. Что такое антропогенные факторы среды?
2. Перечислите токсичные вещества, обладающие способностью накопления в природной среде и в организме человека.
3. Какие токсичные вещества приводят к высокой утомляемости человека, понижению его физической и умственной работоспособности и повышенной чувствительности к инфекциям, особенно при стрессовых воздействиях?
4. Какие источники способствуют накоплению солей тяжелых металлов в организме человека?
5. Какие средства следует применять для защиты организма от антропогенных экотоксикантов?
ЗАДАНИЕ №4 Сточные воды. Методы очистки.
Цель работы. Ознакомиться с видами промышленных сточных вод и методами их очистки.
Обеспечивающие средства (материалы и пособия): искусственно смоделированная сточная вода, растворы: гексацианоферрат (II) калия, гексацианоферрата (III) калия, 2М раствор HCl, роданид аммония, серная кислота (концентрированная), азотная кислота (концентрированная), 1М раствор серной кислоты, 0,01н раствор перманганата калия, раствор нитрата бария, уксусная кислота, перекись водорода, сульфат железа, 0,1 н раствор соляной кислоты, мел, соляная кислота (1:4), фенолфталеин, индикаторная бумага, йодкрахмальная бумага, фильтровальная бумага, колба Вюрца, стаканы химические, колба коническая, калькулятор.
Теоретическое введение.
Виды сточных вод
Сточные воды, отводимые с территории промышленных предприятий, по своему составу могут быть разделены на три вида:
1) производственные - использованные в технологическом процессе производства или получающиеся при добыче полезных ископаемых (угля, нефти, руд и т.п.);
2) бытовые - от санитарных узлов производственных и непроизводственных корпусов и зданий, а также от душевых установок, имеющихся на территории промышленных предприятий;
3) атмосферные - дождевые и от таяния снега.
Производственные сточные воды делятся на две основные категории: загрязненные и незагрязненные (условно чистые).
Загрязненные производственные сточные воды содержат различные примеси и подразделяются на три группы:
1) загрязненные преимущественно минеральными примесями (предприятия металлургической, машиностроительной, рудо- и угледобывающей промышленности; заводы по производству минеральных удобрений, кислот, строительных материалов и др.);
2) загрязненные преимущественно органическими примесями (предприятия мясной, рыбной, молочной, пищевой, целлюлозно-бумажной, химической, микробиологической промышленности; заводы по производству пластмасс, каучука и др.);
3) загрязненные минеральными и органическими примесями (предприятия нефтедобывающей, нефтеперерабатывающей, нефтехимической, текстильной, легкой, фармацевтической промышленности; заводы по производству консервов, сахара, продуктов органического синтеза, бумаги, витаминов и др.).
По концентрации загрязняющих веществ производственные сточные воды делятся на четыре группы: 1-500, 500-5000, 5000-30000, более мг/л. Производственные сточные воды могут различаться по физическим свойствам загрязняющих их органических продуктов (например, по температуре кипения: менее 120, 120-250 и более 2500С). По степени агрессивности эти воды разделяют на слабоагрессивные (слабокислые с рН = 6-6,5 и слабощелочные с рН = 8-9), сильноагрессивные (сильнокислые с рН < 6 и сильнощелочные с рН > 9) и неагрессивные (с рН = 6,5-8).
Незагрязненные производственные сточные воды поступают от холодильных, компрессорных, теплообменных аппаратов. Кроме того, они образуются при охлаждении основного производственного оборудования и продуктов производства. На различных предприятиях, даже при одинаковых технологических процессах, состав производственных сточных вод, режим водоотведения и удельный расход на единицу выпускаемой продукции весьма разнообразны.
Наиболее часто встречающиеся загрязнения промышленных сточных вод следующие: неорганические кислоты и их соли, щелочи, поверхностно-активные вещества и неорганические соли тяжелых металлов. Для очистки промышленных сточных вод от этих вредных загрязнителей требуются специальные технологические методы.
Большое значение в формировании состава производственных сточных вод имеет вид перерабатываемого сырья. Так, например, основным загрязняющим компонентом сточных вод на мясокомбинатах являются отходы мяса, непереваренная пища животных; на бумажных фабриках - целлюлозные волокна; на фабриках первичной обработки шерсти (ПОШ) - жир, шерсть и т.д. Состав сточных вод зависит также от технологического процесса производства, применяемых компонентов, промежуточных изделий и продуктов, выпускаемой продукции, состава исходной свежей воды, местных условий и др.
Методы очистки промышленных сточных вод
В промышленных сточных водах содержится большое количество органических и неорганических соединений, которые оказывают очень вредное действие на окружающую среду.
Очистка сточных вод - сложнейшая задача, в решении которой нуждаются многие производства. Существуют различные методы очистки: механические, химические, физико-химические, биологические и термические. Ввиду множества примесей и их сложного состава методы очистки сточных вод применяют комплексно (рис.8).
Существуют также рекуперационные и деструктивные методы очистки сточных вод. Рекуперационные методы предусматривают извлечение из сточных вод и дальнейшую переработку ценных веществ. При деструктивных методах вещества, загрязняющие воду, подвергают разрушению путем окисления или восстановления. Продукты разрушения удаляют из воды в виде газов или осадков.
Механические методы - наиболее доступные приемы очистки от крупнодисперсных взвесей, применяются как первая стадия в общей схеме очистки сточных вод. Назначение механической очистки заключается в подготовке производственных сточных вод при необходимости к биологическому, физико-химическому или другому методу более глубокой очистки. Механическая очистка на современных очистных станциях состоит из процеживания через решетки, пескоулавливания, отстаивания и фильтрования. Типы и размеры этих сооружений зависят в основном от состава, свойств и расхода производственных сточных вод, а также от методов их дальнейшей обработки. Механическая очистка обеспечивает выделение взвешенных веществ производственных сточных вод до 90-95 % и снижение органических загрязнений (по показателю БПКполн) до 20-25 %.
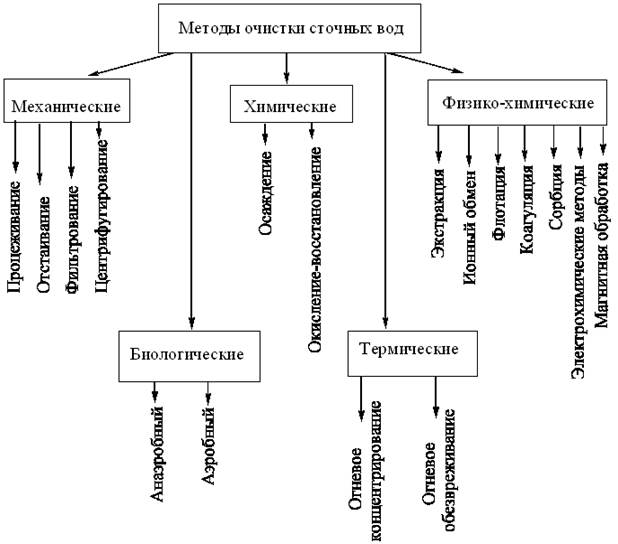
Рисунок 8. Методы очистки сточных вод
Высокий эффект очистки сточных вод достигается различными способами интенсификации гравитационного отстаивания - преаэрацией, биокоагуляцией, осветлением во взвешенном слое (отстойники - осветлители) или в тонком слое (тонкослойные отстойники), а также с помощью гидроциклонов. Процесс более полного осветления сточных вод осуществляется фильтрованием - пропусканием воды через слой различного зернистого материала (кварцевого песка, гранитного щебня, дробленного антрацита и керамзита, горелых пород, чугунолитейного шлака и других материалов) или через сетчатые барабанные фильтры и микрофильтры, через высокопроизводительные напорные фильтры и фильтры с плавающей загрузкой - пенополиуретановой или пенополистирольной. Преимущество указанных процессов заключается в возможности применения их без добавления химических реагентов.
Выбор механического метода очистки осуществляется с учетом размеров взвешенных частиц. Если частицы достаточно велики (диаметром более 30-50 мкм), то они могут легко выделяться отстаиванием или процеживанием. Коллоидные частицы (диаметром 0,1-1 мкм) могут быть удалены фильтрованием, однако из-за органической емкости фильтрующего слоя более подходящим методом при концентрациях взвешенных частиц более 50 мг/л является ортокинетическая коагуляция с последующим осаждением или осветлением во взвешенном слое. Типовое оборудование для механической очистки - решетки, песколовки, отстойники, фильтры, гидроциклоны, центрифуги, жидкостные сепараторы.
Физико-химические методы играют значительную роль при очистке производственных сточных вод. Они применяются как самостоятельно, так и в сочетании с механическими, химическими и биологическими методами. Физико-химические методы позволяют полностью автоматизировать процесс очистки, а современный уровень знаний в области кинетики физико-химических процессов создает основы для их математического моделирования и оптимизации и, как следствие, правильного выбора и расчета параметров аппаратуры. В большинстве случаев использование физико-химических методов выделения загрязняющих веществ из сточных вод позволяет в дальнейшем их рекуперацию.
Химические методы обработки сточных вод основаны на применении химических реакций, в результате которых загрязнения превращаются в соединения, безопасные для потребителя, или легко выделяются в виде осадков.
В особую группу химических методов следует выделить хлорирование и озонирование сточных вод, содержащих органические примеси, а также цианиды и другие пахнущие неорганические вещества. Хлорирование и озонирование наиболее часто применяют для доочистки и обезвреживания питьевой воды на городских водопроводных станциях.
Биологическая очистка - широко применяемый на практике метод очистки производственных сточных вод, позволяющий очистить их от многих органических примесей. Биологическое окисление осуществляется сообществом микроорганизмов (биоценозом), включающим множество различных бактерий, простейших и ряд более высокоорганизованных организмов - водорослей, грибов и т. д., связанных между собой в единый комплекс сложными взаимоотношениями (метабиоза, симбиоза и антагонизма). Главенствующая роль в этом сообществе принадлежит бактериям, число которых варьирует от 106 до 1014 клеток на 1 г сухой биологической массы (биомассы). Число родов бактерий может достигать 5-10, число видов - нескольких десятков и даже сотен.
Такое разнообразие видов бактерий обусловлено наличием в очищаемой воде органических веществ различных классов. Если же в составе сточных вод присутствует лишь один или несколько близких по составу источников органического углерода, т. е. один или несколько близких гомологов органического соединения, то возможно развитие монокультуры бактерий. Сообщество микроорганизмов представлено одними бактериями в том случае, если очистку проводят в анаэробных условиях или при слишком неблагоприятном уровне питания, который представляет собой отношение количества органических веществ к числу микроорганизмов. Неблагоприятным уровнем питания может оказаться, например, слишком высокое соотношение количеств подаваемых на очистку загрязнений и биомассы микроорганизмов. Если очистку проводят в аэробных условиях (в присутствии растворенного кислорода), то при благоприятной обстановке в сообществе микроорганизмов развиваются простейшие, представленные числом видов от 1 до 15-30.
Механизм биологического окисления в аэробных условиях может быть представлен следующей схемой:
органические вещества + O2 + N + P → микроорганизмы + CO2 + H2O
+ биологически неокисляемые растворимые вещества.
Реакция символизирует окисление исходных органических загрязнений сточных вод и образование новой биомассы. В очищенных сточных водах остаются биологически неокисляемые вещества, преимущественно в растворенном состоянии, так как коллоидные и нерастворенные вещества удаляются из сточной воды методом сорбции. Эффективность процессов биологической очистки зависит от многих факторов, например, существенно влияет на развитие микроорганизмов концентрацияводородных ионов. Значительная часть бактерий развивается лучше всего в среде нейтральной или близкой к ней, однако имеются виды, хорошо развивающиеся в кислой среде рН = 4 - 6 (грибы, дрожжи) или, наоборот, в слабощелочной среде (актиномицеты).
Для эффективного процесса биологической очистки сточной воды, для нормального процесса синтеза клеточного вещества в среде должна быть достаточная концентрация всех основных элементов питания – органического углерода, азота, фосфора. При нехватке N и P их добавляют искусственно в виде суперфосфата, аммофоса, ортофосфорной кислоты, хлорида аммония, мочевины и др.
Большое влияние на биологическое окисление оказывает кислородный режим и наличие токсичных веществ в среде. Токсичное действие на биологические процессы могут оказывать органические и неорганические вещества. Токсичное действие может быть и микробостатическим, если задерживается рост и развитие микроорганизмов, и убивающим (микробоцидным). Большинство веществ проявляет то или иное действие в зависимости от концентрации их в очищаемой смеси.
Биологическая очистка сточных вод может осуществляться как в естественных условиях (поля орошения, поля фильтрации, биологические пруды), так и в специальных сооружениях (аэратенки, метантенки).
При термической очистке сжигают жидкие отходы нефтепродуктов и других горючих в печах и горелках различной конструкции. Подлежащие сжиганию сточные воды должны иметь высокое содержание нефтепродукта, обычно не менее 30 %. Для этого сточные воды собирают в резервуар-накопитель, отстаивают и слой нефтепродукта подают на сжигание. В зоне горения поддерживается температура 800-12000С и избыток кислорода. При полном сгорании образуются продукты, не способные к дальнейшему горению: CO2, H2O и др. При неполном сгорании образуются H2S; HCN; COCl3 и др. Оптимальную температуру процесса, при которой обнаруживается минимальное количество загрязняющих веществ, определяют практическим путем.
Расчет необходимой степени очистки сточных вод.
Водоемы обладают самоочищающей способностью, что следует учитывать при проектировании очистных сооружений и определении необходимой степени очистки. Необходимую степень очистки сточных вод, спускаемых в водоем, находят по следующим показателям: количество взвешенных веществ, потребление растворенного кислорода, допускаемая БПК смеси речных и сточных вод, изменение активной реакции воды, а также предельно допустимые концентрации токсических примесей и других вредных веществ.
В «Правилах охраны поверхностных вод от загрязнения сточными водами» выделяют две категории водоемов: водоемы питьевого и культурно-бытового водопользования и водоемы, используемые в рыбохозяйственных целях.
Водоемы питьевого и культурно-бытового водопользования делятся на два вида: первый — участки водоемов, используемые в качестве источника для централизованного и нецентрализованного питьевого водоснабжения, а также водоснабжения предприятий пищевой промышленности; второй — участки водоемов, используемые для купания, спорта и отдыха населения, а также водоемы, находящиеся в пределах населенных пунктов. К какому виду водопользования относится данный участок водоема, определяют органы Государственного санитарного надзора.
Водоемы для рыбохозяйственных целей также подразделяются на два вида: первый — водоемы, используемые для воспроизводства и сохранения ценных пород рыб; второй — водоемы, используемые для других рыбохозяйственных целей. Вид рыбохозяйственного использования водоема определяется органами рыбоохраны.
Расчет необходимой степени очистки сточных вод по взвешенным веществам
Предельно допустимое содержание взвешенных веществ т, г/м3, в спускаемых в водоем сточных водах определяют по формуле:
т = P(aQ/q+1)+b, (33)
где P — допустимое санитарными нормами увеличение содержания взвешенных веществ в водоеме после спуска сточных вод, г/ м3; b— содержание взвешенных веществ в водоеме до спуска в него сточных вод, г/м3; Q— наименьший среднемесячный расход воды в водоеме 95 %-ной обеспеченности, м3/с.
Степень необходимой очистки по взвешенным веществам может быть определена в %:
Э=(С–т)100/С, (34)
где С — содержание взвешенных веществ до очистки, мг/л.
Расчет необходимой степени очистки сточных вод по растворенному в воде водоема кислороду.
В соответствии с правилами спуска сточных вод в воде водоема после смешения ее со сточной водой содержание растворенного кислорода должно быть не ниже 4 мг/л, а для рыбохозяйственных водоемов первого вида — 6 мг/л. Исходя из этого, можно определить допустимую для данного водоема максимальную БПК спускаемых сточных вод. Допустимая БПКполн сточных вод, сбрасываемых в водоем, исходя из условий минимального содержания растворенного кислорода, выражается уравнением:
Lст = aQ/0,4q(Op–0,4Lp–O)–O/0,4 (35)
где Lст, Lр — полное биохимическое потребление кислорода, соответственно, сточными водами и речной водой, г/м3; Q — расход воды в реке, м3/сут; Ор — содержание растворенного кислорода в речной воде до места спуска сточных вод, г/м3; О — минимальное содержание кислорода в воде, принимаемое равным 4 или 6 г/м3; 0,4 — коэффициент для перерасчета БПКполн в двухсуточное.
Расчет по другому методу учитывает среднюю скорость движения воды в водоеме, температуру воды, константы скорости потребления кислорода и скорости поверхностной реаэрации. Этот расчет более полный и точный, но требует проведения натурных изысканий на участке реки, для которого выполняется расчет.
Расчет необходимой степени очистки сточных вод по БПКполн учитывает самоочищение сточных вод в водоеме за счет биохимических процессов, а также разбавление сточных вод водами водоема. Допустимую БПКполн сточной жидкости при выпуске ее в водоем определяют по формуле:
Lпд = [aQ(Lст — Lр • 10–kp t) / (q • 10–kст t)] + Lр / 10–kст t (36)
где kст, kр — константы скорости потребления кислорода сточной и речной водой; Lп.д. — предельно допустимая БПКполн смеси речной и сточной воды в расчетном створе; для водоемов питьевого и культурного пользования 1 и 2 категории эта величина принимается, соответственно, равной 3 и 6 мг/л; Lp — БПКполн речной воды до места выпуска сточных вод; t — продолжительность перемещения воды от места выпуска сточных вод до расчетного створа, равная отношению расстояния по фарватеру от места выпуска вод до расчетного створа к средней скорости течения воды в реке на данном участке vср, сут.
Необходимую степень очистки Э определяют в %:
Э=(Lа–Lст)100/Lа, (37)
где Lа — БПКполн сточных вод, поступающих на очистку.
Расчет допускаемой температуры сточных вод перед сбросом в водоем
Расчет повышения температуры воды в источнике в месте сброса сточных вод производят, исходя из условий, что температура воды летом (максимальная температура) не должна повышаться в месте выпуска сточных вод более чем на 3°. Температура сбрасываемых вод Тст должна удовлетворять условию:
Тст ≤ пТдоп+Тмакс (38)
где Тдоп — допускаемое по санитарным нормативам повышение температуры воды водоема до места выпуска сточных вод. Полученную по расчетам Тст сопоставляют с температурой исходных стоков Тисх и при необходимости намечают мероприятия по их охлаждению.
Экспериментальная часть.
Задание 1. Качественный анализ сточных вод.
Прежде чем приступить к анализу раствора, необходимо внимательно рассмотреть его окраску, а затем определить рН. По окраске можно сделать предварительный вывод о присутствии некоторых ионов, имеющих окраску, например: Cu2+ (синий), Cr3+ (зеленый или фиолетовый), Ni2+ (зеленый), Co2+ (розовый), MnO4- (фиолетовый), CrO42-(желтый), Сr2O2−7 (оранжевый), Fe3+ (желтый) и др.
В кислом растворе при рН меньше 7, помимо солей сильных кислот и сильных оснований, могут быть свободные кислоты, кислые соли, а также соли, образованные сильными кислотами и слабыми основаниями. Анионов слабых кислот, например, CO32−, SO32−, S2O32−, S2–, в таком растворе нет.
Щелочная реакция исследуемого раствора, т. е. рН больше 7, исключает возможность присутствия в растворе катионов слабых оснований, образующих малорастворимые не амфотерные гидроксиды, например, Al3+, Co2+, Cr3+, Cu2+, Fe3+, Fe2+, Mn2+, Ni2+, Pb2+, Zn2+. Нейтральный раствор может содержать соли, образованные одинаковыми по силе кислотами и основаниями, например, Na2SO4, KNO3, CH3COONH4 и др.
После проведения предварительных испытаний приступают к непосредственному обнаружению катионов и анионов. Предложенные студентам модельные образцы сточных вод содержат небольшое число ионов. Поэтому в целях экономии времени анализ лучше проводить дробным методом, используя для обнаружения приведенные ниже качественные реакции. Анализ проводится непосредственно в отдельных порциях анализируемого раствора в присутствии анионов и катионов других элементов. Порядок обнаружения отдельных ионов не имеет при этом значения.
1. Обнаружение иона Fe3+ взаимодействием с гексацианоферратом (II) калия
Гексацианоферрат (II) калия K4[Fe(CN)6] (желтая кровяная соль) в слабокислых растворах образует с ионами Fe3+ темно-синий осадок «берлинской лазури»:
4Fe3+ + 3[Fe(CN)6]4– → Fe4[Fe(CN)6]3↓.
Другие катионы не мешают проведению этой реакции.
К 1-2 мл пробы сточной воды добавьте 1 мл 2 М раствора HCl и по каплям прибавляйте раствор K4[Fe(CN)6]. Образование темно-синего осадка свидетельствует о присутствии ионов Fe3+.
2. Обнаружение иона Fe2+ взаимодействием с гексацианоферратом (Ш) калия.
Гексацианоферрат (III) калия K3[Fe(CN)6] (красная кровяная соль) в слабокислом растворе образует с ионами Fe2+ синий осадок «турнбулевой сини»:
3Fe2+ + 2[Fe(CN)6]3– → Fe3[Fe(CN)6]2↓
Осадок нерастворим в кислотах, но разлагается щелочами. Эта реакция наиболее характерна для ионов Fe2+. Обнаружению Fe2+ с помощью красной кровяной соли не мешают другие катионы.
К 1-2 мл исследуемой сточной воды добавьте равный объем соляной кислоты и по каплям прибавляйте раствор K3[Fe(CN)6]. Образование синего осадка турнбулевой сини является доказательством присутствия ионов Fe2+.
3. Обнаружение иона Co2+ взаимодействием с роданидом аммония
В слабокислой среде ионы Со2+ образуют с NH4SCN комплексные ионы состава (NH4)2[Co(SCN)4]:
Co2+ + 2NH4+ + 4SCN– → (NH4)2[Co(SCN)4].
При этом раствор окрашивается в синий цвет. Если к полученному раствору прибавить амиловый спирт, то образовавшееся соединение извлекается спиртом и окрашивает его в синий цвет.
Эту реакцию можно провести капельным методом. На фильтровальную бумагу последовательно нанесите каплю анализируемого раствора и раствора NH4SCN. После этого бумагу аккуратно подсушите над плиткой или над пламенем спиртовки. При наличии ионов Со2+ пятно по мере высыхания окрашивается в синий цвет. При таком способе проведения реакции другие катионы не мешают обнаружению Со2+.
4. Обнаружение иона хрома (VI)
Если к раствору, содержащему хромат или бихромат-ионы, прибавить серную или азотную кислоту до рН 2-3, а затем пероксид водорода, то появляется синее окрашивание, обусловленное образованием пероксидного соединения хрома – надхромовой кислоты H2CrO6:
Cr2O2−7 + 4H2O2 + 2H+ → H2CrO6 + 3H2O.
Надхромовая кислота в водной среде быстро разлагается. Поэтому рекомендуется прибавлять несколько капель органического растворителя, в котором надхромовая кислота более устойчива. Эта реакция позволяет обнаружить ионы хрома (VI) в присутствии любых других ионов.
К 1-2 мл исследуемого раствора, подкисленного азотной кислотой, прибавьте несколько капель изоамилового спирта, 1-2 мл Н2О2 и раствор взболтайте. Окрашивание всплывающего наверх слоя органического растворителя в ярко-синий цвет свидетельствует о присутствии в растворе ионов шестивалентного хрома.
5. Обнаружение ионов Cu2+ взаимодействием с тиосульфатом натрия.
Тиосульфат натрия Na2S2O3 в кислой среде при нагревании образует с ионами Cu2+ черный осадок сульфида меди (I) Cu2S:
2Cu2+ + 2S2O32– + 2H2O → Cu2S↓ + S + 2SO42– + 4H+.
Поместите в пробирку 1-2 мл исследуемого раствора, несколько капель 1М раствора H2SO4 и 2-3 кристаллика Na2S2O3. Полученную смесь нагрейте почти до кипения. Образование черного осадка свидетельствует о наличии в растворе ионов Cu2+.
6. Обнаружение аниона Cl– окислением хлорид-ионов и образованием хлора
Сильные окислители (KMnO4, PbO2, KClO3 и др.) в кислой среде окисляют анион Cl– до свободного хлора, например:
10 Cl– + 2 MnO−4 + 16 H+ → 5 Cl2↑ + 2Mn2+ + 8 H2O.
Для обнаружения газообразного хлора можно использовать влажную йодкрахмальную бумагу, которая в присутствии хлора синеет в результате реакции
2I– + Cl2 → I2 + 2Cl– ;
I2 + крахмал → синее окрашивание.
К нескольким каплям испытуемого раствора добавьте такой же объем раствора KMnO4, 2-3 капли концентрированной H2SO4 и нагрейте (под тягой!). Посинение влажной йодкрахмальной бумаги, поднесенной к выходу из пробирки, свидетельствует о наличии хлорид-ионов в анализируемом растворе. Раствор KMnO4 в ходе реакции обесцвечивается, а при избытке окислителя образуется коричнево-бурый диоксид марганца.
7. Обнаружение ионов SO42- образованием малорастворимого сульфата бария.
Наиболее характерным свойством SO42- является образование нерастворимого в кислотах осадка BaSO4. Это свойство отличает сульфат-ион от всех других анионов:
Ba2+ + SO42- → BaSO4↓.
Реакция между SO42- и Ba2+ становится еще более специфичной при добавлении небольшого количества разбавленного раствора KMnO4. При этом образуются смешанные кристаллы красно-фиолетового цвета благодаря частичному захвату KMnO4 осаждающимся сульфатом бария. Окрашенные изоморфные кристаллы не обесцвечиваются при добавлении пероксида водорода, в то время как KMnO4, оставшийся в растворе, восстанавливается с образованием бесцветного Mn2+:
2MnO4- + 5 H2O2 + 6 H+ → 2Mn2+ + 8 H2O + 5 O2.
К 2-3 каплям испытуемого раствора, подкисленного уксусной кислотой, добавьте 2-3 капли 0,01н раствора KMnO4 и 1-2 капли нитрата бария, а через некоторое время 1-2 капли H2O2. Образование окрашенного красно-фиолетового осадка, не обесцвечивающегося при добавлении H2O2, свидетельствует о присутствии в испытуемом растворе сульфат-ионов.
8. Обнаружение ионов NO3- взаимодействием с сульфатом железа (П). Реакция бурого пятна.
Сульфат железа (II) FeSO4 в присутствии серной кислоты образует с NO3-комплексное соединение [Fe(NO)]SO4 бурого цвета:
6Fe2+ + 2NO3– + 8H+ → 6Fe3+ + 2NO + 4H2O,
Fe2+ + NO + SO42- → [Fe(NO)]SO4.
Реакции мешают анионы Br– и I–, которые дают сходные по окраске Br2 и I2.
В пробирку или на часовое стекло поместите 1-2 кристаллика FeSO4, добавьте 1-2 капли испытуемого раствора, а затем каплю концентрированной H2SO4. Образование вокруг кристаллов бурого кольца свидетельствует о присутствии нитрат-ионов.
Результаты опыта по качественному анализу сточной воды занесите в табл.27.
Таблица 27 – Результаты анализа по определению качественного состава сточной воды.
| Определяемый ион | Уравнение реакции | Условия проведения реакции | Ожидаемый эффект | Наблюдения | Вывод |
Задание 2. Нейтрализация щелочных сточных вод углекислым газом.
Для определения начальной концентрации исследуемой щелочной воды в коническую колбу для титрования налейте 5 мл щелочной воды, добавьте одну каплю фенолфталеина. Оттитруйте пробу 0,1 н раствором HCl до обесцвечивания, рассчитайте концентрацию гидроокиси в растворе по формуле:
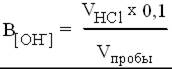
где VHCl - объем 0,1 н раствора HCl, израсходованной на титрование, мл; Vпробы - объем пробы, взятой на титрование, мл.
При помощи индикаторной бумаги определите рН. Затем в стакан налейте 200 мл щелочной воды и барботируйте СО2 из колбы Вюрца, предварительно пометив в нее мел и добавляя к нему соляную кислоту 1:4, где происходит реакция
2 HCl + СаСО3 → CaCl2 + H2O + CO2.
По окончании протекания реакции в колбе Вюрца отберите с помощью пипетки с грушей 10 мл воды, определите рН универсальным индикатором и наличие групп ОН- титрованием раствором HCl (аналогично исходной). Данные занесите в табл. 28.
Таблица 28 – Результаты нейтрализации щелочных вод
| № опыта | τ, мин | рН | VHCl, мл | ВOH- | η, % | MCO2 |
Количество углекислого газа, поглощенного щелочным раствором, рассчитайте по уравнению
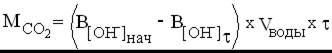
Степень нейтрализации вычислите по уравнению:
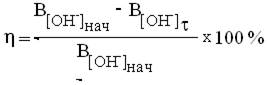
Напишите уравнение реакции нейтрализации.
Задание 3. Оценка устойчивости к загрязнению поверхностных вод.
Естественная устойчивость к загрязнению поверхностных вод зависит от природной специфики водного объекта: водности, скорости течения рек, прочности озер и водохранилищ, минерализации вод и т.д. Используя качественные характеристики водных объектов, оцененные в баллах с учетом коэффициента значимости (Кз), всю гидросеть края по устойчивости объектов поверхностных вод к техногенному загрязнению можно подразделить на три категории.
Ограниченная водность самых малых рек, замедленный водообмен и малая минерализация (100–200 мг/л) делают их весьма неустойчивыми к химическому и бактериологическому загрязнению. Сюда относятся воды всех озер и водохранилищ с минерализацией до 400 мг/л и объемом воды менее 50 млн. м3 независимо от их проточности. Все остальные водоемы и реки, в т.ч. большие со скоростью течения до 0,4 м/с, малой и средней минерализацией, характеризуются как неустойчивые. И лишь большие и быстрые реки обладают относительной устойчивостью к техногенному загрязнению.
Таблица 29 - Критерии оценки устойчивости поверхностных вод к техногенному загрязнению
| Критерии | Водные объекты | Характеристика состояния | Оценочный балл | Коэффициент значимости Кз | Балл с учетом Кз | |
| качественная | количественная | |||||
| Порядок водного объекта | Реки (длина, км.)* | Самые малые | До 25 | 0,5 |
2 | 1 |
| Малые | 25 – 100 | 1,5 | 3 | |||
| Средние | 100 – 500 | 2,5 | 5 | |||
| Большие | Более 500 | 3,0 | 7 | |||
| Озера, водохранилища (млн.м3) | Очень малые | 1 – 10 | 0,5 | 1 | ||
| Малые | 10 – 50 | 1,5 | 3 | |||
| Небольшие | 50 – 100 | 2,5 | 5 | |||
| Большие | Более 100 | 3,0 | 7 | |||
| Миграционные возможности водного объекта | Озера, водохра-нилища (проточность) | Бессточные | 0,28 |
1 | 0,28 | |
| Сточные | 0,85 | 0,85 | ||||
| Проточные | 1,42 | 1,42 | ||||
|
Реки (м/с) | До 0,2 | 2,0 | 2,0 | |||
| 0,2 – 0,4 | 2,57 | 2,57 | ||||
| 0,4 – 0,6 | 3,13 | 3,13 | ||||
| Более 0,6 | 3,71 | 3,71 | ||||
* Длина реки принимается от истоков до выхода из района исследований
Исходя из этого, воды малых рек и небольших водоемов не обладают достаточной устойчивостью к постоянному техногенному прессингу и нуждаются в обязательном выполнении защитных мер, рекомендованных для водоохранных зон малых рек. Ширина водоохранной зоны должна устанавливаться дифференцированно в зависимости от расположения области питания подземных вод, наличия притоков и мелких элементов речной сети, ценных природных объектов, промышленных и транспортных объектов, сложившейся на данном отрезке рекреационной нагрузки. Любое загрязнение в пределах внутренней водоохранной территории (прилегающей к руслу реки) проникает в поверхностный водоток и грунтовый водоносный горизонт, а такие участки характеризуются неудовлетворительной защищенностью подземных вод от проникновения поверхностных загрязнений.
Таблица 30 - Оценка устойчивости объектов поверхностных вод к техногенному загрязнению
| Водные объекты | Критерии оценки | Характеристика состояния | Оценочный балл с учетом Кз | Критерии оценки |
Характеристика состояния | Оценочный балл с учетом Кз | Суммарный балл | Степень устойчивости | |||
| качест-венная | количест-венная | ||||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | ||
| Реки | Длина водотока, км. |
Самые малые |
до 25 |
1,0 | Скорость течения (м/с) | До 0,2 | 2,0 | 3,0 | Весьма неустойчивый (менее 5) | ||
| 0, –0,4 | 2,57 | 3,57 | |||||||||
| Озера, водохранилища | Объем воды, млн.м3 |
Очень малые |
1–10 |
1,0 | Проточность | Бессточные | 0,28 | 1,28 | |||
| Сточные | 0,85 | 1,85 | |||||||||
| Проточные | 1,42 | 2,42 | |||||||||
|
Малые |
10-50 |
3,0 | Бессточные | 0,28 | 3,28 | ||||||
| Сточные | 0,85 | 3,85 | |||||||||
| Проточные | 1,42 | 4,42 | |||||||||
| Реки | Длина водотока, км. | Малые | 25-100 | 3,0 | Скорость течения (м/с) | 0,2-0,4 | 2,57 | 5,57 | Неустойчивые (5-10) | ||
| Средние | 100-500 | 5,0 | 0,4-0,6 | 2,57 | 7,57 | ||||||
| Большие | Более 500 | 7,0 | 0,4-0,6 | 3,13 | 8,13 | ||||||
| 0,2-0,4 | 2,57 | 9,57 | |||||||||
| Озера, водохранилища | Объем воды, млн.м3 | Небольшие | 50-100 | 5,0 | Проточность | Бессточные | 0,28 | 5,28 | |||
| Сточные | 0,85 | 5,85 | |||||||||
| Проточные | 1,42 | 6,42 | |||||||||
| Большие | Более 100 | 7,0 | Бессточные | 0,28 | 7,28 | ||||||
| Сточные | 0,85 | 7,85 | |||||||||
| Проточные | 1,42 | 8,45 | |||||||||
| Реки | Длина водо-тока, км. |
Большие | 500 Более 500 | 7,0 | Скорость течения (м/с) | 0,4-0,6 Более 0,6 | 3,13 3,71 | 10,13 10,71 | Относительно устойчивые (более 10) | ||
1. Определить устойчивость к техногенному загрязнению реки Енисей.
2. Определить устойчивость к техногенному загрязнению реки Кача.
3. Определить устойчивость к техногенному загрязнению Красноярского водохранилища.
Задание 4. Расчет необходимой степени очистки сточных вод.
Выполнение данной части работы выполняется в соответствии с вариантом, указанным преподавателем.
Задача 1. Найти разбавление сточных вод для глубинного сосредоточенного выпуска в проточное озеро, если даны: скорость течения vп (м/с), средняя глубина в месте выпуска Н (м), расчетный расход сточных вод Q (м3/с). Расчетный створ водопользования расположен на расстоянии L (м).
Данные для решения задачи приведены в табл.27.
Таблица 31 – Варианты задачи
| № п/п | vп | H | Q | L |
| 1 | 0,02 | 30 | 0,32 | 500 |
| 2 | 0,01 | 25 | 0,41 | 800 |
| 3 | 0,02 | 28 | 0,46 | 250 |
| 4 | 0,03 | 42 | 0,53 | 620 |
| 5 | 0,01 | 36 | 0,48 | 780 |
Задача 2. Какова должна быть температура сбрасываемых в водоем сточных вод, если максимальная летняя температура природной воды до места выпуска сточной равна 19°С, а кратность разбавления стоков составляет п = 25?
Результат решения задачи оформите в табл.32.
Таблица 32 - Расчета разбавления сточных вод в озерах и водохранилищах по методам М.А.Руффеля и Н.Н.Лапшева.
| Рассчитываемый параметр | формула | Численное значение |
| 1 | 2 | 3 |
| Диаметр отверстия выпуска, принимая vo = 2,5 м/с | do = 4 • Q/3,14 • 2,5 | |
| Параметр, зависящий от степени проточности водоема и нагрузки сточных вод на него | р = vn/(0,000015v0 + vn) | |
| Параметр, определяемый относительной глубиной водоема |
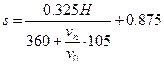
| |
| Наименьшее разбавление, наблюдающееся на расстоянии от места выпуска сточных вод | n = A(0,2L/d0)ps |
Таблица 33 - Расчет температуры сбрасываемых в водоем сточных вод
| Рассчитываемый параметр | формула | Численное значение |
| Температура сбрасываемых вод Тст | Тст ≤ пТдоп+Тмакс |
Требование к содержанию отчета. Отчеты по каждому заданию оформляются в соответствии с указанными выше требованиями.
Контрольные вопросы.
1. Охарактеризуйте роль, которую играет законодательство в комплексном использовании и охране водных ресурсов?
2. Что такое мониторинг водных объектов и кто его проводит?
3. Для чего составляются схемы комплексного использования и охраны вод? Их виды? Что такое бассейновое соглашение?
4. Перечислите мероприятия по охране поверхностных вод?
5. Для чего установлены водоохранные воды? Какую роль играют водоохранные лесные насаждения?
6. Какие сооружения входят в систему искусственной биологической очистки?
7. Перечислите мероприятия, проводимые с целью борьбы с истощением и загрязнением сточных вод.
8. Почему в настоящее время так остро стоит проблема охраны малых рек?
9. Перечислите методы очистки сточных вод предприятия.
10. Какие основные устройства применяются при механической очистке сточных вод?
11. Какие процессы используются при химической и физико-химической очистке сточных вод?
12. Охарактеризуйте роль бессточных производств в решении проблемы охраны водоемов.
4. Контрольные вопросы
Взаимодействие организма и среды
Фундаментальные свойства живых систем. Уровни биологической организации. Организм как дискретная самовоспроизводящаяся открытая система, связанная со средой обменом веществ, энергии и информации.
Разнообразие организмов. Источники энергии для организмов. Автотрофы и гетеротрофы. Фотосинтез и дыхание: кислород атмосферы как продукт фотосинтеза. Основные группы фотосинтезирующих организмов (планктонные цианобактерии и водоросли в морях и высшие растения на суше). Хемосинтез, жизнь в анаэробных условиях. Основные группы гетеротрофов (бактерии, грибы, животные). Трофические отношения между организмами: продуценты, консументы и редуценты.
Геометостаз (сохранение постоянства внутренней среды организма); принципы регуляции жизненных функций. Возможности адаптации организмов к изменениям условий среды. Генетические пределы адаптации. Эврибионты и стенобионты. Гомойо – и пойкилотермность. Принципы воспроизведения и развития различных организмов. Особенности зависимости от среды на разных стадиях жизненного цикла. Критические периоды развития.
Условия и ресурсы среды
Представление о физико-химической среде обитания организмов:
особенности водной, почвенной и воздушной сред. Абиотические и биотические факторы. Экологическое значение основных абиотических факторов: тепла, освещённости, влажности, солёности, концентрации биогенных элементов. Заменимые и незаменимые ресурсы. Сигнальное значение абиотических факторов. Суточная и сезонная цикличность.
Лимитирующие факторы. Правило Либиха. Взаимодействие экологических факторов. Распределение отдельных видов по градиенту условий. Представление об экологической нише; потенциальная и реализованная ниша. Организмы – индикаторы качества среды.
Популяции Определение понятий «биологический вид» и «популяция». Иерархическая структура популяций; расселение организмов и межпопуляционные связи. Популяция как элемент экосистемы.
Статистические характеристики популяции: численность, плотность, возрастной и половой состав. Биомасса и способы её выражения: сырой и сухой вес, энергетический эквивалент. Методы оценки численности и плотности популяции. Характер пространственного размещения особей и его выявление. Случайное и агрегированное распределение. Механизмы поддержания пространственной структуры. Территориальность, скопления животных и растений, причины их возникновения.
Динамические характеристики популяции: рождаемость, смертность, скорость популяционного роста. Таблицы и кривые выживания.
Характер распределения смертности по возрастам в разных группах животных и растений. Специфическая скорость роста популяции, «плотность насыщения» как показатель ёмкости среды. Динамика биомассы.
Понятие о биопродуктивности.
Сообщества
Биоценозы (сообщества), их таксономический состав и функциональная структура. Типы взаимоотношений между организмами: симбиоз, мутуализм, комменсализм, биотрофия (хищничество в широком смысле слова).
Межвидовая конкуренция. Эксплуатация и интерференция. Принцип конкурентного исключения. Условия существования конкурирующих видов. Конкуренция и распределение видов в природе.
Отношения «хищник-жертва». Сопряжённые колебания численности хищника и жертвы. Сопряжённая эволюция.
Видовая структура сообществ и способы её выявления. Видовое разнообразие как специфическая характеристика сообщества. Динамика сообществ во времени. Сериальные и климаксовые сообщества.
Определение понятия «Экосистема». Экосистемы как хорологические единицы биосферы. Составные компоненты экосистем, основные факторы, обеспечивающие их существование. Развитие экосистем: сукцессия.
Дата: 2019-07-24, просмотров: 385.