Следующий метод клеточной селекции — создание неполовых гибридов путем слияния изолированных протопластов, полученных из соматических клеток. Этот метод позволяет скрещивать филогенетически отдаленные виды растений, которые невозможно скрестить обычным половым путем, вызывать слияние трех и более родительских клеток, получать асимметричные гибриды, несущие весь генный набор одного из родителей наряду с несколькими хромосомами или генами, или только органеллами и цитоплазмой другого. Гибридизация соматических клеток дает возможность не только соединить в одном ядре гены далеких видов растений, но и сочетать в гибридной клетке цитоплазматические гены партнеров.
Слияние изолированных протопластов
Использование данного метода в селекции растений не ограничивается возможностью их индуцированного слияния и получения соматических гибридов. Изолированные протопласты способны поглощать из окружающей среды макромолекулы и органеллы, следовательно, в них можно вводить
чужеродную информацию, не пересаживая ДНК или органеллы других клеток. Уже проведена успешная трансплантация изолированных ядер в протопласты петунии и табака. Вместе с тем поглощение протопластами чужеродных ядер не всегда ведет к образованию гибридов. Кроме ядер в изолированные протопласты удалось трансплантировать чужеродные хлоропласты. В целом использование изолированных протопластов в генетической реконструкции клетки открывает богатые перспективы перед клеточной селекцией.
Разработки клеточных систем с высоким регенерационным потенциалом и методов оптимальной инициации каллусной ткани и растений - регенерантов для получения большого количества однородного материала за небольшое время.
Помимо этого, культура каллусных тканей является одним из наиболее удобных и наглядных объектов фундаментальных исследований. Она используется в различных по своей направленности экспериментах. Это и выявление общих закономерностей развития изолированных биологических систем, и на основе этих данных получение представлений о морфофизиологических и биохимических механизмах в природе.
Заключение
Использование культур клеток и тканей во многих работах позволяет проводить параллели между процессами in vitro и in vivo, моделировать и изучать метаболические процессы вне организменного контроля. Эти системы могут быть использованы как альтернатива природным источникам получения практически ценных соединений, в частности как модель биосинтеза и биогенетических связей в ряду вторичных метаболитов. Много работ проводилось в сфере изучения влияния различных факторов и химических агентов на биохимические и морфологические процессы в культуре тканей и клеток, с последующим переносом этих знаний на природные объекты. С помощью моделей in vitro возможно исследование геномных и хромосомных аббераций, изучение роли экзо- и эндофитогормонов (эксперименты по изменению и подбору питательных сред) на характеристики роста и развития растений.
Таким образом, культура клеток растений имеет огромное как практическое, так и фундаметально-научное значение. Безусловно, данный метод будет использоваться и модифицироваться, как удобный инструмент биотехнологической, биохимической и других категорий исследовательской деятельности.
Приложения
Техника культивирования растительного материала на искусственных питательных средах
Организация биотехнологической лаборатории
Для организации биотехнологической лаборатории необходимы просторные изолированные помещения, а также современное оборудование и высококачественные реактивы.
Для удобства проведения дезинфекции полы и стены в помещениях должны иметь кафельное покрытие, а потолок должен быть побелен.
Оборудование моечной комнаты: мойки с горячей и холодной водой; дистиллированная вода; дистилляторы и бидистилляторы; сушильные шкафы с режимом работы для сушки посуды – до 100-130оС, для инструментов – до 170оС; шкафы для хранения чистой посуды и инструментов, емкости для хранения моющих средств, вытяжные шкафы с эксикаторами. Оборудование комнаты для приготовления питательных сред: лабораторные столы; холодильники для хранения маточных растворов солей, гормонов и витаминов; аналитические и торсионные весы; иономер; магнитные мешалки; плитки, газовые горелки; набор посуды (колбы, стаканы, мерные цилиндры, мензурки, пробирки и др.), необходимый набор химических реактивов надлежащей степени чистоты (ХЧ, Ч, ЧДА).
Оборудование помещения для стерилизации: автоклавы с режимом работы – давление 1-2 атмосферы и температура 120оС; стеллажи для штативов с питательными средами; шкафы для хранения стерильных материалов. Данное помещение должно быть оборудовано приточно-вытяжной вентиляцией и иметь канализационный слив для отвода конденсата из автоклава.
Оборудование комнаты для инокуляции (перенесение) растительных эксплантов на питательные среды: ламинар-боксы, лабораторные столы, стеллажи, бактерицидные лампы, шкафы для материалов и оборудования.
Оборудование культуральных комнат: световое отделение – источники освещения со спектром близким к спектру дневного света (от 3 до 10 kLx), кондиционер для регуляции температуры (25+ - 2оС) и влажности воздуха (70 %), стеллажи для штативов с культивируемым материалом; темновое отделение – с тем же оборудованием, исключая источники освещения. Для культивирования эксплантов на питательной среде желательно использовать термостаты или хладотермостаты, способные с высокой точностью поддерживать задаваемые режимы температуры и влажности воздуха.
Необходимый набор посуды, инструментов и материалов в биотехнологической лаборатории: мерные колбы, колбы Эрленмейера, химические стаканы, мерные цилиндры, чашки Петри, пробирки, бутылки, пипетки, стеклянные палочки, стеклянные и мембранные фильтры, ланцеты (в том числе глазные, хирургические, анатомические), ножницы, пинцеты, ножи, бритвенные лезвия, препарировальные иглы, шпатели, бумага (оберточная, пергаментная, фильтровальная), фольга алюминиевая, вата, марля, шпагат.
Приготовление питательных сред для культивирования клеток и тканей in vitro.
Компоненты среды для выращивания растительных клеток и тканей можно разделить на 6 основных групп, что обычно отражает порядок приготовления концентрированных маточных растворов: макроэлементы, микроэлементы, источники железа, витамины, источники углерода, фитогормоны.
Основой для всех питательных сред для культивирования растительных эксплантов является смесь минеральных солей. Это соединения азота в виде нитратов, нитритов, солей аммония; фосфора – в виде фосфатов; серы – в виде сульфатов; а также растворимых солей К+, Na+, Са2+, Мg2+. Железо используется в виде хелатов [FeО4 или Fe2O4 + ЭДТА (этилендиаминтетрауксусная кислота) или её натриевая соль Na ЭДТА (трилон Б)] – наиболее доступной форме для усвоения растительными тканями.
Азот, фосфор, сера входят в состав органических соединений: белков, жиров, нуклеиновых кислот. Железо, цинк, марганец, молибден, кобальт в сочетании с порфиринами образуют макромолекулы пигментов фотосинтеза (хлорофилла), окислительно-восстановительных ферментов (каталазы, пероксидазы, полифенолоксидазы). Следовательно, все эти соединения выполняют в клетках и тканях структурную функцию. В то же время ионы К+, Na+, Са2+, Cl –, Н + необходимы для регуляции pH среды и поддержания физиологических градиентов клеток (тургора, осмотического давления, полярности).
В качестве источника углерода для биологических макромолекул, а также при культивировании гетеротрофных тканей (каллусов и суспензий) в питательные среды добавляют углеводы в концентрации 20-60 г/л. Обычно это дисахариды (сахароза), моносахариды (гексозы: глюкоза и фруктоза, пентозы: ксилоза и другие). Полисахариды в питательных средах практически не используются. Только некоторые типы тканей (опухолевые), содержащие гидролитические ферменты, выращивают на средах с крахмалом, раффинозой (природный трисахарид), целлобиозой.
Для стимуляции биохимических реакций в клетке используют биологические катализаторы – витамины группы В: В1, В6, В12; С (аскорбиновую кислоту), РР (никотиновую кислоту), мезоинозит (витаминоподобное соединение).
Тиамин (В1) входит в состав пируватдекарбоксилазы, участвует в превращениях углеводов. Тиаминпирофосфат входит в состав ферментов окислительного декарбоксилирования кетокислот (пировиноградной и кетоглутаровой), является коферментом транскетолазы (фермент пентозомонофосфатного пути).
Пиридоксин (В6) в виде фосфорнокислого эфира входит в состав ферментов декарбоксилирования и переаминирования аминокислот.
Никотиновая кислота (РР) в виде амида входит в состав дегидрогеназ НАД и НАДФ, катализирующих донорно-акцепторную электротранспортную цепь Н+ (отнятие Н+ от молекул органических веществ).
Для управления процессами формообразования в культуре тканей необходимы биологические регуляторы роста и развития – фитогормоны. Эти вещества влияют на дифференциацию и дедифференциацию клеток и тканей, инициируют гистогенез, индуцируют деление и растяжение клеток, участвуют в процессах старения и созревания, либо стимулируют, либо ингибируют рост и развитие клеточных культур, обуславливают формирование пола. В биотехнологических исследованиях чаще используют гормоны, стимулирующие рост и развитие: ауксины, цитокинины, гиббереллины.
Ауксины: ИУК – b-индолил-3-уксусная кислота, ИМК – индолил-3-мас-ляная кислота, НУК – a-нафтилуксусная кислота, 2,4-Д – 2,4-дихлорфеноксиуксусная кислота.
Цитокинины: кинетин – 6-фурфуриламинопурин, зеатин, NN-дифенил-мочевина, 6-БАП – 6-бензиламинопурин.
Гиббереллины: гиберрелловая кислота.
В качестве биологических добавок для индукции первичного каллуса можно использовать растительные экстракты (10-15 % от общего объёма среды): кокосовое молоко (жидкий эндосперм кокосового ореха), вытяжки из незрелых зерновок кукурузы (лучше в период молочной спелости), которые содержат цитокинины – кинетин и зеатин (6-ти замещенные аминопурины) и NN-дифенилмочевину.
В культуре in vitro применяют жидкие и агаризованные (твердые) среды. Жидкие среды используются для культивирования суспензий, каллусов, изолированных органов и тканей, растений - регенерантов. При этом для поддержания эксплантов в пробирки со средой помещают специальные мостики - поддержки из фильтровальной бумаги или синтетических пористых материалов.
Агаризованные среды готовят на основе агар-агара – полисахарида, входящего в состав морских водорослей, который образует с водой гель при pH 5,6-6,0. иногда в качестве уплотнителя и заменителя агар-агара используют полиакриламидные гели (биогели) P10 и P200.
Для искусственных питательных сред растворы макро- и микросолей готовят заранее и используют многократно. Это маточные (концентрированные) растворы. Их хранят в специальных условиях: макро- и микросоли в холодильнике в сосудах с притертыми пробками при 0…+4оС; витамины, фитогормоны, ферменты, растительные экстракты – при -20оС в небольших по 5-10 мл сосудах с пробками (пеницилловые флаконы).
Маточные растворы макросолей обычно превосходят рабочие по концентрации в 10-40 раз, микросолей – в 100-1000 раз, витаминов – в 1000 раз.
Растворы фитогормонов желательно готовить непосредственно перед работой со средами.
Для приготовления маточного раствора макро- и микросолей каждую соль растворяют в отдельном стаканчике при нагревании, затем сливают и доводят до нужного объема. В охлажденную смесь микросолей последним добавляют раствор солей молибдена, а в макросоли – раствор солей магния (для предотвращения выпадения осадка).
Маточные растворы хлористого кальция и хелата железа (сернокислое железо + ЭДТА, либо Na ЭДТА – трилон Б) готовят и хранят отдельно от других солей.
Концентрированные растворы витаминов готовят следующим образом: 10-кратные навески растворяют в 10 мл дистиллированной воды каждый отдельно.
Фитогормоны – это вещества, которые плохо растворяются в воде. Поэтому предварительно 100 мг вещества растворяют в небольших количествах (0,5-2,0 мл) спирта (ауксины, гиббереллины), 0,5-1н HCl или КОН (цитокинины), затем подогревают до полного растворения (кроме абсцизовой кислоты и кинетина) и доводят до 100 мл объема (1 мл содержит 1 мг вещества).
В таблице представлен состав наиболее часто используемых питательных сред. Как правило, начиная работать с новым объектом, исследователи модифицируют состав стандартных сред, особенно часто варьируя концентрации и набор органических компонентов.
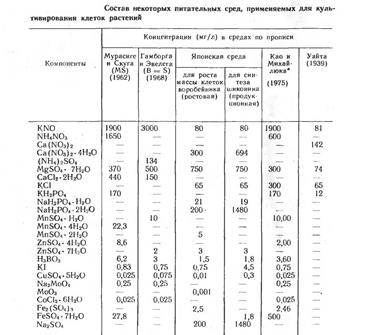
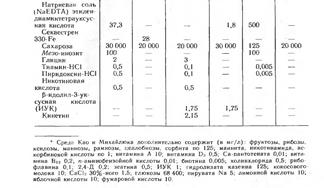
Частные примеры питательных сред.
Приготовление маточных растворов для среды Мурасиге-Скуга.
| № п.п. | Компонент среды | Количество вещества |
| Маточный раствор макросолей (г на 1 л маточного раствора) | ||
| 1. 2. 3. 4. | KNO3 NH4NО3 KH2PO4 MgSO4 . 7H2O или MgSO4 безводный | 38 33 3,4 7,4 3,6 |
| 5. | CaCl2 . 2H2O или CaCl2 безводный | 8,8 6,65 |
| Маточный раствор микросолей (мг на 100 мл маточного раствора) | ||
| 6. 7. 8. 9. 10. 11. 12. | Na2MoO4 . 2H2O CuSO4 . 5H2O H3BO3 MnSO4 . 5H2O или MnSO4 . 4H2O ZnSO4 . 7H2O KJ CoCl2 . 6H2O | 25 2,5 620 2410 2230 860 83 2,5 |
| 13. | FeSO4 Na2 ЭДТА | 557 745 |
Среда Мурасиге-Скуга (М-С) для клеточных и тканевых культур
| Компоненты питательной среды | |
| Маточный раствор макросолей Маточный раствор микросолей Fe-хеллат CaCl2 Тиамин-HCl Пиридоксин-HCl Никотиновая кислота Мезоинозит Глицин Сахароза | 50 мл/л 1 мл/л 5 мл/л 50 мл/л 0,1 мг/л 0,5 мг/л 0,5 мг/л 100 мг/л 2 мг/л 30 г/л |
| рН 5,6-5,8 | |
Модифицированная питательная среда Мурасиге-Скуга для культивирования апикальных меристем картофеля
| Компоненты питательной среды | |
| Маточный раствор макросолей Маточный раствор микросолей Fe-хеллат CaCl2 Тиамин-HCl Пиридоксин-HCl Витамин В12 Никотиновая кислота Фолиевая кислота Мезоинозит Гидролизат казеина Аденин Пантотенат Са Рибофлавин Биотин Активированный уголь ГК Кинетин Сахароза Глюкоза Агар-агар | 50 мл/л 1 мл/л 5 мл/л 50 мл/л 1 мг/л 1 мг/л 0,015 мг/л 2 мг/л 0,5 мг/л 100 мг/л 1 г/л 40 мг/л 10 мг/л 0,5 мг/л 1 мг/л 10 г/л 2 мг/л 0,5 мг/л 20 г/л 20 г/л 7 г/л |
| рН 5,7-5,8 | |
Модифицированная питательная среда Мурасиге-Скуга для микроразмножения картофеля черенкованием побегов
| Компоненты питательной среды | |
| Маточный раствор макросолей Маточный раствор микросолей Fe-хеллат CaCl2 Тиамин-HCl Пиридоксин-HCl Никотиновая кислота Аденин Кинетин Гибберелловая кислота Пантотенат Са | 50 мл/л 1 мл/л 5 мл/л 50 мл/л 1 мг/л 1 мг/л 2 мг/л 40 мг/л 0,5 мг/л 2 мг/л 10 мг/л |
| Активированный уголь Сахароза Агар-агар | 10 г/л 30 г/л 7 г/л |
| рН 5,8 | |
Приготовление маточных растворов для среды Гамборга-Эвелега.
| № п.п. | Компонент среды | Количество вещества |
| Маточный раствор макросолей (г на 1 л маточного раствора) | ||
| 1. 2. 3. 4. | KNO3 (NH4)2SO4 MgSO4 . 7H2O NaH2PO4 . H2O | 60 2,68 10,0 3,0 |
| 5. | CaCl2 . 2H2O | 3,0 |
| Маточный раствор микросолей (мг на 100 мл маточного раствора) | ||
| 6. 7. 8. 9. 10. 11. | Na2MoO4 . 2H2O CuSO4 . 5H2O H3BO3 MnSO4 . H2O ZnSO4 . 7H2O CoCl2 . 6H2O | 25 7,5 300 1000 200 2,5 |
| 12. | FeSO4 Na2 ЭДТА | 557 745 |
Среда Гамборга-Эвелега
| Компоненты питательной среды | |
| Маточный раствор макросолей Маточный раствор микросолей Fe-хеллат CaCl2 Тиамин-HCl Пиридоксин-HCl Никотиновая кислота Мезоинозит 2,4-Д Сахароза | 50 мл/л 1 мл/л 5 мл/л 50 мл/л 10 мг/л 1 мг/л 1 мг/л 100 мг/л 2 мг/л 20 г/л |
| рН 5,8 | |
Модифицированная питательная среда Мурасиге-Скуга для клубнеобразования у картофеля.
| Компоненты питательной среды | |
| Маточный раствор макросолей Маточный раствор микросолей Fe-хеллат CaCl2 Тиамин-HCl Пиридоксин-HCl Никотиновая кислота Аскорбиновая кислота Кинетин Сахароза Агар-агар | 50 мл/л 1 мл/л 5 мл/л 50 мл/л 1 мг/л 0,5 мг/л 0,5 мг/л 1 мг/л 0,5 мг/л 50 г/л 7 г/л |
| рН 5,8-6,0 | |
Приготовление маточных растворов для среды Блейдза.
| № п.п. | Компонент среды | Количество вещества |
| Маточный раствор макросолей (г на 1 л маточного раствора) | ||
| 1. 2. 3. 4. 5. | KNO3 KCl KH2PO4 NH4NO3 MgSO4 . 7H2O или MgSO4 безводный | 20 1,3 6 20 1,44 0,7 |
| 6. | Ca(NO3)2 . 4H2O | 10,28 |
| Маточный раствор микросолей (мг на 100 мл маточного раствора) | ||
| 7. 8. 9. 10. | H3BO3 MnSO4 . H2O или MnSO4 . 5H2O ZnSO4 . 7H2O KJ | 160 440 627 150 80 |
| 11. | FeSO4 Na2 ЭДТА | 557 745 |
Среда Блейдза для каллусогенеза.
| Компоненты питательной среды | |
| Маточный раствор макросолей Маточный раствор микросолей Fe-хеллат CaNO3 Тиамин-HCl Пиридоксин-HCl Никотиновая кислота Аскорбиновая кислота Мезоинозит 2,4-Д Сахароза Агар-агар | 50 мл/л 1 мл/л 5 мл/л 50 мл/л 0,5 мг/л 0,5 мг/л 1 мг/л 1 мг/л 0,1 г/л 2 мг/л 20 г/л 7 г/л |
| рН 6,0 | |
Среда Блейдза для соматического эбриогенеза.
| Компоненты питательной среды | |
| Маточный раствор макросолей Маточный раствор микросолей Fe-хеллат CaNO3 Тиамин-HCl Пиридоксин-HCl Никотиновая кислота Аскорбиновая кислота Мезоинозит ИУК Кинетин АБК Сахароза Агар-агар | 50 мл/л 1 мл/л 2,5 мл/л 50 мл/л 0,5 мг/л 0,5 мг/л 1 мг/л 1 мг/л 0,1 г/л 0,2 мг/л 0,2 мг/л 0,05 мг/л 20 г/л 7 г/л |
| рН 6,0 | |
Способы стерилизации в биотехнологии
Все работы с культурой клеток и тканей in vitro проводят в стерильных (асептических) условиях в стерильном боксе или ламинар-боксе, стерильными инструментами, в стерильной посуде, на стерильных питательных средах. В случае нарушения стерильности на средах хорошо развиваются микроорганизмы (грибы, бактерии), нарушающие состав среды и подавляющие рост растительных эксплантов.
Чаще всего для стерилизации помещений (боксов для пересадки тканей, культуральных комнат) используют ультрафиолетовое облучение в течение 0,5-2 часов (в зависимости от площади помещения). Работы в облученном помещении начинают через 15-20 минут после отключения бактерицидных ламп, так как под действием ультрафиолетового излучения двухатомный кислород воздуха становится трехатомным озоном – газом, токсичным для человека. Для достижения максимальной стерильности перед обработкой УФ все поверхности тщательно отмываются моющими средствами, водой и растворами хлорсодержащих веществ, поверхности ламинар-бокса обрабатывают 96 % спиртом.
Посуду, халаты, вату, бумагу, дистиллированную воду, питательные среды стерилизуют в автоклавах под давлением пара 1-2 атмосферы и температурой 120оС в течении 20-60 мин, в зависимости от объёма стерилизуемого материала.
Колбы, штативы со средой, вату, бумагу, халаты перед автоклавированием заворачивают в целлофановую бумагу, либо помещают в бюксы.
Металлические инструменты автоклавировать нельзя, так как под действием пара образуется ржавчина. Поэтому их стерилизуют сухим жаром в термостатах с температурой 170-250оС в течении 1-2 часов или на окрытом пламени горелки, что также не иене эффективно.
Способы стерилизации растительных эксплантов
С целью получения эксплантов для каллусной и опухолевой культур, микроклонального размножения, изучения гормональной регуляции используют стерильные проростки. Семена для проращивания высевают либо на воду, либо на питательную среду.
Растительные объекты перед стерилизацией тщательно отмывают проточной водой, иногда с моющими средствами, очищают от излишних тканей. С корнеплодов и корней снимают кожуру, с побегов – кору, с почек – кроющие чешуи.
Растительные экспланты стерилизуют растворами веществ, содержащими активный хлор (хлорамином, гипохлоритом Са и Nа, сулемой), бром (бромной водой), перекисью водорода, спиртом, нитратом серебра, диацидом, антибиотиками.
Этиловый спирт часто применяют для предварительной стерилизации, протирая им поверхность материала или погружая материал на несколько секунд в абсолютный спирт. Иногда такой стерилизации достаточно, ее используют при работе с плодами, семенами, побегами, завязями.
Гипохлорит кальция (хлорная известь) используется в виде 5-7 % раствора для обработки почек, завязей, цветков, семян, побегов в течение 5-8 минут.
Гипохлорит натрия используется в виде 0,5-5 % раствора для обработки любых эксплантов в течение 1-20 минут. Это вещество является клеточным ядом, поэтому время стерилизации и концентрацию подбирают экспериментально. Например: для изолированных зародышей используют 2-3 % раствор в течение 10-15 минут, а для сухих семян 3-5 % раствор в течение 1 часа. Остатки гипохлорита натрия сначала удаляют 0,01 н HCl, а затем 8 раз промывают автоклавированной дистиллированной водой.
Хлорамин применяют в концентрации 1-6 %. Пыльники и молодые зародыши обрабатывают в течение 1-3 минут, сухие семена – 30-60 минут, затем промывают стерильной дистиллированной водой 2-3 раза.
Сулема – токсичное вещество и требует особой тщательности, как при хранении, так и при подборе концентрации для отдельных объектов. Для стерилизации зародышей используют 0,1 % раствор в течение 1-3 минут, для корне- и клубнеплодов – до 10-20 минут.
Растворы, содержащие активный хлор используются 1 раз и готовят их непосредственно перед работой.
Диацид используется в 0,2 % растворе для стерилизации корнеплодов, семян, кусочков, тканей, верхушечных меристем, изолированных зародышей, пыльников. Диацид готовят, растворяя отдельно 330 мг этанолмеркурхлорида и 660 мг цетилпиридиния хлорида в горячей воде (330 мл), затем их смешивают и доводят объем жидкости до 1 л, добавляют несколько капель детергента твин-80; хранят в плотно закрытой колбе в темноте.
Также применяются 5%-й раствор формалина или фенола. Антибиотики применяют для стерилизации растительного материала, инфицированного бактериями (ткани корончатогалловых опухолей). Часто применяют стрептомицин и тетрамицин 10-80 мг/л, ампициллин 200-400 мг/л, левомицитин, каномицин и другие. Семена могут быть обработаны газами (оксид пропилена).
Стерилизацию можно разделить на три этапа:
- предварительная стерилизация исходного растительного материала. Условия обработки варьируют в зависимости от объекта. Хранящиеся органы промывают водопроводной водой, фрагменты стебля, корня или листа также промывают проточной водопроводной водой и помещают в спирт. Предварительная стерилизация семян – более длительная процедура, зависящая от степени их загрязнённости.
- собственно стерилизация. Предварительно простерилизованные ткани и органы помещают в стерилизующий раствор. Необходимое условие процесса стерилизации – это обеспечение достаточной степени чистоты объекта, и сохранность его жизнеспособности.
- Постстерилизация. Отмывание объекта от стерилизующего раствора порциями дистиллята.
Литература
1. Алёхина Н.Д., Балконин Ю.В., Гавриленко В.Ф. Физиология растений М.: Академия, 2005. С. 416-498, 588-593.
2. Комов В.П., Шведова В.Н. Биохимия М.: Дрофа, 2004. С 494-507.
3. Андреев В.П., Марков А.Г. Биология. Толковый словарь с английскими эквивалентами Санкт – Петербург: Лань, 1999.
4. Бутенко Р.Г. Биология культивируемых клеток и биотехнология растений М.: Наука, 1991. С. 166 – 183.
5. Гупало П.И., Скрипчинский В.В. Физиология индивидуального развития растений М.: Колос, 1971. С. 3 – 164.
6. Сорокина И.К., Старичкова Н.И., Решетникова Т.Б., Гринь Н.А. Основы биотехнологии растений. Культура растительных клеток и тканей. Учебное пособие М.: УМК биологического факультета СГУ им. Н.Г.Чернышевского, 2002. 45 с.
7. Шевелуха В.С., Калашникова Е.А., Дегтярев С.В. Сельскохозяйственная биотехнология М.: Высшая школа, 1998. С. 7 – 66.
8. Адамс Р. Методы культуры клеток для биохимиков М.: Мир, 1983. С. 16.
9. Бутенко Р.Г., Гусев М.В., Киркин А.Ф. Клеточная инженерия М.: Высшая школа, 1987. С. 7 – 49.
10. Егоров Н.С., Олескин А.В., Самуилов В.Д. Биотехнология. Проблемы и перспективы М.: Высшая школа, 1987. 150 с.
11. Носов А.М. Культура клеток высших растений – уникальная система, модель, инструмент //Физиология растений. 1999. Т. 46. №6. С. 837 – 844.
12. Соболева М.И., Логинов И.В. Статистические характеристики, маркирующие морфогенез в каллусных культурах яровой мягкой пшеницы //Физиология растений. 2004. Т. 51. № 2. С. 287 – 296.
13. Батыгина Т.Б. Эмбриогенез и морфогенез половых и соматических зародышей //Физиология растений. 1999. Т. 46. № 6. С. 884 – 898.
14. Копертех Л.Г., Стрибная Л.А. Регенерация растений из листовых эксплантов пшеницы //Физиология растений. 2003. Т. 50. № 3. С. 410 – 414.
15. Филиппова В.Н., Володина С.О., Смоленская И.Н. Экдистероиды в культурах клеток Serrtula Coronata и Ajuga Reptans //Химия растительного сырья. 2002. № 1. С. 57 – 62.
16. Мухитов А.Р. Влияние колхицина на генетическую стабильность и морфогенную активность каллусов Fagopyrum Tataricum (L.) Gaertn.: Автореферат дис… канд. биол. наук. Казань, 2000. 23 с.
17. Ветчинникова Л.В. Изучение роста и развития растений Карельской берёзы, полученных в культуре in vitro. Годичное собрание общества физиологов растений России и Международная научная конференция «Проблемы растений Севера». Петрозаводск, 2004. С. 40.
18. Медведев С.С. Полярный транспорт ИУК, как основа пространственно-временной организации процессов роста и морфогенеза растений. Годичное собрание общества физиологов растений России и Международная научная конференция «Проблемы растений Севера». Петрозаводск, 2004. С. 125.
19. Карначук Р.А., Тищенко С. Ю., Головацкая И.Ф. Эндогенные фитогормоны и регуляция морфогенеза синим светом //Физиология растений. 2001. Т. 48. №2. С. 262 – 267.
20. Дунаева С.Е., Лукьянова М.В., Ковалёва О.Н. Способность незрелых зародышей к образованию растений – регенерантов в культуре in vitro у ранее- и позднеспелых сортов ячменя. Регенерация растений в первичном каллусе, полученном от незрелых зародышей //Физиология растений. 2000. Т. 47. № 1. С. 53 – 57.
21. Власова Т.А., Гавриленко В.Ф., Ермаков И.П., Жигалова Т.В. Малый практикум по физиологии растений М.: Московский Университет, 1994. С.35 – 50.
Дата: 2019-07-24, просмотров: 367.