Содержание
Введение
Общее представление о росте и развитии
Дифференцировка.
Тотипотентность.
Культура каллусных тканей и их морфогенетические особенности.
Суспензионная культура.
Культуры отдельных клеток.
Применение культур растительной ткани. Фундаментальные и практические аспекты.
Вспомогательное использование методов in vitro в селекции растений.
Преодоление постгамной несовместимости.
Клональное микроразмножение отдаленных гибридов.
Гибридизация соматических клеток.
Слияние изолированных протопластов.
Заключение.
Приложения.
Литература.
Введение
Клеточная биотехнология базируется на использовании культуры клеток, тканей и протопластов. Для того чтобы манипулировать клетками, нужно выделить их из растения и создать такие условия, при которых они могли бы жить и размножаться вне растительного организма. Метод культивирования изолированных клеток и тканей на искусственных питательных средах в стерильных условиях (in vitro) получил название культуры изолированных тканей и приобрёл особое значение в связи с возможностью его использования в биотехнологии.
Культура клеток высших растений может рассматриваться с трёх точек зрения – как уникальная биологическая система, как модель в физиологии растений и как инструмент для разнообразных исследований и биотехнологий. Изолированные растительные клетки способны продуцировать ценные для медицины, парфюмерии и других отраслей промышленности вещества вторичного синтеза (вещества не участвующие в основном обмене веществ): алкалоиды, стероиды, гликозиды, гормоны, эфирные масла и т.д. Продуктивность культивируемых клеток в результате клеточной селекции может значительно превышать продуктивность целых растений. Использование изолированных культур клеток в селекции, дают возможность получать быстрорастущие растения, устойчивые к различным неблагоприятным факторам среды. Вместе с тем, это направление предусматривает создание новых растений путём слияния изолированных протопластов и получение соматических гибридов. Перенос в изолированные протопласты чужеродных генов с помощью методов генной инженерии позволяет получать в дальнейшем растения с новыми наследуемыми свойствами. Культура клеток как экспериментально созданная биологическая система интересна сама по себе и является объектом исследования узкого круга специалистов. Как модель, клетки in vitro представляют интерес для многих физиологов и биохимиков растений. Очевидно, что адекватно использовать культуру клеток как модель можно тогда, когда чётко представляешь её свойства, как биологической системы. И, наконец, как инструмент фундаментальных и прикладных исследований. Статус экспериментально созданной биологической системы обусловлен свойственной культурам клеток изменчивостью, наследуемостью возникших изменений, адаптивным отбором и эволюцией. В некотором роде её можно считать микропопуляцией, основное отличие которой от природных популяций - это отсутствие полового размножения особей, т.е. клеток. Можно выделить две принципиальные особенности культуры клеток растений как биологической системы: во-первых, отсутствие организменного контроля развития, и во-вторых - избыточный генетический материал. Культивируемые клетки и ткани могут служить адекватными моделями для исследований различных направленностей, например метаболизма и его регуляции в клетках и тканях целого растения. И для более глубокого понимания данных процессов и явлений часто используются методы создания биохимических мутантов, гибридных и трансформированных клеток в пределах исследуемой культуры. Простота клеточных моделей, возможность быстро получать достаточную массу в асептических, контролируемых по многим параметрам условиях являются преимуществами такого моделирования. В отношении синтеза вторичных метаболитов культуры клеток также обладают рядом достоинств, а именно возможность использования для этой цели растения, не произрастающие в наших природных условиях, и получать продукцию круглый год. Тем не менее, проблемы клеточных и молекулярных основ морфогенеза, не говоря уже о механизмах морфогенеза, остаются малоизученными. Прежде всего, это концепция тотипотентности растительной клетки и её влияние на стратегию исследовательской работы с культурой тканей и клеток растений. Постулат этой концепции о первичности внешнего сигнала в морфогенетическом ответе растительной клетки во многом определил экстенсивный характер исследований в области культуры клеток растений. Второй причиной является сложность морфогенетических процессов, которые позволяют моделировать и изучать культуры клеток и тканей. Известно, что в культуре in vitro может осуществляться реализация нескольких морфогенетических программ, а именно зародышевого развития и некоторого органогенеза. Возможность моделирования в культуре in vitro более простых процессов, например гистогенеза и цитодифференцировок представляется затруднительнее. Однако, в рамках исследования эти проблемы вполне преодолимы, при индивидуальной разработке методики и постановки эксперимента.
Дифференцировка
Термин дифференцировка был введён для обозначения процесса приобретения различий между клетками (тканями, органами, системами органов и т.д.). Предполагается, что есть начальное недифференцированное состояние, когда наблюдатель не может установить различий между клетками, затем появляются видимые различия клеток и они становятся дифференцированными. Традиционно недифференцированными считают: делящиеся клетки эмбриона; меристематические клетки апексов корня и стебля, камбия, феллогена, интеркалярных меристем; клетки,_неорганизованно делящиеся в экспериментальных условиях (суспензионная и каллусная культура in vitro).
Клетки, покинувшие зону деления, приступают к дифференцировке. Результат этого процесса можно увидеть, например, при образовании проводящей системы: возникает прокамбий, который дифференцируется на флоэму, ксилему и камбий. Во флоэме дифференцируются ситовидные элементы и клетки-спутницы, в ксилеме — паренхимные клетки и трахеиды, проводящий пучок может быть усилен дифференцирующимися механическими тканями и т.д. В данном примере клетки поэтапно приобретают анатомические различия в связи с выполняемыми функциями, многообразие клеток растет.
Анатомической дифференцировке предшествует биохимическая дифференцировка, когда видимых различий между клетками мало, но они, не одинаковы по содержанию тех или иных веществ. Удобнее следить за дифференциальной эспрессией генов: появлением новых или снижением уровня старых мРНК и белков. Эти данные позволяют зарегистрировать различия между клетками раньше, чем они станут видимыми на анатомическом уровне. Таким образом, дифференцировка начинается с изменения активности генома, экспрессии одних генов и подавления активности других.
При таком подходе делящиеся клетки меристемы придется считать дифференцированными, так как для прохождения клеточного цикла нужна определённая активность генома, которая и будет отличать эти клетки от других. Анатомы давно обратили внимание на неоднородность клеток меристемы. Можно сказать, что апикальная меристема корня дифференцирована на каллиптроген (инициали чехлика), дерматоген (инициали эпидермальной ткани), инициали коры, покоящийся центр и инициали осевого цилиндра. Для каждой из групп делящихся клеток характерны определенная локализация, направление веретена делений и тип производных клеток. Исследование меристемы методами молекулярной генетики показывает, что обнаруженная анатомами дифференцировка меристемы на зоны совпадает с зонами дифференциальной экспрессией определенных генов. Более того, саму меристему в целом можно достаточно четко выделить по зонам дифференциальной экспрессии. Таким образом, меристема является биохимически дифференцированной тканью.
Дифференциальная экспрессия генов — фундаментальное проявляение дифференцировки, и, как это ни парадоксально, недифференцированных клеток вообще не существует. Понятие «недифференцированный» хорошо работает только там, где в соответствии с задачами исследования исходные различия между клетками не учитывают (или нет методов их обнаружить).
Генетический анализ процесса развития предполагает его разложение на ряд промежуточных этапов, каждый из которых контролируется определённой генетической системой. Развитие есть результат совместной, возможно сменяющей друг друга активности двух генетических систем – первичной и вторичной. Под первичной системой понимается генетический контроль, жёстко регламентирующий переход развивающейся системы из одного состояния в другое, а под вторичной генетической регуляцией – способность системы достигать некоторого конечного состояния автоматически или авторегуляторно.
Геноконтролируемые этапы являются критическими периодами в развитии биологической системы, поскольку именно здесь происходят коренные изменения, связанные с формированием морфофункциональной структуры и определение принципов регулирования. В эти периоды создаются предпосылки негеноконтролируемых переходов системы, в которых она сохраняет свои качественные характеристики и свойства, а также демонстрирует низкую чувствительность к внешним и внутренним изменениям условий развития.
Итак, дифференцировкой можно назвать процесс изменения профиля генной активности, приводящий к дальнейшему изменению функции клеток.
Тотипотентность
В эмбриологии животных процесс дифференцировки изображают как сложный «ландшафт», по которому катится «шар». Шар — это символ клетки, дающей начало новому организму. В развилках шар «совершает выбор» и скатывается по одной из нескольких возможных траекторий. Так и клетки, возникшие при делении зиготы, направляются по одному из возможных путей дифференцировки. При этом клетки теряют «морфогенетический потенциал». Все «траектории» заканчиваются в «море», символизирующем смерть организма.
Если в начале пути у «шара» - клетки много потенциальных возможностей, то по мере приближения к «морю» их становится все меньше.
По имени ученого, предложившего такую аналогию, ее называют морфогенетическим ландшафтом Уоддингтона.
Процесс дифференцировки равносилен потере морфогенетического потенциала.
В отличие от клеток животных большинство клеток растений после анатомической дифференцировки легко переходят к делению. Такой процесс называют дедифференцировкой (потерей специализации). При механическом повреждении растения, а также в условиях эксперимента дедифференцировка приводит к образованию каллуса.
Из большинства клеток можно получить новый организм (для клеток животных это невозможно). Практически любая клетка многоклеточного организма содержит полный набор генов, необходимый для формирования организма, однако не каждая клетка может дать начало целому организму. Свойство клетки реализовать имеющуюся генетическую информацию и дать начало целому организму называют тотипотентностью. Тотипотентность клеток растения сравнительно легко реализовать, тогда, как большинство животных клеток не могут образовать новый организм. Таким образом, понятие дифференцировки как снижения морфогенетического потенциала, заимствованное из эмбриологии животных, не применимо к тотипотентным растительным клеткам, так как их морфогенетический потенциал долго остается высоким.
Идея о тотипотентности растительной клетки была выдвинута Г. Хаберландтом еще в 1902 г., хотя и не получила тогда экспериментального подтверждения. Согласно определению Хаберландта, любая клетка растения может дать начало новому организму, и если этого не наблюдается, то только потому, что растительный организм подавляет потенции клетки к развитию. Изоляция клеток от растений способствует проявлению этих потенций.
Суспензионная культура
Помимо культур каллусных клеток в научной практике довольно часто применяются культуры клеточных суспензий и культуры единичных (одиночных) клеток. Для начала рассмотрим суспензионную культуру.
Суспензию клеток можно получить из каллуса, поместив его в жидкую питательную среду с автоматическим перемешиванием. Суспензионную культуру получают непосредственно из ткани экспланта. Культура состоит из отдельных клеток и агрегатов, отделившихся от первично образованной каллусной ткани. Необходимым условием культивирования клеточных суспензий является постоянное перемешивание на качалке (90 – 120 об/мин), роллеров различного типа, или встряхивание среды. Если клеточная суспензия находится в неподвижном состоянии, то пролиферация суспензионных клеток приводит к образованию каллусной ткани. Также необходимыми условиями поддержания культуры является аэрация, оптимальные температуры (20-30оС), а также определенный объём и физиологическое состояние инокулюма (часть клеточной суспензии, используемая для переноса на свежую среду). Минимальный объём инокулюма, необходимый для роста культуры, зависит от вида объекта, фазы роста и состава культуральной среды. При слишком больших объёмах рост клеток в суспензии может ингибироваться из-за накопления токсичных продуктов метаболизма, либо из-за недостатка питательного субстрата.
Начальный момент получения суспензионной клеточной культуры является рандомическим событием. Это означает, что только клетки, которые по ряду причин способны к перестройке метаболизма и размножению с высоким коэффициентом в данных конкретных условиях суспензионного культивирования, образуют «хорошие» линии. Важными характеристиками иаких линий является высокая степень дезинтеграции (5-10 клеток в группе), морфологическая выравненность клеток. На рисунке показаны микрофотографии суспензионных клеток отвечающих этим критериям.
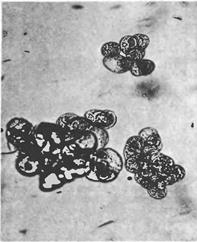
Морфологическая вариабельность клеток суспензионных культур не слишком высока: встречаются одиночные растянувшиеся клетки, содержащие огромную вакуоль и пристеночный слой цитоплазмы с крупным ядром; клетки меньшего размер, округлые или овальные, в той или иной степени вакуолизированные, с более плотной цитоплазмой, одиночные или образующие агрегаты.
Суспензии лучше образуются из рыхлого каллуса, получаемого на средах с 2,4-Д. Исключение из питательной среды ионов кальция облегчает суспензирование. Ещё больше облегчает этот процесс добавление в среду пектидазы, способной гидролизировать пектиновые связи в клеточной стенке.
Кривая роста клеток в суспензии, как и клетки каллусной культуры, имеет S--образную форму.
Выращивание клеточных суспензий в жидкой питательной среде имеет ряд преимуществ перед выращиванием каллусных тканей поверхностным способом. Здесь легче и более воспроизводимо влиять на метаболизм и рост клеточных популяций экзогенными факторами. Они удобнее для биохимических и молекулярно-биологических экспериментов – изучения индукции ферментов и связи их с событиями клеточного цикла, экспрессии и репрессии определённых генов, изолирования и характеристик мутантов.
Работы по культивированию и субкультивированию проводят в асептических условиях.
Первичную суспензию перед субкультивированием фильтруют через 1 — 2 слоя марли, нейлоновые или металлические сита, чтобы избавиться от крупных, плотных кусков каллусной ткани, остатков экспланта и очень крупных агрегатов. Фильтрование рекомендуется и в нескольких последующих субкультивированиях до приобретения клеточной суспензией желательных характеристик. Однако агрегированность суспензии зависит не только от характеристик начальной линии, но и от условий культивирования.
Способы выращивания, разработанные в микробиологии, применяются для глубинного культивирования растительных клеток. Используются закрытые или открытые системы в периодическом или проточном режимах. В закрытой системе при периодическом режиме выращивания клеточная масса (инокулюм) помещается в определенный объем среды. До конца выращивания система остается закрытой по всем параметрам, кроме газов. В закрытой культуре в систему периодически подается свежая питательная среда, а старая удаляется в том же объеме. Клетки при этом остаются в системе в течение всего цикла выращивания.
В открытые проточные культуры периодически (или непрерывно) поступает свежая питательная среда, однако отбирается не только старая среда, но и часть урожая клеточной массы. Регуляция этого процесса может осуществляться по принципу турбидостата или хемостата. В турбидостате подача свежей среды, и отбор суспензии происходят после достижения клеточной популяцией определенной заданной плотности. Сигнал на включение протока поступает от реле, связанного с оптической системой, определяющей плотность клеток. В хемостате скорость протока задается экспериментатором и от нее зависит скорость роста клеточной массы. Для этого питательная среда лимитируется по одному из наиболее важных для роста факторов, чаще всего по фосфору, азоту или сахару. Режим хемостата позволяет с помощью фиксированной скорости разбавления поддерживать константную скорость деления и плотность клеток в популяции.
Клеточные суспензии в биотехнологии используются для получения вторичных метаболитов, многие из которых являются ценными лекарственными препаратами, для промышленного выращивания клеточной биомассы и для клеточной селекции. Наряду с этим, суспензии клеток можно применять в качестве исходного материала для получения изолированных протопластов. Для промышленного получения продуктов вторичного синтеза из больших клеточных масс используют ферментеры большой емкости (от 20000 и более литров), в которых проводят непрерывное культивирование клеток. Суспензионные культуры могут быть не только источником ценных вторичных метаболитов, но в них выявлены также другте соединения, например, камптотецин, харрингтонин и другие антиканцерогены, пептиды (ингибитор протеаз, ингибитор фитовирусов) и др. Следует отметить, что деление клеток, приводящее к увеличению клеточной биомассы, и синтез вторичных метаболитов разобщены во времени. Синтез вторичных метаболитов достигает максимума в стационарной фазе роста.
Культуры отдельных клеток
Для генетических и физиологических исследований, а также для практического использования в клеточной селекции очень ценном является культивирование отдельных клеток.
Получение клона-потомства одиночной клетки помогает разобраться в причинах генетической неоднородности каллусных клеток, так как наблюдения в данном случае проводятся на ткани, полученной не из гетерогенного экспланта, а из одной клетки. Одиночная гибридная клетка, выделенная из культуры изолированных протопластов, при дальнейшем ее делении позволяет получить клон, состоящий из гибридных клеток. Это намного облегчает работу исследователя, так как устраняет необходимость отбора потомства в культуре изолированных протопластов от негибридных, что представляет значительные трудности. Кроме того, сам процесс соматической гибридизации лучше наблюдать, если работа ведется с одиночными протопластами. Выделяют одиночные клетки из клеточных суспензий, из тканей растений, например, из мезофилла листа после его мацерации ферментами, из культуры изолированных протопластов после восстановления клеточной стенки. Для получения одноклеточной фракции суспензионной культуры иногда достаточно простого отстаивания в колбе в течение 15—30 мин. При этом крупные агрегаты оседают на дно колбы, а надосадочная фракция содержит только одиночные клетки или мелкие агрегаты. В том случае, когда при отстаивании не удается получить одноклеточную фракцию, применяют мацерирующие ферменты, центрифугирование или фильтрование через сита (найлоновые или металлические).
Трудности культивирования одиночных клеток связаны с тем, что отдельная клетка не делится в тех условиях, в которых хорошо растет каллусная ткань. Для того чтобы заставить одиночные клетки делиться, разработаны специальные методы. Существует так называемый метод «няньки», при котором функцию «няньки», стимулирующей деление одиночной клетки, выполняют кусочки каллусной ткани, отделенные от нее фильтровальной бумагой. В присутствии «няньки» одиночная клетка делится и дает индивидуальную колонию клеток — клон. Другой метод основан на использовании очень малых объемов богатой питательной среды и представляет собой культивирование одиночных клеток в микрокапле в чашке Купрака объемом 20 мкл. Для индукции клеточных делений у одиночной клетки можно использовать также «кормящий слой» (активно делящиеся клетки суспензионной культуры того же вида растений, что и одиночная клетка):
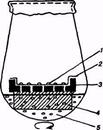
1 - колонии клеток
2 - фильтровальная бумага
3 - алюминиевая сетка
4 - пенополиуретан
5 - суспензия клеток
Заключение
Использование культур клеток и тканей во многих работах позволяет проводить параллели между процессами in vitro и in vivo, моделировать и изучать метаболические процессы вне организменного контроля. Эти системы могут быть использованы как альтернатива природным источникам получения практически ценных соединений, в частности как модель биосинтеза и биогенетических связей в ряду вторичных метаболитов. Много работ проводилось в сфере изучения влияния различных факторов и химических агентов на биохимические и морфологические процессы в культуре тканей и клеток, с последующим переносом этих знаний на природные объекты. С помощью моделей in vitro возможно исследование геномных и хромосомных аббераций, изучение роли экзо- и эндофитогормонов (эксперименты по изменению и подбору питательных сред) на характеристики роста и развития растений.
Таким образом, культура клеток растений имеет огромное как практическое, так и фундаметально-научное значение. Безусловно, данный метод будет использоваться и модифицироваться, как удобный инструмент биотехнологической, биохимической и других категорий исследовательской деятельности.
Приложения
Техника культивирования растительного материала на искусственных питательных средах
Организация биотехнологической лаборатории
Для организации биотехнологической лаборатории необходимы просторные изолированные помещения, а также современное оборудование и высококачественные реактивы.
Для удобства проведения дезинфекции полы и стены в помещениях должны иметь кафельное покрытие, а потолок должен быть побелен.
Оборудование моечной комнаты: мойки с горячей и холодной водой; дистиллированная вода; дистилляторы и бидистилляторы; сушильные шкафы с режимом работы для сушки посуды – до 100-130оС, для инструментов – до 170оС; шкафы для хранения чистой посуды и инструментов, емкости для хранения моющих средств, вытяжные шкафы с эксикаторами. Оборудование комнаты для приготовления питательных сред: лабораторные столы; холодильники для хранения маточных растворов солей, гормонов и витаминов; аналитические и торсионные весы; иономер; магнитные мешалки; плитки, газовые горелки; набор посуды (колбы, стаканы, мерные цилиндры, мензурки, пробирки и др.), необходимый набор химических реактивов надлежащей степени чистоты (ХЧ, Ч, ЧДА).
Оборудование помещения для стерилизации: автоклавы с режимом работы – давление 1-2 атмосферы и температура 120оС; стеллажи для штативов с питательными средами; шкафы для хранения стерильных материалов. Данное помещение должно быть оборудовано приточно-вытяжной вентиляцией и иметь канализационный слив для отвода конденсата из автоклава.
Оборудование комнаты для инокуляции (перенесение) растительных эксплантов на питательные среды: ламинар-боксы, лабораторные столы, стеллажи, бактерицидные лампы, шкафы для материалов и оборудования.
Оборудование культуральных комнат: световое отделение – источники освещения со спектром близким к спектру дневного света (от 3 до 10 kLx), кондиционер для регуляции температуры (25+ - 2оС) и влажности воздуха (70 %), стеллажи для штативов с культивируемым материалом; темновое отделение – с тем же оборудованием, исключая источники освещения. Для культивирования эксплантов на питательной среде желательно использовать термостаты или хладотермостаты, способные с высокой точностью поддерживать задаваемые режимы температуры и влажности воздуха.
Необходимый набор посуды, инструментов и материалов в биотехнологической лаборатории: мерные колбы, колбы Эрленмейера, химические стаканы, мерные цилиндры, чашки Петри, пробирки, бутылки, пипетки, стеклянные палочки, стеклянные и мембранные фильтры, ланцеты (в том числе глазные, хирургические, анатомические), ножницы, пинцеты, ножи, бритвенные лезвия, препарировальные иглы, шпатели, бумага (оберточная, пергаментная, фильтровальная), фольга алюминиевая, вата, марля, шпагат.
Приготовление питательных сред для культивирования клеток и тканей in vitro.
Компоненты среды для выращивания растительных клеток и тканей можно разделить на 6 основных групп, что обычно отражает порядок приготовления концентрированных маточных растворов: макроэлементы, микроэлементы, источники железа, витамины, источники углерода, фитогормоны.
Основой для всех питательных сред для культивирования растительных эксплантов является смесь минеральных солей. Это соединения азота в виде нитратов, нитритов, солей аммония; фосфора – в виде фосфатов; серы – в виде сульфатов; а также растворимых солей К+, Na+, Са2+, Мg2+. Железо используется в виде хелатов [FeО4 или Fe2O4 + ЭДТА (этилендиаминтетрауксусная кислота) или её натриевая соль Na ЭДТА (трилон Б)] – наиболее доступной форме для усвоения растительными тканями.
Азот, фосфор, сера входят в состав органических соединений: белков, жиров, нуклеиновых кислот. Железо, цинк, марганец, молибден, кобальт в сочетании с порфиринами образуют макромолекулы пигментов фотосинтеза (хлорофилла), окислительно-восстановительных ферментов (каталазы, пероксидазы, полифенолоксидазы). Следовательно, все эти соединения выполняют в клетках и тканях структурную функцию. В то же время ионы К+, Na+, Са2+, Cl –, Н + необходимы для регуляции pH среды и поддержания физиологических градиентов клеток (тургора, осмотического давления, полярности).
В качестве источника углерода для биологических макромолекул, а также при культивировании гетеротрофных тканей (каллусов и суспензий) в питательные среды добавляют углеводы в концентрации 20-60 г/л. Обычно это дисахариды (сахароза), моносахариды (гексозы: глюкоза и фруктоза, пентозы: ксилоза и другие). Полисахариды в питательных средах практически не используются. Только некоторые типы тканей (опухолевые), содержащие гидролитические ферменты, выращивают на средах с крахмалом, раффинозой (природный трисахарид), целлобиозой.
Для стимуляции биохимических реакций в клетке используют биологические катализаторы – витамины группы В: В1, В6, В12; С (аскорбиновую кислоту), РР (никотиновую кислоту), мезоинозит (витаминоподобное соединение).
Тиамин (В1) входит в состав пируватдекарбоксилазы, участвует в превращениях углеводов. Тиаминпирофосфат входит в состав ферментов окислительного декарбоксилирования кетокислот (пировиноградной и кетоглутаровой), является коферментом транскетолазы (фермент пентозомонофосфатного пути).
Пиридоксин (В6) в виде фосфорнокислого эфира входит в состав ферментов декарбоксилирования и переаминирования аминокислот.
Никотиновая кислота (РР) в виде амида входит в состав дегидрогеназ НАД и НАДФ, катализирующих донорно-акцепторную электротранспортную цепь Н+ (отнятие Н+ от молекул органических веществ).
Для управления процессами формообразования в культуре тканей необходимы биологические регуляторы роста и развития – фитогормоны. Эти вещества влияют на дифференциацию и дедифференциацию клеток и тканей, инициируют гистогенез, индуцируют деление и растяжение клеток, участвуют в процессах старения и созревания, либо стимулируют, либо ингибируют рост и развитие клеточных культур, обуславливают формирование пола. В биотехнологических исследованиях чаще используют гормоны, стимулирующие рост и развитие: ауксины, цитокинины, гиббереллины.
Ауксины: ИУК – b-индолил-3-уксусная кислота, ИМК – индолил-3-мас-ляная кислота, НУК – a-нафтилуксусная кислота, 2,4-Д – 2,4-дихлорфеноксиуксусная кислота.
Цитокинины: кинетин – 6-фурфуриламинопурин, зеатин, NN-дифенил-мочевина, 6-БАП – 6-бензиламинопурин.
Гиббереллины: гиберрелловая кислота.
В качестве биологических добавок для индукции первичного каллуса можно использовать растительные экстракты (10-15 % от общего объёма среды): кокосовое молоко (жидкий эндосперм кокосового ореха), вытяжки из незрелых зерновок кукурузы (лучше в период молочной спелости), которые содержат цитокинины – кинетин и зеатин (6-ти замещенные аминопурины) и NN-дифенилмочевину.
В культуре in vitro применяют жидкие и агаризованные (твердые) среды. Жидкие среды используются для культивирования суспензий, каллусов, изолированных органов и тканей, растений - регенерантов. При этом для поддержания эксплантов в пробирки со средой помещают специальные мостики - поддержки из фильтровальной бумаги или синтетических пористых материалов.
Агаризованные среды готовят на основе агар-агара – полисахарида, входящего в состав морских водорослей, который образует с водой гель при pH 5,6-6,0. иногда в качестве уплотнителя и заменителя агар-агара используют полиакриламидные гели (биогели) P10 и P200.
Для искусственных питательных сред растворы макро- и микросолей готовят заранее и используют многократно. Это маточные (концентрированные) растворы. Их хранят в специальных условиях: макро- и микросоли в холодильнике в сосудах с притертыми пробками при 0…+4оС; витамины, фитогормоны, ферменты, растительные экстракты – при -20оС в небольших по 5-10 мл сосудах с пробками (пеницилловые флаконы).
Маточные растворы макросолей обычно превосходят рабочие по концентрации в 10-40 раз, микросолей – в 100-1000 раз, витаминов – в 1000 раз.
Растворы фитогормонов желательно готовить непосредственно перед работой со средами.
Для приготовления маточного раствора макро- и микросолей каждую соль растворяют в отдельном стаканчике при нагревании, затем сливают и доводят до нужного объема. В охлажденную смесь микросолей последним добавляют раствор солей молибдена, а в макросоли – раствор солей магния (для предотвращения выпадения осадка).
Маточные растворы хлористого кальция и хелата железа (сернокислое железо + ЭДТА, либо Na ЭДТА – трилон Б) готовят и хранят отдельно от других солей.
Концентрированные растворы витаминов готовят следующим образом: 10-кратные навески растворяют в 10 мл дистиллированной воды каждый отдельно.
Фитогормоны – это вещества, которые плохо растворяются в воде. Поэтому предварительно 100 мг вещества растворяют в небольших количествах (0,5-2,0 мл) спирта (ауксины, гиббереллины), 0,5-1н HCl или КОН (цитокинины), затем подогревают до полного растворения (кроме абсцизовой кислоты и кинетина) и доводят до 100 мл объема (1 мл содержит 1 мг вещества).
В таблице представлен состав наиболее часто используемых питательных сред. Как правило, начиная работать с новым объектом, исследователи модифицируют состав стандартных сред, особенно часто варьируя концентрации и набор органических компонентов.
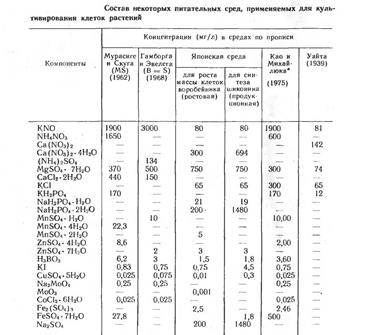
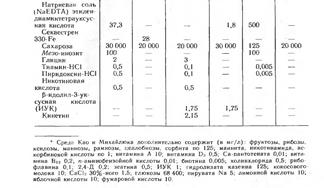
Частные примеры питательных сред.
Приготовление маточных растворов для среды Мурасиге-Скуга.
| № п.п. | Компонент среды | Количество вещества |
| Маточный раствор макросолей (г на 1 л маточного раствора) | ||
| 1. 2. 3. 4. | KNO3 NH4NО3 KH2PO4 MgSO4 . 7H2O или MgSO4 безводный | 38 33 3,4 7,4 3,6 |
| 5. | CaCl2 . 2H2O или CaCl2 безводный | 8,8 6,65 |
| Маточный раствор микросолей (мг на 100 мл маточного раствора) | ||
| 6. 7. 8. 9. 10. 11. 12. | Na2MoO4 . 2H2O CuSO4 . 5H2O H3BO3 MnSO4 . 5H2O или MnSO4 . 4H2O ZnSO4 . 7H2O KJ CoCl2 . 6H2O | 25 2,5 620 2410 2230 860 83 2,5 |
| 13. | FeSO4 Na2 ЭДТА | 557 745 |
Среда Мурасиге-Скуга (М-С) для клеточных и тканевых культур
| Компоненты питательной среды | |
| Маточный раствор макросолей Маточный раствор микросолей Fe-хеллат CaCl2 Тиамин-HCl Пиридоксин-HCl Никотиновая кислота Мезоинозит Глицин Сахароза | 50 мл/л 1 мл/л 5 мл/л 50 мл/л 0,1 мг/л 0,5 мг/л 0,5 мг/л 100 мг/л 2 мг/л 30 г/л |
| рН 5,6-5,8 | |
Модифицированная питательная среда Мурасиге-Скуга для культивирования апикальных меристем картофеля
| Компоненты питательной среды | |
| Маточный раствор макросолей Маточный раствор микросолей Fe-хеллат CaCl2 Тиамин-HCl Пиридоксин-HCl Витамин В12 Никотиновая кислота Фолиевая кислота Мезоинозит Гидролизат казеина Аденин Пантотенат Са Рибофлавин Биотин Активированный уголь ГК Кинетин Сахароза Глюкоза Агар-агар | 50 мл/л 1 мл/л 5 мл/л 50 мл/л 1 мг/л 1 мг/л 0,015 мг/л 2 мг/л 0,5 мг/л 100 мг/л 1 г/л 40 мг/л 10 мг/л 0,5 мг/л 1 мг/л 10 г/л 2 мг/л 0,5 мг/л 20 г/л 20 г/л 7 г/л |
| рН 5,7-5,8 | |
Модифицированная питательная среда Мурасиге-Скуга для микроразмножения картофеля черенкованием побегов
| Компоненты питательной среды | |
| Маточный раствор макросолей Маточный раствор микросолей Fe-хеллат CaCl2 Тиамин-HCl Пиридоксин-HCl Никотиновая кислота Аденин Кинетин Гибберелловая кислота Пантотенат Са | 50 мл/л 1 мл/л 5 мл/л 50 мл/л 1 мг/л 1 мг/л 2 мг/л 40 мг/л 0,5 мг/л 2 мг/л 10 мг/л |
| Активированный уголь Сахароза Агар-агар | 10 г/л 30 г/л 7 г/л |
| рН 5,8 | |
Приготовление маточных растворов для среды Гамборга-Эвелега.
| № п.п. | Компонент среды | Количество вещества |
| Маточный раствор макросолей (г на 1 л маточного раствора) | ||
| 1. 2. 3. 4. | KNO3 (NH4)2SO4 MgSO4 . 7H2O NaH2PO4 . H2O | 60 2,68 10,0 3,0 |
| 5. | CaCl2 . 2H2O | 3,0 |
| Маточный раствор микросолей (мг на 100 мл маточного раствора) | ||
| 6. 7. 8. 9. 10. 11. | Na2MoO4 . 2H2O CuSO4 . 5H2O H3BO3 MnSO4 . H2O ZnSO4 . 7H2O CoCl2 . 6H2O | 25 7,5 300 1000 200 2,5 |
| 12. | FeSO4 Na2 ЭДТА | 557 745 |
Среда Гамборга-Эвелега
| Компоненты питательной среды | |
| Маточный раствор макросолей Маточный раствор микросолей Fe-хеллат CaCl2 Тиамин-HCl Пиридоксин-HCl Никотиновая кислота Мезоинозит 2,4-Д Сахароза | 50 мл/л 1 мл/л 5 мл/л 50 мл/л 10 мг/л 1 мг/л 1 мг/л 100 мг/л 2 мг/л 20 г/л |
| рН 5,8 | |
Модифицированная питательная среда Мурасиге-Скуга для клубнеобразования у картофеля.
| Компоненты питательной среды | |
| Маточный раствор макросолей Маточный раствор микросолей Fe-хеллат CaCl2 Тиамин-HCl Пиридоксин-HCl Никотиновая кислота Аскорбиновая кислота Кинетин Сахароза Агар-агар | 50 мл/л 1 мл/л 5 мл/л 50 мл/л 1 мг/л 0,5 мг/л 0,5 мг/л 1 мг/л 0,5 мг/л 50 г/л 7 г/л |
| рН 5,8-6,0 | |
Приготовление маточных растворов для среды Блейдза.
| № п.п. | Компонент среды | Количество вещества |
| Маточный раствор макросолей (г на 1 л маточного раствора) | ||
| 1. 2. 3. 4. 5. | KNO3 KCl KH2PO4 NH4NO3 MgSO4 . 7H2O или MgSO4 безводный | 20 1,3 6 20 1,44 0,7 |
| 6. | Ca(NO3)2 . 4H2O | 10,28 |
| Маточный раствор микросолей (мг на 100 мл маточного раствора) | ||
| 7. 8. 9. 10. | H3BO3 MnSO4 . H2O или MnSO4 . 5H2O ZnSO4 . 7H2O KJ | 160 440 627 150 80 |
| 11. | FeSO4 Na2 ЭДТА | 557 745 |
Среда Блейдза для каллусогенеза.
| Компоненты питательной среды | |
| Маточный раствор макросолей Маточный раствор микросолей Fe-хеллат CaNO3 Тиамин-HCl Пиридоксин-HCl Никотиновая кислота Аскорбиновая кислота Мезоинозит 2,4-Д Сахароза Агар-агар | 50 мл/л 1 мл/л 5 мл/л 50 мл/л 0,5 мг/л 0,5 мг/л 1 мг/л 1 мг/л 0,1 г/л 2 мг/л 20 г/л 7 г/л |
| рН 6,0 | |
Среда Блейдза для соматического эбриогенеза.
| Компоненты питательной среды | |
| Маточный раствор макросолей Маточный раствор микросолей Fe-хеллат CaNO3 Тиамин-HCl Пиридоксин-HCl Никотиновая кислота Аскорбиновая кислота Мезоинозит ИУК Кинетин АБК Сахароза Агар-агар | 50 мл/л 1 мл/л 2,5 мл/л 50 мл/л 0,5 мг/л 0,5 мг/л 1 мг/л 1 мг/л 0,1 г/л 0,2 мг/л 0,2 мг/л 0,05 мг/л 20 г/л 7 г/л |
| рН 6,0 | |
Способы стерилизации в биотехнологии
Все работы с культурой клеток и тканей in vitro проводят в стерильных (асептических) условиях в стерильном боксе или ламинар-боксе, стерильными инструментами, в стерильной посуде, на стерильных питательных средах. В случае нарушения стерильности на средах хорошо развиваются микроорганизмы (грибы, бактерии), нарушающие состав среды и подавляющие рост растительных эксплантов.
Чаще всего для стерилизации помещений (боксов для пересадки тканей, культуральных комнат) используют ультрафиолетовое облучение в течение 0,5-2 часов (в зависимости от площади помещения). Работы в облученном помещении начинают через 15-20 минут после отключения бактерицидных ламп, так как под действием ультрафиолетового излучения двухатомный кислород воздуха становится трехатомным озоном – газом, токсичным для человека. Для достижения максимальной стерильности перед обработкой УФ все поверхности тщательно отмываются моющими средствами, водой и растворами хлорсодержащих веществ, поверхности ламинар-бокса обрабатывают 96 % спиртом.
Посуду, халаты, вату, бумагу, дистиллированную воду, питательные среды стерилизуют в автоклавах под давлением пара 1-2 атмосферы и температурой 120оС в течении 20-60 мин, в зависимости от объёма стерилизуемого материала.
Колбы, штативы со средой, вату, бумагу, халаты перед автоклавированием заворачивают в целлофановую бумагу, либо помещают в бюксы.
Металлические инструменты автоклавировать нельзя, так как под действием пара образуется ржавчина. Поэтому их стерилизуют сухим жаром в термостатах с температурой 170-250оС в течении 1-2 часов или на окрытом пламени горелки, что также не иене эффективно.
Способы стерилизации растительных эксплантов
С целью получения эксплантов для каллусной и опухолевой культур, микроклонального размножения, изучения гормональной регуляции используют стерильные проростки. Семена для проращивания высевают либо на воду, либо на питательную среду.
Растительные объекты перед стерилизацией тщательно отмывают проточной водой, иногда с моющими средствами, очищают от излишних тканей. С корнеплодов и корней снимают кожуру, с побегов – кору, с почек – кроющие чешуи.
Растительные экспланты стерилизуют растворами веществ, содержащими активный хлор (хлорамином, гипохлоритом Са и Nа, сулемой), бром (бромной водой), перекисью водорода, спиртом, нитратом серебра, диацидом, антибиотиками.
Этиловый спирт часто применяют для предварительной стерилизации, протирая им поверхность материала или погружая материал на несколько секунд в абсолютный спирт. Иногда такой стерилизации достаточно, ее используют при работе с плодами, семенами, побегами, завязями.
Гипохлорит кальция (хлорная известь) используется в виде 5-7 % раствора для обработки почек, завязей, цветков, семян, побегов в течение 5-8 минут.
Гипохлорит натрия используется в виде 0,5-5 % раствора для обработки любых эксплантов в течение 1-20 минут. Это вещество является клеточным ядом, поэтому время стерилизации и концентрацию подбирают экспериментально. Например: для изолированных зародышей используют 2-3 % раствор в течение 10-15 минут, а для сухих семян 3-5 % раствор в течение 1 часа. Остатки гипохлорита натрия сначала удаляют 0,01 н HCl, а затем 8 раз промывают автоклавированной дистиллированной водой.
Хлорамин применяют в концентрации 1-6 %. Пыльники и молодые зародыши обрабатывают в течение 1-3 минут, сухие семена – 30-60 минут, затем промывают стерильной дистиллированной водой 2-3 раза.
Сулема – токсичное вещество и требует особой тщательности, как при хранении, так и при подборе концентрации для отдельных объектов. Для стерилизации зародышей используют 0,1 % раствор в течение 1-3 минут, для корне- и клубнеплодов – до 10-20 минут.
Растворы, содержащие активный хлор используются 1 раз и готовят их непосредственно перед работой.
Диацид используется в 0,2 % растворе для стерилизации корнеплодов, семян, кусочков, тканей, верхушечных меристем, изолированных зародышей, пыльников. Диацид готовят, растворяя отдельно 330 мг этанолмеркурхлорида и 660 мг цетилпиридиния хлорида в горячей воде (330 мл), затем их смешивают и доводят объем жидкости до 1 л, добавляют несколько капель детергента твин-80; хранят в плотно закрытой колбе в темноте.
Также применяются 5%-й раствор формалина или фенола. Антибиотики применяют для стерилизации растительного материала, инфицированного бактериями (ткани корончатогалловых опухолей). Часто применяют стрептомицин и тетрамицин 10-80 мг/л, ампициллин 200-400 мг/л, левомицитин, каномицин и другие. Семена могут быть обработаны газами (оксид пропилена).
Стерилизацию можно разделить на три этапа:
- предварительная стерилизация исходного растительного материала. Условия обработки варьируют в зависимости от объекта. Хранящиеся органы промывают водопроводной водой, фрагменты стебля, корня или листа также промывают проточной водопроводной водой и помещают в спирт. Предварительная стерилизация семян – более длительная процедура, зависящая от степени их загрязнённости.
- собственно стерилизация. Предварительно простерилизованные ткани и органы помещают в стерилизующий раствор. Необходимое условие процесса стерилизации – это обеспечение достаточной степени чистоты объекта, и сохранность его жизнеспособности.
- Постстерилизация. Отмывание объекта от стерилизующего раствора порциями дистиллята.
Литература
1. Алёхина Н.Д., Балконин Ю.В., Гавриленко В.Ф. Физиология растений М.: Академия, 2005. С. 416-498, 588-593.
2. Комов В.П., Шведова В.Н. Биохимия М.: Дрофа, 2004. С 494-507.
3. Андреев В.П., Марков А.Г. Биология. Толковый словарь с английскими эквивалентами Санкт – Петербург: Лань, 1999.
4. Бутенко Р.Г. Биология культивируемых клеток и биотехнология растений М.: Наука, 1991. С. 166 – 183.
5. Гупало П.И., Скрипчинский В.В. Физиология индивидуального развития растений М.: Колос, 1971. С. 3 – 164.
6. Сорокина И.К., Старичкова Н.И., Решетникова Т.Б., Гринь Н.А. Основы биотехнологии растений. Культура растительных клеток и тканей. Учебное пособие М.: УМК биологического факультета СГУ им. Н.Г.Чернышевского, 2002. 45 с.
7. Шевелуха В.С., Калашникова Е.А., Дегтярев С.В. Сельскохозяйственная биотехнология М.: Высшая школа, 1998. С. 7 – 66.
8. Адамс Р. Методы культуры клеток для биохимиков М.: Мир, 1983. С. 16.
9. Бутенко Р.Г., Гусев М.В., Киркин А.Ф. Клеточная инженерия М.: Высшая школа, 1987. С. 7 – 49.
10. Егоров Н.С., Олескин А.В., Самуилов В.Д. Биотехнология. Проблемы и перспективы М.: Высшая школа, 1987. 150 с.
11. Носов А.М. Культура клеток высших растений – уникальная система, модель, инструмент //Физиология растений. 1999. Т. 46. №6. С. 837 – 844.
12. Соболева М.И., Логинов И.В. Статистические характеристики, маркирующие морфогенез в каллусных культурах яровой мягкой пшеницы //Физиология растений. 2004. Т. 51. № 2. С. 287 – 296.
13. Батыгина Т.Б. Эмбриогенез и морфогенез половых и соматических зародышей //Физиология растений. 1999. Т. 46. № 6. С. 884 – 898.
14. Копертех Л.Г., Стрибная Л.А. Регенерация растений из листовых эксплантов пшеницы //Физиология растений. 2003. Т. 50. № 3. С. 410 – 414.
15. Филиппова В.Н., Володина С.О., Смоленская И.Н. Экдистероиды в культурах клеток Serrtula Coronata и Ajuga Reptans //Химия растительного сырья. 2002. № 1. С. 57 – 62.
16. Мухитов А.Р. Влияние колхицина на генетическую стабильность и морфогенную активность каллусов Fagopyrum Tataricum (L.) Gaertn.: Автореферат дис… канд. биол. наук. Казань, 2000. 23 с.
17. Ветчинникова Л.В. Изучение роста и развития растений Карельской берёзы, полученных в культуре in vitro. Годичное собрание общества физиологов растений России и Международная научная конференция «Проблемы растений Севера». Петрозаводск, 2004. С. 40.
18. Медведев С.С. Полярный транспорт ИУК, как основа пространственно-временной организации процессов роста и морфогенеза растений. Годичное собрание общества физиологов растений России и Международная научная конференция «Проблемы растений Севера». Петрозаводск, 2004. С. 125.
19. Карначук Р.А., Тищенко С. Ю., Головацкая И.Ф. Эндогенные фитогормоны и регуляция морфогенеза синим светом //Физиология растений. 2001. Т. 48. №2. С. 262 – 267.
20. Дунаева С.Е., Лукьянова М.В., Ковалёва О.Н. Способность незрелых зародышей к образованию растений – регенерантов в культуре in vitro у ранее- и позднеспелых сортов ячменя. Регенерация растений в первичном каллусе, полученном от незрелых зародышей //Физиология растений. 2000. Т. 47. № 1. С. 53 – 57.
21. Власова Т.А., Гавриленко В.Ф., Ермаков И.П., Жигалова Т.В. Малый практикум по физиологии растений М.: Московский Университет, 1994. С.35 – 50.
Содержание
Введение
Общее представление о росте и развитии
Дифференцировка.
Тотипотентность.
Культура каллусных тканей и их морфогенетические особенности.
Суспензионная культура.
Культуры отдельных клеток.
Применение культур растительной ткани. Фундаментальные и практические аспекты.
Вспомогательное использование методов in vitro в селекции растений.
Преодоление постгамной несовместимости.
Клональное микроразмножение отдаленных гибридов.
Гибридизация соматических клеток.
Слияние изолированных протопластов.
Заключение.
Приложения.
Литература.
Введение
Клеточная биотехнология базируется на использовании культуры клеток, тканей и протопластов. Для того чтобы манипулировать клетками, нужно выделить их из растения и создать такие условия, при которых они могли бы жить и размножаться вне растительного организма. Метод культивирования изолированных клеток и тканей на искусственных питательных средах в стерильных условиях (in vitro) получил название культуры изолированных тканей и приобрёл особое значение в связи с возможностью его использования в биотехнологии.
Культура клеток высших растений может рассматриваться с трёх точек зрения – как уникальная биологическая система, как модель в физиологии растений и как инструмент для разнообразных исследований и биотехнологий. Изолированные растительные клетки способны продуцировать ценные для медицины, парфюмерии и других отраслей промышленности вещества вторичного синтеза (вещества не участвующие в основном обмене веществ): алкалоиды, стероиды, гликозиды, гормоны, эфирные масла и т.д. Продуктивность культивируемых клеток в результате клеточной селекции может значительно превышать продуктивность целых растений. Использование изолированных культур клеток в селекции, дают возможность получать быстрорастущие растения, устойчивые к различным неблагоприятным факторам среды. Вместе с тем, это направление предусматривает создание новых растений путём слияния изолированных протопластов и получение соматических гибридов. Перенос в изолированные протопласты чужеродных генов с помощью методов генной инженерии позволяет получать в дальнейшем растения с новыми наследуемыми свойствами. Культура клеток как экспериментально созданная биологическая система интересна сама по себе и является объектом исследования узкого круга специалистов. Как модель, клетки in vitro представляют интерес для многих физиологов и биохимиков растений. Очевидно, что адекватно использовать культуру клеток как модель можно тогда, когда чётко представляешь её свойства, как биологической системы. И, наконец, как инструмент фундаментальных и прикладных исследований. Статус экспериментально созданной биологической системы обусловлен свойственной культурам клеток изменчивостью, наследуемостью возникших изменений, адаптивным отбором и эволюцией. В некотором роде её можно считать микропопуляцией, основное отличие которой от природных популяций - это отсутствие полового размножения особей, т.е. клеток. Можно выделить две принципиальные особенности культуры клеток растений как биологической системы: во-первых, отсутствие организменного контроля развития, и во-вторых - избыточный генетический материал. Культивируемые клетки и ткани могут служить адекватными моделями для исследований различных направленностей, например метаболизма и его регуляции в клетках и тканях целого растения. И для более глубокого понимания данных процессов и явлений часто используются методы создания биохимических мутантов, гибридных и трансформированных клеток в пределах исследуемой культуры. Простота клеточных моделей, возможность быстро получать достаточную массу в асептических, контролируемых по многим параметрам условиях являются преимуществами такого моделирования. В отношении синтеза вторичных метаболитов культуры клеток также обладают рядом достоинств, а именно возможность использования для этой цели растения, не произрастающие в наших природных условиях, и получать продукцию круглый год. Тем не менее, проблемы клеточных и молекулярных основ морфогенеза, не говоря уже о механизмах морфогенеза, остаются малоизученными. Прежде всего, это концепция тотипотентности растительной клетки и её влияние на стратегию исследовательской работы с культурой тканей и клеток растений. Постулат этой концепции о первичности внешнего сигнала в морфогенетическом ответе растительной клетки во многом определил экстенсивный характер исследований в области культуры клеток растений. Второй причиной является сложность морфогенетических процессов, которые позволяют моделировать и изучать культуры клеток и тканей. Известно, что в культуре in vitro может осуществляться реализация нескольких морфогенетических программ, а именно зародышевого развития и некоторого органогенеза. Возможность моделирования в культуре in vitro более простых процессов, например гистогенеза и цитодифференцировок представляется затруднительнее. Однако, в рамках исследования эти проблемы вполне преодолимы, при индивидуальной разработке методики и постановки эксперимента.
Общее представление о росте и развитии
О росте растений, казалось бы, можно судить по увеличению общей биомассы. Однако этот показатель весьма неоднозначен, поскольку сырая биомасса может не только увеличиваться, но и уменьшаться. Ещё один показатель роста – это увеличение числа клеток. Если число клеток растёт, можно уверенно говорить о росте, но постоянное число клеток ещё не говорит об отсутствии роста: в зоне растяжения увеличение числа клеток незначительно, тем не менее, рост идёт. О росте можно судить по увеличению линейных размеров – высоты растения, длины корня, ширины листа и т.д.
Таким образом, ростом можно называть необратимое увеличение растения хотя бы по одному из параметров: число клеток, линейные размеры, сырая/сухая биомасса.
Упрощённой моделью изменения параметров роста от времени является «кривая роста». Более подробно я буду говорить о ней ниже. Следует только отметить, что характер этой кривой способен резко меняться, в связи с действием на растение массы внешних факторов. Общая кривая роста, часто оказывается составленной разномасштабными S – образными участками. Таким образом, кривая роста целого растения обычно имеет более сложную форму.
Дифференцировка
Термин дифференцировка был введён для обозначения процесса приобретения различий между клетками (тканями, органами, системами органов и т.д.). Предполагается, что есть начальное недифференцированное состояние, когда наблюдатель не может установить различий между клетками, затем появляются видимые различия клеток и они становятся дифференцированными. Традиционно недифференцированными считают: делящиеся клетки эмбриона; меристематические клетки апексов корня и стебля, камбия, феллогена, интеркалярных меристем; клетки,_неорганизованно делящиеся в экспериментальных условиях (суспензионная и каллусная культура in vitro).
Клетки, покинувшие зону деления, приступают к дифференцировке. Результат этого процесса можно увидеть, например, при образовании проводящей системы: возникает прокамбий, который дифференцируется на флоэму, ксилему и камбий. Во флоэме дифференцируются ситовидные элементы и клетки-спутницы, в ксилеме — паренхимные клетки и трахеиды, проводящий пучок может быть усилен дифференцирующимися механическими тканями и т.д. В данном примере клетки поэтапно приобретают анатомические различия в связи с выполняемыми функциями, многообразие клеток растет.
Анатомической дифференцировке предшествует биохимическая дифференцировка, когда видимых различий между клетками мало, но они, не одинаковы по содержанию тех или иных веществ. Удобнее следить за дифференциальной эспрессией генов: появлением новых или снижением уровня старых мРНК и белков. Эти данные позволяют зарегистрировать различия между клетками раньше, чем они станут видимыми на анатомическом уровне. Таким образом, дифференцировка начинается с изменения активности генома, экспрессии одних генов и подавления активности других.
При таком подходе делящиеся клетки меристемы придется считать дифференцированными, так как для прохождения клеточного цикла нужна определённая активность генома, которая и будет отличать эти клетки от других. Анатомы давно обратили внимание на неоднородность клеток меристемы. Можно сказать, что апикальная меристема корня дифференцирована на каллиптроген (инициали чехлика), дерматоген (инициали эпидермальной ткани), инициали коры, покоящийся центр и инициали осевого цилиндра. Для каждой из групп делящихся клеток характерны определенная локализация, направление веретена делений и тип производных клеток. Исследование меристемы методами молекулярной генетики показывает, что обнаруженная анатомами дифференцировка меристемы на зоны совпадает с зонами дифференциальной экспрессией определенных генов. Более того, саму меристему в целом можно достаточно четко выделить по зонам дифференциальной экспрессии. Таким образом, меристема является биохимически дифференцированной тканью.
Дифференциальная экспрессия генов — фундаментальное проявляение дифференцировки, и, как это ни парадоксально, недифференцированных клеток вообще не существует. Понятие «недифференцированный» хорошо работает только там, где в соответствии с задачами исследования исходные различия между клетками не учитывают (или нет методов их обнаружить).
Генетический анализ процесса развития предполагает его разложение на ряд промежуточных этапов, каждый из которых контролируется определённой генетической системой. Развитие есть результат совместной, возможно сменяющей друг друга активности двух генетических систем – первичной и вторичной. Под первичной системой понимается генетический контроль, жёстко регламентирующий переход развивающейся системы из одного состояния в другое, а под вторичной генетической регуляцией – способность системы достигать некоторого конечного состояния автоматически или авторегуляторно.
Геноконтролируемые этапы являются критическими периодами в развитии биологической системы, поскольку именно здесь происходят коренные изменения, связанные с формированием морфофункциональной структуры и определение принципов регулирования. В эти периоды создаются предпосылки негеноконтролируемых переходов системы, в которых она сохраняет свои качественные характеристики и свойства, а также демонстрирует низкую чувствительность к внешним и внутренним изменениям условий развития.
Итак, дифференцировкой можно назвать процесс изменения профиля генной активности, приводящий к дальнейшему изменению функции клеток.
Тотипотентность
В эмбриологии животных процесс дифференцировки изображают как сложный «ландшафт», по которому катится «шар». Шар — это символ клетки, дающей начало новому организму. В развилках шар «совершает выбор» и скатывается по одной из нескольких возможных траекторий. Так и клетки, возникшие при делении зиготы, направляются по одному из возможных путей дифференцировки. При этом клетки теряют «морфогенетический потенциал». Все «траектории» заканчиваются в «море», символизирующем смерть организма.
Если в начале пути у «шара» - клетки много потенциальных возможностей, то по мере приближения к «морю» их становится все меньше.

По имени ученого, предложившего такую аналогию, ее называют морфогенетическим ландшафтом Уоддингтона.
Процесс дифференцировки равносилен потере морфогенетического потенциала.
В отличие от клеток животных большинство клеток растений после анатомической дифференцировки легко переходят к делению. Такой процесс называют дедифференцировкой (потерей специализации). При механическом повреждении растения, а также в условиях эксперимента дедифференцировка приводит к образованию каллуса.
Из большинства клеток можно получить новый организм (для клеток животных это невозможно). Практически любая клетка многоклеточного организма содержит полный набор генов, необходимый для формирования организма, однако не каждая клетка может дать начало целому организму. Свойство клетки реализовать имеющуюся генетическую информацию и дать начало целому организму называют тотипотентностью. Тотипотентность клеток растения сравнительно легко реализовать, тогда, как большинство животных клеток не могут образовать новый организм. Таким образом, понятие дифференцировки как снижения морфогенетического потенциала, заимствованное из эмбриологии животных, не применимо к тотипотентным растительным клеткам, так как их морфогенетический потенциал долго остается высоким.
Идея о тотипотентности растительной клетки была выдвинута Г. Хаберландтом еще в 1902 г., хотя и не получила тогда экспериментального подтверждения. Согласно определению Хаберландта, любая клетка растения может дать начало новому организму, и если этого не наблюдается, то только потому, что растительный организм подавляет потенции клетки к развитию. Изоляция клеток от растений способствует проявлению этих потенций.
Дата: 2019-07-24, просмотров: 291.