Насыщенные монокарбоновые кислоты представляют собой бесцветные жидкие или кристаллические вещества с острым своеобразным запахом, высшие карбоновые кислоты (С15 – С13) имеют слабый запах стеарина. Они имеют весьма высокие температуры кипения, что свидетельствует о значительной межмолекулярной ассоциации.
Таблица 1. Физические константы некоторых насыщенных монокарбоновых кислот
| Соединение | Т.пл.С | Т. кип., С | d |
| НСООН | 8,4 | 100,7 | 1,22 |
| СН3СООН | 16,6 | 118,1 | 1,049 |
| СН3СН2СООН | -22,4 | 141,1 | 0,992 |
| СН3СН2СН2СООН | -7,9 | 163,5 | 0,959 |
| СН3СН(СН3)СООН | -47 | 154,5 | 0,949 |
| СН3СН2СН2СН2СООН | -34,5 | 187 | 0,942 |
| СН3СН(СН3)СН2СООН | -37,6 | 176,7 | 0,937(15 °С) |
| СН3(СН2)14СООН | 64 | 271(13,3 кПа) | 0,853(62 °С) |
| СН3(СН2)16СООН | 69,4 | 291(13,3 кПа) | 0,847(69 °С) |
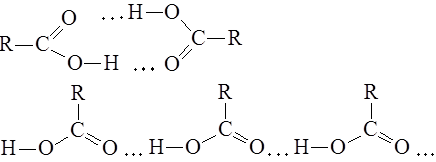 |
вследствие образования межмолекулярных водородных связей, причем образуются как циклические димеры, так и линейные олигомеры:
Электронографическое изучение карбоновых кислот показало, что в их молекуле имеются карбонильная и гидроксильная группы, при этом связь С=О длиннее, чем в кетонах, а связь С-О короче, чем в спиртах. Это свидетельствует о взаимодействии электронных систем атома кислорода и С=О - группы:
Неподеленная пара электронов кислородного атома гидроксильной
группы взаимодействует с p -электронами карбонильной группы, поэтому проявляет донорный эффект (+М). Это увеличивает полярность связи О-Н , но в то же время в некоторой степени уменьшает положительный
заряд по сравнению с карбонильными соединениями на углеродном атоме. Одновременно действует электроно-акцепторный индуктивный эффект
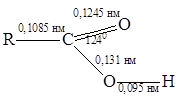 |
(-1) кислородных атомов.
Следовательно, в карбоксильной группе имеются сильно поляризованные положительно водородный атом и углеродный атом, которые являются электрофильными центрами, и неподеленные электронные пары двух кислородных атомов, которые являются нуклеофильными центрами. Предполагают, что кислородный атом карбонильной группы имеет более нуклеофильный характер. [6]
Химические свойства.
Для монокарбоновых кислот характерна многосторонняя реакционная способность. Главным образом это определяется реакциями карбоксильной группы (отщепление и присоединение протона, нуклеофильные реакции у карбонильной группы):
НO
RСCЭлектрофилы
OH
ННуклеофилы Известны также реакции замещения углеродного атома. Возможен термический разрыв связей (декарбоксилирование, образование кетенов) и другого типа разрушения карбоксильной группы.
Кислотность и основность. Карбоновые кислоты обладают кислыми свойствами, что и отражено в названии. В растворах происходит ионизация с образованием сольватированного протона и аниона – карбоксилот-иона:



 O:O: 1/2
O:O: 1/2



 R - C+ : SolR - C+ HSol+
R - C+ : SolR - C+ HSol+
 OHO: 1/2
OHO: 1/2
 Карбоксилат-ион построен симметрично и имеет систему сопряженных связей. Обычно его изображают проще:
Карбоксилат-ион построен симметрично и имеет систему сопряженных связей. Обычно его изображают проще:
илиR – COO -
В строении карбоксилат-иона много общего со строением нитрогруппы.
Ниже приведены константы ионизации некоторых карбоновых кислот в водный растворах в единицах рКа (Н2О, 25°С)
| Кислота | pKa | Кислота | pKa |
 НСООН
СН3СООН
СН3СН2СООН
СН3СН2СН2СООН НСООН
СН3СООН
СН3СН2СООН
СН3СН2СН2СООН
| 3, 75 4, 76 4, 87 4, 82 | (СH3)3ССООН | 5, 03 4, 83 4, 90 |
Наиболее сильной из монокарбоновых кислот является муравьиная. Введение алкильных групп уменьшает кислотность, что объясняется электронодонорным действием алкильных групп.
В водных растворах соли карбоновых кислот чистично гидролизуются:
 RCOO – Na + H2O RCOOH + Na + OH
RCOO – Na + H2O RCOOH + Na + OH
Для названия солей карбоновых кислот применяют ривиальные латинские названия кислот. Если таких названий нет, используют названия с суффиксом-карбоксилат.
Таблица 2 Примеры номенклатуры солей карбоновых кислот
| Карбоксилат | Название солей |
НСОО-М+Формиаты
СН3СОО-М+Ацетаты
СН3СН2СОО-М+Пропионаты
СН3СН2СН2СОО-М+Бутираты
СН3СН(СН3)СОО-М+Изобутираты
СН3СН2СН2СН2СОО-М+Валераты
(СН3)3ССОО-М+Пивалаты
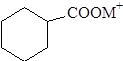
Циклогексанкарбоксилаты
В кислой среде (рН меньше 3) ионизация кислот практически не происходит, а может осуществиться присоединение протона к карбонильной группе:
OO . . . H SO4O - H
R - C+ H HSO4 RC R - C + HSO4
O - H O - HO - H
Вначале образуются прочные водородные связи, но при увеличении кислотности среды растет концентрация протонированной карбоновой кислоты.
Образование водородной связи и тем более протонированой формы значительно увеличивает положительный заряд на углеродном атоме карбонильной группы и электрофильность этой группы. Это можно изобразить при помощи резонансных структур:
O - HO - HO - H
R - CR - CR - C
O - HO - HO -H
В протонированной форме оба кислородных атома фактически становятся одинаковыми:
O - H
R - C(2b + 2b + b = 1)
O - H
Основность карбоновых кислот (рКвн+ = -6) сравнима с основностью кетонов (рКвн+= -6. . . –8), но значительно ниже основности простых эфиров (рКвн+ = -2. . . –4).
Так, в растворе 1 моль/л серной кислоты концентрация протонированой формы карбоновой кислоты не превышает 0,001 %, а в растворе 70%-ной серой кислоты протонировано около 50% карбоновой кислоты.
Несмотря на малую концентрацию протонированой формы, присутствие небольших количеств сильных кислот исключительным образом влияет на реакционную способность карбоновых кислот (образование сложных эфиров и др.). Очевидно, большую роль играет также образование водородной связи. [7]
Важнейшие представители. Муравьиная кислота – бесцветная едкая жидкость с острым запахом, смешивающаяся с водой. Впервые выделена в ХУП в. из красных муравьев перегонкой с водяным паром. В природе встречается в свободном состоянии также в крапиве.
Муравьиная кислота - надежное оружие рыжих муравьев. Ядовитая железа такого муравья содержит от 20 до 70% муравьиной кислоты, это главный компонент его «оборонного средства». Именно им муравьи парализуют добычу. Муравьиная кислота встречается также в некоторых растениях, в частности в жгучей крапиве. [8]
Источники накопления муравьиной кислоты в атмосфере- выхлопные газы автомобилей и различные промышленные дымы, претерпевающие химические превращения под действием солнечных лучей.
Получают муравьиную кислоту из гидроксида натрия и оксида углерода нагреванием под давлением:
100 - 105 °CH2SO4
Na + OH + COНСОО – Na +HCOOH
0,5 - 1, 0МПа
Оксид углерода и спирты в присутствии алкоксидов образуют сложные эфиры муравьиной кислоты:
RO - Na + , 80 oC
CO + ROH НСООR
3, 0 МПа
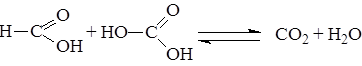 |
Муравьиная кислота в отличие от других карбоновых кислот содержит атом водорода у углеродного атома, формально группу Н – С в молекуле муравьиной кислоты можно рассматривать как альдегидную группу. Вследствие этого муравьиная кислота обладает восстанавливающими свойствами, при действии окислителей превращается в СО2 и Н=О:
Своеобразной реакцией муравьиной кислоты является распад на СО и Н2О при взаимодействии с концентрированной серной кислотой:
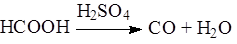 |
Муравьиная кислота широко используется в органическом синтезе, например для получения формамида, диметилформамида, щавелевой кислоты. [9]
Уксусная кислота – одно из первых органических соединений, которое было выделено в относительно чистом виде и описано уже в ХI в. алхимиками как продукт перегонки натурального уксуса. В 1845 г. немецкий химик А.Кольбе осуществил ее синтез. Водный раствор этой кислоты известен как столовый уксус. Безводная уксусная кислота затвердевает при температуре = 17 С. Ее часто называют «ледяной» уксусной кислотой. Метод приготовления ледяной уксусной кислоты, вошедший в Российскую фармакопею, был разработан в 1784г.
Уксусная кислота представляет собой бесцветную жидкость с острым запахом и кислым вкусом, неограниченно смешивающуюся с водой. Безводную уксусную кислоту называют «ледяной», так как при 16 °С на замерзает и образует кристаллы, подобные льду. Обычная уксусная кислота, содержащая 2-3% воды, замерзает при температуре ниже 13 °С.
Уксусная кислота известна издавна. Ее разбавленные водные растворы образуются при брожении вина. При перегонке водных растворов получают приблизительно 80%-ную кислоту («уксусную эссенцию»), которую применяют для пищевых целей.
Синтетическую уксусную кислоту для нужд химической промышленности получают различными методами. Один из методов заключается в окислении уксусного альдегида, который, в свою очередь, получают из этилена окислением в присутствии РdСl2 или из ацетилена:
РdCl2; CuCl2OН2О; Кат.
СН2 = СН2CH3CНС = СН
H2O; O2H
O2; Кат.
Кат.: t0О2; Кат.
СН3ОН + СОСН3СООНСН3СН2СН2СН3
Второй метод заключается в карбонилировании метанола. Третий метод – каталитическое окисление бутана.
Уксусную кислоту используют в качестве растворителя и как исходное вещество для синтеза производных уксусной кислоты (ацетилхлорида, ацетангидрида, амидов, сложных эфиров). Соли уксусной кислоты (ацетаты) применяют в текстильной промышленности в качестве протравителей и в синтезе как основные катализаторы. [3]
Масляная кислота - бесцветная жидкость с острым запахом, при большом разбавлении для нее характерен неприятный запах старого сливочного масла и пота. Масляная кислота встречается в природе в виде сложных эфиров; эфиры глицерина и масляной кислоты входят в состав жиров и сливочного масла. Масляную кислоту получают окислением бутанола-1 или карбонилированием пропанола-1. Используют в органическом синтезе для получения ароматных сложных эфиров. Изовалериановая кислота – бесцветная жидкость с острым запахом, в разбавленном виде имеет своеобразный запах валерианы. Встречается в природе в корнях валерианы. Синтетически ее получают окислением изоамилового спирта или карбонилированием изобутилового спирта. Используют в синтезе лекарственных веществ и ароматных эссенций.
Пальмитиновая кислота представляет собой бесцветное кристаллическое вещество со слабым запахом стеарина, в воде не растворяется. Широко распространена в природе, в виде сложных эфиров с глицерином входит в состав жиров.
Получают пальмитиновую кислоту обработкой жиров щелочью (гидролиз, омыление). При этом образуются соли (пальмитаты), после подкисления которых осаждается сама кислота.
Пальмитиновая кислота и ее производные используются в качестве поверхностно-активных веществ (моющих средств и др.). Ее натриевая соль называется мылом.
Стеариновая кислота – бесцветное кристаллическое вещество со слабым запахом стеарина. Ее эфиры с глицерином входят в состав жиров.
Получают стеариновую кислоту омылением жиров. Обычно образуется смесь стеариновой и пальметиновой кислот, которую можно разделить на составные части. Стеариновую кислоту в смеси с пальметиновой используют в производстве свечей, их натриевые соли являются обыкновенным мылом. В органическом синтезе стеариновую кислоту используют для получения других поверхностно-активных веществ.
Производные пальметиновой и стеариновой кислот принадлежат к важным природным веществам – липидам.
Циклогексанкарбоновая кислота – бесцветное кристаллическое вещество с запахом пота, т.пл. 31 С, т. кип. 233 С.
Получают ее каталитическим гидрированием бензойной кислоты. [8]
ПРИМЕРЫ ПРОБЛЕМНЫХ СИТУАЦИЙ И ИХ РЕШЕНИЕ
Дата: 2019-07-24, просмотров: 283.