Гидроперекись изопропилбензола из сборника 2 подают через холодильник 1 в реактор, представляющий собой центробежный насос 4, в котором смесь дополнительно перемешивается путем применения ультразвука. Смесь из насоса 4 поступает в холодильник 3, где отводится тепло реакции. Охлажденная смесь поступает в сосуд 5, снабженный мешалкой и охлаждающим устройством. После дополнительного перемешивания и охлаждения в сосуде 5 смесь направляют в первый разделитель 6, откуда отделившаяся серная кислота стекает через холодильник 7 в сборник 8. Углеводородный слой из сосуда 6 поступает во второй разделитель 9 для окончательного отделения остатков серной кислоты. Свободный от кислоты углеводородный слой подают из сосуда 9 в нейтрализатор 10, а оттуда — на ректификацию для выделения целевых продуктов.
5. Анализ ХТС
Реакционная масса, полученная в результате разложения гидроперекиси изопропилбензола, представляет собой довольно сложную смесь. Кроме фенола и ацетона, она содержит диметилфенилкарбинол, ацетофенон, α-метилстирол, окись мезитила, ацетальдегид, изопропилбензол, кислотные катализаторы, примеси органических кислот и следы других примесей.
Первой стадией процесса выделения фенола и ацетона из этой смеси является нейтрализация кислот более сильных, чем фенол. Методы дальнейшей очистки бывают различными и зависят от того, проводилось ли разложение гидроперекиси в гетерогенной или гомогенной среде. Шервуд указывает, что при гомогенном разложении во время последующей нейтрализации образуется небольшой водный слой, в котором содержание фенола и ацетона сравнительно невелико. В процессе нейтрализации, особенно -при гомогенном процессе, осаждается сульфат натрия, что вызывает небходимость фильтрации смеси.
Процесс обработки реакционной смеси, полученной при гетерогенном разложении гидроперекиси изопропилбензола, был разработан фирмой «Distillers Company Limited». Первая стадия этого процесса состоит в отгонке ацетона. Кубовый остаток из отгонной колонны экстрагируют водой при 75—90°С (весовое соотношение вода : сырой продукт составляет около 6). Эта экстракция обеспечивает выделение основной массы фенола и около 0,25 части ацетофенона. Изопропилбензол в рафинате освобождается от ацетофенона перегонкой, а от α-метилстирола — гидрированием в мягких условиях. После такой очистки изопропилбензол можно снова направлять на окисление.
Водный слой экстрагируют бутилацетатом, в результате чего извлекают 99% содержащегося в нем фенола; ацетофенон остается в водном растворе. Некоторое количество бутилацета-та регенерируют перегонкой из водной среды, в которой его концентрация составляет 0,5%. Содержание фенола в бутилацетатном слое составляет около 40%. Растворитель регенерируют перегонкой, после чего остаются фенол и ацетофенон, последний в количестве примерно 1,5%. В процессе окончательного фракционирования фенол получается в технически чистом виде и практически не содержит ацетофенона. Степень выделения фенола, образующегося при разложении, составляет около 95%.
Для выделения целевых продуктов, получаемых в процессе разложения, гомогенизируемого ацетоном, попользуют многоступенчатую перегонку. Вначале отбирается в качестве дистиллята ацетон; изопропилбензол и α-метилстирол выделяются во второй колонне, где выгодно применять отгонку паром из щелочного раствора. Кубовый остаток из второй колонны подвергают фракционированию и фенол, собранный в виде дистиллята, кристаллизуют для получения кондиционного продукта. Кубовый остаток фенольной колонны состоит в основном из ацетофенона, который можно выделить и очистить.
Указывают, что в процессах такого типа соль, растворяющаяся в органическом слое во время нейтрализации, выкристаллизовывается в отгонных колоннах и коммуникациях, что вызывает серьезные затруднения при эксплуатации. Однако этого можно избежать, смешивая перед нейтрализацией продукт разложения с равным объемом воды. Нейтральная смесь отстаивается, водный слой перегоняют для отделения в виде дистиллята фракции, состоящей главным образом из воды и некоторого количества фенола и ацетона. Эта фракция возвращается на промывку. Углеводородный слой фракционируют для выделения ацетона и фенола в соответствии с приведенной ниже схемой технологического процесса (рис. 4).
Наиболее широкое распространение получил способ гомогенного разложения гидроперекиси с применением малых количеств серной кислоты. В этом случае процесс разделения реакционной смеси проводят следующим образом (рис. 5).
Разложенная гидроперекись после нейтрализации щелочью подается насосом 2 из сборника 1 на ректификацию в колонну 3 для отгонки ацетона-сырца. Для снижения температуры в кубе колонны смесь перед ректификацией в ряде случаев разбавляют водой. Ацетон-сырец поступает на ректификацию в колонну 10, в которую подают также водный раствор щелочи для осмоления альдегидов. Товарный ацетон собирают в емкость 12. Удаление альдегидов при получении товарного ацетона возможно и путем ректификации ацетона-сырца в несколько стадий.

Рис. 4. Принципиальная схема процесса выделения фенола и ацетона, разработанная фирмой «Distillers Company Limited».
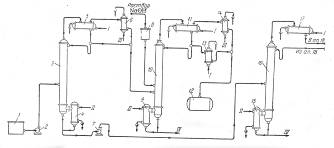
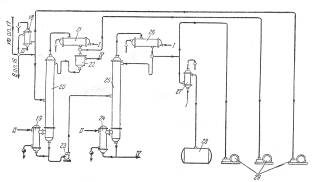
Рис. 5. Принципиальная схема процесса разделения продуктов разложения кислотного гидроперекиси изопропилбензола
1—сборник разложенной гидроперекиси; 5, 7, 23—центробежные насосы; 3—ректификационная колонна для отгонки ацетона-сырца; 4, 9, 15, 19, 24—кипятильники; 5, 11, 17, 21, 26—дефлегматоры; 6, 14, 18—конденсаторы; 8—мерник раствора едкого натра; 10—ректификационная колонна для выделения товарного ацетона; 12—сборник товарного ацетона; 13, 27—холодильники; 16—ректификационная колонна для отгонки фенола-сырца; 20—ректификационная колонна для отгонки а метилстирола; 22—разделительный сосуд; 25—ректификационная колота для выделения товарного фенола; 28—сборник товарного фенола; 29—вакуум-насосы. I—вода; II—греющий пар; III—охлаждающий рассол; IV—отходы на переработку.
Кубовый остаток колонны 3, состоящий главным образом из фенола с примесями а-метилстирола, ацетофенона, диметилфенилкарбинола, воды и смолы, подвергают разгонке в колонне 16; здесь отгоняется в вакууме от диметялфанилкарбинола и смолы фенольная фракция. Кубовой остаток направляют на дальнейшую -переработку, а дистиллят, состоящий из фенола, а-метилстирола, ацетофенона и воды, разгоняют в колонне 20. Эта колонна предназначена для отделения а-метилстирола от фенола, и от четкости ее работы во многом зависит качество товарного фенола, поскольку малейшие примеси а-метилстирола снижают температуру застывания фенола, делая его некондиционным. В качестве дистиллята из колонны 20 отбирают, гетероазеотропную смесь: фенол — а-метилстирол—вода. После расслоения смеси в сосуде 22 водный слой возращают на орошение колонны, а органический слой направляют на щелочную экстракцию для выделения фенола через фенолят натрия.
Дальнейшее выделение фенола можно производить двумя методами. По одному из них разгонку в колонне 20 осуществляют таким образом, что вся вода отгоняется с дистиллятом, а свободный от воды кубовый остаток направляется на окончательную ректификацию в колонну 25, где сверху отбирается товарный фенол. Другой метод более сложен, однако обеспечивает получение фенола самого высокого качества. В этом случае в колонне 20 отгоняется часть воды, а другая ее часть остается в кубовой жидкости, которую подвергают разгонке в дополнительной колонне (на схеме не показана), где сверху отбирается незначительное количество азеотропной смеси фенол—вода; кубовый остаток подают на окончательную разгонку в колонну 25.
Для уменьшения потерь продуктов (вследствие выделения смол), а также во избежание термической дегидратации диметилфенилкарбинола с образованием а-метилстирола в кубах колонн ректификацию в колоннах 16,
5.1 Иерархическая структура ХТС
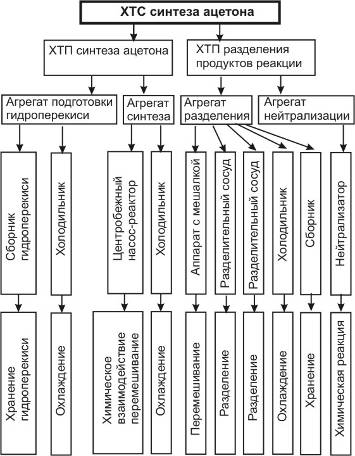
5.3 Изучение свойств и эффективности функционирования ХТС
Изопропилбензол (кумол) С6Н5СН(СН3)2, молекулярная масса 120,20; бесцветная жидкость с запахом бензола; Тпл. - 96 °С, т. кип. 152,4°С, 38,2°С/10 мм рт. ст.; d420 0,8618; nD20 1,4915; давление пара (в кПа): 1 (33,22 °С), 20 (99,08 °С), 80 (143,5 °С); h 0,791 мПа×с (20°С), 0,612 мПа×с (40°С); γ 28,2 мН/м (20°С); tкрит 351,4°С, ркрит 3220 кПа; С0р 197 Дж/(моль.К); DH0исп 367 кДж/кг (25 °С), ΔH0обр -41,3 кДж/моль (25 °С); смешивается с этанолом, диэтиловым эфиром, ацетоном, бензолом, хлороформом; р-римость в воде менее 0,01% (20 oC). Изопропилбензол - типичное ароматическое соединение (легко алкилируется, хлорируется, сульфируется, нитруется в ядро). В промышленности изопропилбензол получают каталитическим алкилированием бензола пропиленом; реакция осложняется последовательным введением алкильных радикалов в образовавшийся И. вплоть до получения гексаизопропилбензола. В способе производства изопропилбензол, осуществленном в РФ, катализатором алкилирования служит хлоралюминиевый каталитический комплекс (АlСl3 с НСl и алкилароматическим углеводородом). Процесс осуществляют при 100-130°С (давление определяется т-рой), мольное соотношение бензол : пропилен (с учетом возвращаемых в реакцию полиалкилбензолов) составляет 3:3,5. Полученный изопропилбензол отмывают от катализатора последовательно 17-25%-ным раствором АlСl3, 3-5%-ным раствором NaOH и водой, подвергают ректификации. Расход бензола и пропилена на производство 1 т И. составляет 0,692 и 0,372 т соотв., АlСl3 - 5,5кг. Недостаток метода - необходимость использования коррозионностойкого оборудования. Все большее промышленное использование находит гомофазное алкилирование в присутвии растворимых количеств хлоралюминиевого каталитического комплекса. В этом методе упрощается технологическая схема процесса, возрастает скорость реакции, уменьшается коррозионная активность реакции среды и снижается выход побочных продуктов. За рубежом для производства И. используют фосфорнокислотные катализаторы на твердом носителе - глине, кизельгуре, силикагеле или алюмосиликате. Процесс осуществляют при температуре около 200 °С и давлении 2,8-4,2 МПа. Чтобы предотвратить дезактивацию катализатора, в реакционную зону вводят воду (0,06-0,08% по массе от массы сырья). С целью сокращения образования полиалкилбензолов процесс ведут при мольном соотношении бензол: пропилен, равном 10:1. Выход изопропилбензола 96-97% в расчете на бензол и 91-92% в расчете на пропилен. Применяют изопропилбензол для производства главным образом фенола и ацетона (через кумилгидропероксид) и α-метилстирола, а также как добавку к авиационным бензинам, повышающую октановое число, Твсп. 38 °С, КПВ 0,88-6,5%. При ингаляции вызывает острые и хронические поражения кроветворных органов (костного мозга, селезенки).
Ацетон (от латинского acetum - уксус) (2-пропанон, диметилкетон) СН3СОСН3, мол. м. 58,079; летучая бесцветная жидкость с характерным запахом; Тпл. - 94,6°С, Ткип. 56,1 °С; d420 0,7920, nD20 1,3588; η 0,36 мПа×с (10°С), 0,30 мПа×с (30 С); γ 0,0237 Н/м (20°С); tкрит 235,5°С, pкрит 4,75 МПа; С°р 749,3 Дж/(кмоль×К); ΔH°исп 29,1 кДж/моль (56,1 °С), ΔН°сгор -1787кДж/моль, ΔН°обр - 216,5 кДж/моль (газ; 25°С) и - 248 кДж/моль (жидкость). Смешивается с водой и органическими растворителями, например эфиром, метанолом, этанолом, сложными эфирами. Ацетон обладает всеми химическими свойствами, характерными для алифатических кетонов. Образует кристаллические соединения с гидросульфитами щелочных металлов, напр. с NaHSO3 - (CH3)2C(OH)SO3Na. Только сильные окислители, например щелочной раствор КМnО4 и хромовая кислота, окисляют ацетон до уксусной и муравьиной кислот и далее - до СО2 и воды. Каталитически восстанавливается до изопропанола, амальгамами Mg или Zn, а также Zn с СН3СООН - до пинакона (СН3)2С(ОН)С(ОН)(СН3)2. Атомы водорода легко замещаются при галогенировании, нитрозировании и т.п. Действием хлора и щелочи ацетон превращается в хлороформ, который взаимодействуя с ацетоном с образованием хлорэтона (СН3)2С(ОН)СС13, применяемого как антисептик. Ацетон окисляет вторичные спирты в присутствии алкоголятов А1 до кетонов (реакция Оппенауэра):
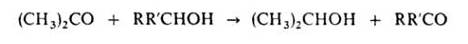
Вступает в альдольную конденсацию с образованием диацетонового спирта (СН3)2С(ОН)СН2СОСН3, а также в кротоновую конденсацию с образованием окиси мезитила (СН3)2С=СНСОСН3, форона (СН3)2С=СНСОСН=С(СН3)2 и мезитилена. В присутствии сильной минеральной кислоты ацетон алкилирует фенол с образованием дифенилолпропана (бисфенола ацетона) (НОС6Н4)2С(СН3)2, присоединяет цианид-ион с образованием ацетонциангидрина (CH3)2C(OH)CN. При пиролизе (700°С) ацетон образуются кетен СН2=С=О и метан. В промышленсти ацетон получают преимущественно так назеваемым кумольным способом одновременно с фенолом из бензола и пропилена через изопропилбензол (кумол) по схеме, рассмотренной подробнее выше:
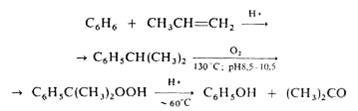
Ацетон - широко применяемый растворитель органических веществ, в первую очередь нитратов и ацетатов целлюлозы; благодаря сравнительно малой токсичности он используется также в пищевой и фармацевтической промышленности; ацетон служит также сырьем для синтеза уксусного ангидрида, кетена, диацетонового спирта, окиси, мезитила, метилизобутилкетона, метилметакрилата, дифенилолпропана, изофорона и многих других соединений. Для ацетон Твсп. -20°С, Тсамовоспл. 500°С; КПВ 2,15-13,00%. Ацетон при вдыхании накапливается в организме. Т.к. выводится из организма медленно, возможны хронические отравления. ПДК 200 мг/м3.
6. Заключение
В процессе производства применяются токсичные вещества, оказывающие вредное влияние на обслуживающий персонал и окружающую среду. Это исходные компоненты для синтеза – серная кислота и гидроперекись изопропилбензола и основные продукты синтеза – ацетон и фенол.
Серная кислота - чрезвычайно агрессивное вещество. Она поражает дыхательные пути, кожу, слизистые оболочки, вызывают затруднение дыхания, кашель, нередко - ларингит, трахеит, бронхит и так далее. ПДК аэрозоля серной кислоты в воздухе рабочей зоны 1,0 мг/м3, в атмосферном воздухе 0,3 мг/м3 (максимальная разовая) и 0,1 мг/м3 (среднесуточная). Поражающая концентрация паров серной кислоты. 0,008 мг/л (экспозиция 60 мин), смертельная 0,18 мг/л (60 мин). Класс опасности 2. Аэрозоль серной кислоты может образовываться в атмосфере в результате выбросов хим. и металлургических производств, содержащих оксиды S, и выпадать в виде кислотных дождей. Изопропилбензол - при ингаляции вызывает острые и хронические поражения кроветворных органов (костного мозга, селезенки)
Фенол вызывает нарушение функций нервной системы, дыхания и кровообращения, раздражает слизистые оболочки дыхательных путей и глаз, вызывает ожоги при попадании на кожу. ПДК в атмосферном воздухе 0,003 мг/м3, в воздухе рабочей зоны 0,3 мг/м3, в воде водоемов рыбохозяйственного и хозяйственно-бытового пользования 0,001 мг/л. ЛД50 427 мг/кг (мыши, внутрижелудочно). Ацетон при вдыхании накапливается в организме. Т.к. выводится из организма медленно, возможны хронические отравления. ПДК 200 мг/м3. Для снижения экологической напряжённости производства применяется регенерация серной кислоты, позволяющая снизить отходы производства. В цехах должны быть реализованы эффективные системы приточно-вытяжной вентиляции для обеспечения безопасных условий работы персонала.
Химическая наука и химическая промышленность в настоящее время являются одними из ведущих отраслей, которые обеспечивают научно технический прогресс в обществе. Интенсивный рост данной отрасли требует создания мощной производственной базы в области основных растворителей и крупнотоннажных реагентов.
В данной работе приведён критический анализ разнообразных способов получения ацетона. Выбрана оптимальная технологическая схема. Проведена оценка экологической безопасности производства.
Благодаря тому, что в рассмотренной схеме серная кислота работает в замкнутом цикле, снижается экологическая напряжённость процесса. Таким образом в курсовой работе разработана технологическая модель являющаяся прогрессивной, экономически эффективной и экологически безопасной.
7. Список использованных источников
1. Кутепов А. М., Бондарева Т. И., Беренгартен М. Г. Общая химическая технология. М.: Высшая школа, 1990. 520 с.
2. Общая химическая технология / Под ред. И. П. Мухлёнова М.: Высшая школа, т 1, 2. 1984, 419 с.
3. Расчёты химико-технологических процессов / Под ред. И. П. Мухлёнова, изд М.: Химия. 1982, 245 с.
4. Бесков С. Д. технологические расчёты. М.: Высшая школа,1966, 519 с.
Дата: 2019-05-29, просмотров: 300.