Реакция кислотного, или так называемого гетеролитического распада гидроперекисей, в отличие от гемолитического распада, до сравнительно недавнего времени не привлекала внимания исследователей. Толчком к изучению этой весьма интересной реакции послужило открытие и широкое распространение нового способа совместного получения фенола и ацетона через гидроперекись изопропилбензола.
П. Г. Сергеев, Р. Ю. Удрис и Б. Д. Кружалов, изучая в 1943 г. свойства впервые полученной ими гидроперекиси изопропилбензола, обнаружили, что данная гидроперекись в присутствии незначительных количеств серной кислоты практически количественно и с большой скоростью распадается на фенол и ацетон, выделяя при этом значительное количество тепла. Через год эта реакция была описана в литературе Хоком и Лан-гом [1]. В 1943—1946 гг. П. Г. Сергеев с сотрудниками детально изучил описанную реакцию, и несколько .позднее этот процесс был реализован в промышленном масштабе[2].
Первые сведения о возможности такого расщепления гидроперекисей относятся к более раннему периоду (1931 г.), когда была опубликована работа Виланда и Мейера [3], посвященная изучению свойств гидроперекиси трифенилметана. Эти авторы впервые синтезировали гидроперекись трифенилметана и пытались получить ее бензоильное производное. Однако при взаимодействии гидроперекиси с хлористым бензоилом неожиданно были получены фенол и бензофенон в эквимолекулярном соотношении:
(С6Н5)3–COOH → (С6Н6)3С=О + С6Н5ОН
Спустя 20 лет, в 1950 г., когда в СССР процесс получения фенола и ацетона через гидроперекись изопропилбензола уже был осуществлен в промышленности, появилась работа Караша с сотрудниками по изучению механизма реакции кислотного разложения гидроперекиси изопропилбензола.
Авторы отмечают, что реакция разложения чрезвычайно экзотермична и протекает с заметной скоростью даже при –80 СС. Для того чтобы свести к минимуму нежелательные побочные процессы, разложение проводилось в среде уксусной кислоты (в которой гидроперекись стабильна при комнатной температуре) в присутствии 0,1 мол. % хлорной кислоты. В этих условиях гидроперекись изопропилбензола количественно разлагалась на фенол и ацетон.
Для объяснения этой реакции Караш предложил цепной механизм:
|
С6Н5(СН3)2СООН → [С6Н5(СН3)2СО]+ + (АОН)— (а)
[С6Н6(СН3)2СО]+ → [СвН6-О-(СН3)2С]+ (б)
С6Н5(СН3)2СООН + [С6Н5–О– (СН3)2С]+ →
→ [СвН6(СН3)2СО]+ + С6Н5ОН + (СН3)2СО (в)
В описанной схеме «А» — сильная кислота по теории Льюиса. В результате бимолекулярной реакции гидроперекиси с кислотой образуется осколок молекулы, несущий положительный заряд на кислородном атоме, который перегруппировывается затем в катион, несущий положительный заряд на углеродном атоме (ион карбония). Этот ион, взаимодействуя с молекулой гидроперекиси, превращается в фенол и ацетон, регенерируя кислородный катион, который в свою очередь перегруппировывается в ион карбония и т. д.
Тот факт, что только сильные кислоты могут быть причиной гетеролитического распада гидроперекиси изопропилбензола, авторы доказывают следующим образом. Хлористый водород, растворенный в уксусной кислоте, не является сильной кислотой и в этом случае не пригоден для разложения гидроперекиси, тогда как в других условиях следы хлористого водорода вызывают бурный ее распад на фенол и ацетон. С другой стороны, хлорное железо, которое в спиртовом растворе представляет собой слабую кислоту, в данных условиях не разлагает гидроперекись. В то же время раствор хлорного железа в бензоле является сильной кислотой и быстро превращает гидроперекись изопропилбензола в фенол и ацетон. Аналогичные результаты были получены с другими растворителями (диоксан, бензол) и кислотами (растворы фтористого бора, хлористого алюминия, серная кислота). Это указывает на отсутствие специфического влияния растворителя или аниона.
Караш с сотрудниками наблюдали также, что присутствие в гидроперекиси диметилфенилкарбинола вызывает в условиях кислотного разложения образование димера α-метилстирола наряду с заметно уменьшающимися количествами фенола и ацетона. Если в реакцию вступали относительно большие количества этого карбинола (2 – 3 моль на 1 моль гидроперекиси), образование фенола и ацетона полностью прекращалось; основными продуктами при этом были димер а-метилстирола и перекись водорода.
На основании описанного эксперимента Караш. сделал вывод о том, что разложение гидроперекиси изопропилбензола может по существу измениться в присутствии вещества, способного конкурировать с гидроперекисью по отношению к кислоте «А». В данном случае, очевидно, диметилфенилкарбинол является более сильным основанием, чем гидроперекись изопропилбензола; следовательно, реакция (а) не может протекать.
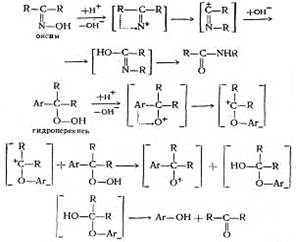
Сравнительно недавно Хоку с сотрудниками удалось синтезировать бензоильное производное гидроперекиси изопропилбензола, которое безуспешно пытались получить Виланд и Мейер для гидроперекиси трифенилметана. Детально изучив механизм превращений гидроперекиси изопропилбензола, Хок предложил схему распада, в основе которой лежит перегруппировка иона оксония в ион карбония.
При рассмотрении реакции кислотного разложения гидроперекиси изопропилбензола с точки зрения, механизма, предложенного Карашем, становится очевидной аналогия с бекмановской перегруппировкой:
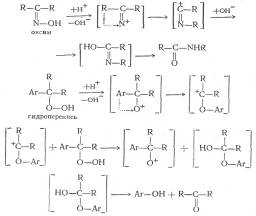
Несмотря на то, что схема, предложенная Карашем, наиболее полно объясняет процесс кислотного разложения гидроперекисей, следует отметить, что точный механизм первичного гетеролитического распада гидроперекисей в деталях не известен и трудно сказать что-либо определенное относительно продолжительности существования предполагаемого кислородного катиона и того, является ли он в действительности «свободным».
Таким образом можно сделать вывод о том, что процесс кислотного разложения гидроперекиси изопропилбензола является оптимальным процессом получения ацетона.
Рассмотрим технические решения по созданию данного производства.
4.2 Определение технологической топологии ХТС
Вследствие того, что реакция кислотного разложения гидроперекиси изопропилбензола нашла большое практическое применение в производстве фенола и ацетона, в научно-технической литературе с каждым годом появляются новые сообщения относительно различных способов осуществления данного процесса. В основном вся литература по этому вопросу представлена в виде патентов или коротких сообщений рекламного характера. В то же время опубликовано очень мало сведений о конкретном аппаратурно-технологическом оформлении процесса кислотного разложения гидроперекиси на действующих или проектируемых промышленных установках.
В большинстве случаев в качестве катализатора рекомендуют серную кислоту, концентрированную или разбавленную. При этом, как правило, концентрированная кислота применяется в каталитических количествах (0,1—2% от веса гидроперекиси), а разбавленная кислота берется в большом избытке. В ряде патентов предлагают вместо серной кислоты использовать хлорную и фосфорную кислоты, органические сульфокислоты, сульфированную феноло-формальдегидную смолу. Рекомендуют проводить разложение гидроперекиси изопропилбензола сернистым ангидридом в аппарате пленочного типа. Сообщают о возможности разложения гидроперекиси сульфидами щелочных или щелочноземельных металлов и их смесей, а также в присутствии таких катализаторов, как фосфор, сера, селен и мышьяк при 108—110 °С в вакууме. В качестве катализаторов для разложения концентрированной или разбавленной гидроперекиси предлагают безводные сульфаты меди, кальция, бериллия, магния, стронция и бария. Разложение гидроперекиси можно также осуществить на пористом материале, пропитанном серной кислотой, с помощью катализаторов алкилирования (А1С13, FеС13, активные глины) или на ионообменных смолах. Несмотря на множество предложенных катализаторов, в промышленности России и за рубежом применяют только серную кислоту, и нет никаких сведений о использовании других катализаторов.
Вследствие большого теплового эффекта реакции разложения гидроперекиси на фенол и ацетон (2×103 кДж/кг = 486 ккал/кг) необходимо отводить выделяющееся тепло в качестве среды, воспринимающей тепло, применяют изопропилбензол, фенол, ацетон или серную кислоту.
В значительной части патентов указывается на возможность кислотного разложения неконцентрированной гидроперекиси изопропилбензола в том виде, в каком она получается сразу после окисления, т. е. состоящей примерно из 25% гидроперекиси и 70—75% изопропилбензола. Разложение такой гидроперекиси обычно осуществляют с помощью относительно большого количества разбавленной серной кислоты — в гетерогенной среде. Конструкция реактора не описывается, однако указано, что смесь в реакторе должна интенсивно перемешиваться для обеспечения необходимой скорости реакции. Эмульсия, образовавшаяся в реакторе, поступает в сепаратор, где происходит разделение фаз. Верхний, органический слой направляют сначала на нейтрализацию, затем на ректификацию для выделения индивидуальных продуктов, а слой отработанной серной кислоты вновь возвращают в реактор.
Для такого гетерогенного процесса рекомендуют применять 10—75%-ную серную кислоту. Выбор необходимой концентрации серной кислоты зависит от температуры реакции. Так, для того чтобы обеспечить достаточную скорость реакции при 50—60 °С, необходима 60—70%-ная серная кислота. В одном из патентов предлагают проводить процесс с использованием 44%-ной серной кислоты.
В первоначальном варианте гетерогенного метода разложения разбавленная (10%-ная) серная кислота и гидроперекись энергично смешивались в реакторе. Затем после отстаивания и разделения органический и водный слои подвергали раздельной обработке для выделения целевых продуктов. Недостатки этого метода: влияние эффективности перемешивания на скорость реакции, корродирующее действие разбавленной серной кислоты, сложность системы выделения целевых продуктов, вызванная тем, что фенол и ацетон растворимы в органических и неорганических фазах. Серьезным недостатком является также необходимость удаления большого количества сточных вод, содержащих фенол. Гетерогенный процесс кислотного разложения гидроперекиси изопропилбензола, по имеющимся сведениям, был реализован в промышленности только на первом зарубежном заводе по производству фенола и ацетона, введенном в действие в Монреале (Канада) в 1953 г.
В дальнейшем все большее применение стал находить гомогенный процесс кислотного разложения, заключающийся в том, что кислота применяется в таких небольших количествах, которые полностью растворимы в реакционной смеси и не образуют второго слоя.
Так, в кратком описании завода по производству фенола и ацетона в Пон-де-Кле (Франция) указывается, что гидроперекись выделяется в концентрированном виде путем вакуум-ректификации продуктов, полученных в результате окисления изо-протшлбензола. Здесь же сообщается, что при современном состоянии техники такой метод концентрирования гидроперекиси не вызывает затруднений. Разложению на фенол и ацетон подвергается уже концентрированная гидроперекись. В сообщении о пуске в начале 1960 г. завода по получению фенола и ацетона в Гренжмаутсе (Англия) говорится, что концентрированная гидроперекись разлагается на фенол и ацетон в присутствии серной кислоты. Процесс разложения протекает настолько быстро, что в любой момент количество гидроперекиси в реакторе незначительно.
Для осуществления реакции разложения в гомогенной среде было разработано несколько методов, согласно которым один из основных продуктов реакции возвращают в аппарат на разложение в количестве, достаточном для гомогенизации реакционной массы.
Применение фенола в качестве гомогенизатора было осуществлено рядом французских производителей. В данных процессах в реакторе создается пленка из фенола. Для этого гидроперекись изопропилбензола, серную кислоту, а также дополнительное количество фенола подают в реактор непрерывно.
Концентрация кислоты составляет 30—75%, а количество ее — около 1—5% от веса гидроперекиси. Реакцию можно проводить при 50 °С и скорость подачи сырья регулировать таким образом, чтобы содержание гидроперекиси изопропилбензола в смеси не превышало 0,5%.
Реакционная смесь непрерывно поступает во второй реактор, в котором также поддерживается температура 50 °С и где реакция заканчивается. Смесь, выходящая из этого реактора, содержит менее 0,1% гидроперекиси и подается в третий реактор, в котором кислоту нейтрализуют каустиком до щелочной реакции по метилроту. Нейтрализованная смесь отстаивается от небольшого водного слоя, содержащего главным образом сульфат натрия. Органический слой перегоняют в трех колоннах. В первой из них, работающей при атмосферном давлении, в виде дистиллята отгоняется ацетон, во второй — α-метилстирол и в третьей — фенол путем перегонки в вакууме. Выход фенола составляет 94—96%, ацетона — 95% в пересчете на гидроперекись изопропилбензола.
Метод использования ацетона в качестве гомогенизатора был разработан фирмами «Hercules Powder Company» (США) и «Distillers Company Limited» (Англия). Этот метод применяется в промышленности. Разложение гидроперекиси проводят в гомогенной среде, состоящей из ацетона и концентрированной (95—96%-ной) серной кислоты, которая вводится в виде 1%-ного раствора в ацетон. Реакционная среда не должна содержать больших количеств воды, так как при этом происходит расслаивание. Желательно, чтобы воды было менее 2%, а для достижения оптимальных результатов вода должна полностью отсутствовать.
Гидроперекись изопропилбензола может быть применена как концентрированная, так и в виде сырой реакционной смеси, полученной окислением изопропилбензола. Преимущественно используют концентрированную (75—88%-ную) гидроперекись. Хотя количество серной кислоты можно изменять в широких пределах, оптимальной является добавка 0,8 вес. % Н2PО4 (считая на серный ангидрид).
Регулирование температуры осуществляется путем дефлегмации ацетона. Гидроперекись изопропилбензола и дополнительное количество ацетона вводят в реактор, в котором находится смесь, гомогенизированная ацетоном. В патенте приводится пример непрерывного разложения гидроперекиси изопропилбензола в ацетоне. Реакционный сосуд, в котором осуществлялось разложение, был снабжен термометром, механической мешалкой, холодильником и штуцерами для ввода гидроперекиси, раствора серной кислоты в ацетоне и для вывода разложенной реакционной смеси. Штуцер для вывода смеси находился сбоку, на высоте, равной одной трети общей высоты реактора. До начала опыта реактор заполняли раствором, состоявшим из ацетона и 1 вес. % -(в пересчете на ацетон) концентрированной серной кислоты. Затем вводили до уровня слива из реактора гидроперекись изопропилбензола. С этого момента из сосуда вытекала реакционная смесь, а из холодильника возвращался -ацетон, который смешивался с добавляемой в количестве 1 % (из расчета на вводимую гидроперекись) серной кислотой и поступал обратно в реактор. Полученная смесь отбиралась в том же объеме, в каком вводилась гидроперекись. Таким образом было разложено 3516 вес. частей 80,5%-ной гидроперекиси изопропилбензола. В минуту подавалось 17,2 вес. части гидроперекиси. Температура смеси в реакторе составляла 90 °С, а время контактирования — 29 мин. Вытекающий из реактора продукт содержал 0,5% гидроперекиси. При разгонке реакционной смеси было получено 1510 вес. частей твердого фенола, что соответствовало выходу 86% от теоретического.
Фирма «Bergwerkgeselschaft Hibernia AG» рекомендует проводить процесс разложения гидроперекиси изопропилбензола в центробежном насосе с использованием в качестве теплоносителя серной кислоты при температуре около 30°С, причем отношение объема раствора гидроперекиси к кислоте составляет 1 : 14—20. Благодаря высокой степени перемешивания реакционной смеси в насосе гидроперекись полностью разлагается, хотя смесь остается в насосе только короткое время. Размешивание можно интенсифицировать применением ультразвука, благодаря которому повышается также скорость реакции. В патенте указывается, что при таком способе разложения не образуется побочных продуктов. Серная кислота, используемая в процессе, одновременно служит для поддержания температуры реакции в пределах 28—38°С. Продукты разложения гидроперекиси отличаются высокой степенью чистоты, что является важным условием для их выделения в чистом виде. Ниже приводится описание схемы предлагаемого патентом процесса (рис. 3).
Сборник 9 заполняют смесью, состоящей из 50% серной кислоты и 50% ацетона; смесь готовят прибавлением ацетона к серной кислоте до тех пор, пока плотность смеси не станет равной 1,325 г/см3 при 15°С. Температура смеси, прокачиваемой через систему, поддерживается в пределах 20 °С при помощи холодильной установки 1. Гидроперекись изопропилбензола из сборника 3 подают через холодильник 2 в реактор, представляющий собой центробежный насос 5, в котором смесь дополнительно может быть перемешана путем применения ультразвука. Насос имеет емкость около 5 л и вращается со скоростью 1400 об/мин. За 1 ч через насос проходит 30 м3 реакционной жидкости. Рекомендуемое объемное соотношение серной кислоты и гидроперекиси 14: 1. Смесь из насоса 5 поступает в холодильник 4, где отводится тепло реакции. Охлажденная смесь поступает в сосуд 6, снабженный мешалкой и охлаждающим устройством. После дополнительного перемешивания и охлаждения в сосуде 6 смесь направляют в первый разделитель 7, откуда отделившаяся серная кислота стекает через холодильник 8 в сборник 9. Углеводородный слой из сосуда 7 поступает во второй разделитель 10 для окончательного отделения остатков серной кислоты. Свободный от кислоты углеводородный слой подают из сосуда 10 в нейтрализатор 11, а оттуда — на ректификацию для выделения целевых продуктов. Указывают, что по этому методу получают с высокими выходами очень чистые фенолы и кетоны. В качестве иллюстрации приводится следующий пример. Был взят продукт окисления, содержащий 41% гидроперекиси изопропилбензола. При количественном разложении в реакционной смесидолжно было бы содержаться 23,8% фенола и 15,7 % ацетона. Фактически смесь состояла из 23,8 % фенола и 15,2 %, т. е. выход фенола составил 94% и ацетона 97% от теоретического (считая на гидроперекись бензоила).
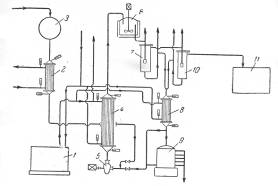
Рис. 3. Принципиальная схема процесса кислотного разложения гидроперекиси изопропилбензола с центробежным насосом в качестве реактора:
1—холодильная установка; 2, 4, 8—холодильники; 3—сборник концентрированной гидроперекиси; 5— центробежный насос-реактор; 6—аппарат с мешалкой; 7, 10— разделительные сосуды; 9—сборник смеси серной кислоты и ацетона; 11—нейтрализатор.
С целью уменьшения количества побочных продуктов, образующихся при совместном получении фенола и ацетона, появились предложения о проведении кислотного разложения гидроперекиси изопропилбензола в присутствии перекиси водорода. Сущность этих предложений заключается в том, что присутствующий в качестве примеси в технической гидроперекиси диметилфенилкарбинол образует с перекисью водорода гидроперекись, которая вместе с основным количеством гидроперекиси разлагается на фенол и ацетон. Возможность такого превращения диметилфенилкарбинола в фенол и ацетон впервые была показана Карашем с сотр. в 1950 г.
Росс и Хуттель показали, что диметилфенилкарбинол, содержащийся в технической гидроперекиси изопропилбензола, путем обработки последней перекисью водорода в присутствии серной кислоты при низкой температуре (5—10 °С) можно превратить в гидроперекись. Однако при таком способе разложения технической гидроперекиси изопропилбензола возможно образование димерной перекиси ацетона, являющейся сильным взрывчатым веществом. Кроме того, вследствие сравнительно больших расходов относительно дорогой (по сравнению с дешевым фенолом, получаемым по кумольному методу) перекиси водорода указанный способ вряд ли может представлять промышленный интерес.
4.3 Установление технологических и конструкционных параметров ХТС, технологических параметров режима и потоков
Реакция кислотного разложения гидроперекиси изопропилбензола на фенол и ацетон очень экзотермична: средний тепловой эффект процесса составляет ~ 308×103 кДж/кмоль ( ~ 74 ккал/моль) или 2080 кДж/кг гидроперекиси ( ~ 486 ккал/кг гидроперекиси). Энергия активации, найденная для технической гидроперекиси, E = 75420 кДж/моль (18 000 кал/моль).
Скорость реакции разложения сильно меняется в зависимости от количества и концентрации кислоты. В случае применения 10%-ного раствора серной кислоты для полного разложения гидроперекиси требуется около 1 ч, тогда как в присутствии 1%-ного раствора кислоты — 5 ч, а при применении 94—96%-ной серной кислоты в количестве 0,1% от веса гидроперекиси — менее одной минуты.
Сообщают, что при подаче газообразного сернистого ангидрида в сосуд, содержащий несколько граммов чистой гидроперекиси изопропилбензола, происходил взрыв. Даже при очень низких температурах сернистый ангидрид все еще сохраняет свою активность. При добавлении гидроперекиси по каплям к жидкому SО3 при —55 °С через некоторое время происходил сильный взрыв вследствие недостаточного отвода тепла из реакционной массы.
Кинетика реакции кислотного разложения гидроперекиси изопропилбензола была исследована П. Г. Сергеевым, М. С. Немцовым и Б. Д. Кружаловым, которые установили, что скорость реакции находится в сложной зависимости от концентрации кислоты три ее значениях меньше 0,01%. При Концентрациях кислоты выше 0,01% константа скорости пропорциональна содержанию кислоты. Скорость реакции разложения увеличивается также с ростом температуры.
При кислотном разложении гидроперекиси изопропилбензола очень важно поддерживать определенный температурный режим, так как при увеличении температуры выше определенного предела выход фенола и ацетона снижается. Существенным является также протекание вторичных реакций при кислотном разложении гидроперекиси. Очевидно, что для понижения выхода побочных продуктов необходимо снижать концентрации фенола и диметилфенилкарбинола в смеси, а также уменьшать время их пребывания в присутствии серной кислоты в реакционной зоне.
Перечисленные особенности кислотного разложения гидроперекиси и определяют технологическое оформление этого процесса.
Разложение проводят при низких начальных концентрациях гидроперекиси в реакционной смеси таким образом, чтобы обеспечивался полный распад гидроперекиси за один проход. При высоких концентрациях гидроперекиси незначительное колебание режима может вызвать неконтролируемое спонтанное разложение ее с выделением такого количества тепла, которое нельзя отвести в системе охлаждения реактора; это может привести к взрыву вследствие мгновенного испарения реакционной смеси. При неполном разложении за один проход гидроперекись будет распадаться на следующих стадиях процесса, что вызывает ее потери за счет термического распада и нежелательно по соображениям техники безопасности. Высокая экзотермичность реакции обусловливает необходимость создания эффективной системы отвода тепла.
Практически процесс можно осуществлять как в адиабатических, так и изотермических условиях. Оформление процесса в адиабатическом реакторе сводится к следующему. По реакционной системе, состоящей из реактора и холодильника, циркулирует какой-либо разбавитель, к которому перед входом в аппарат добавляют серную кислоту и гидроперекись изопропилбензола. За счет тепла реакции смесь нагревается от начальной температуры t1 до заданной предельной температуры t2. Очевидно, что степень тепловыделения и нагрева реакционной смеси определяется количеством гидроперекиси, вводимой на единицу веса жидкости, циркулирующей в системе.
Смесь из реактора поступает в холодильник, где охлаждается до начальной температуры t2 после чего часть ее, соответствующая количеству гидроперекиси, поданной на разложение, выводится из системы, а оставшаяся часть возвращается на циркуляцию. Как уже говорилось, в качестве реакционной среды может быть использована либо разбавленная серная кислота, легко отстаивающаяся от продуктов разложения гидроперекиси и возвращаемая в производственный цикл, либо собственно смесь продуктов разложения гидроперекиси.
4.4 Модели рассматриваемой ХТС
Химическая схема
Кислотное разложение гидроперекиси изопропилбензола протекает по следующей схеме:
4.5 Функциональная модель ХТС
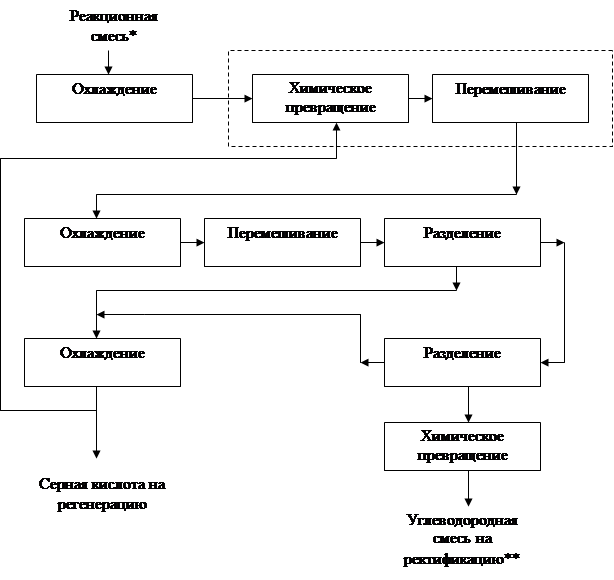 |
* - Гидроперекись и серная кислота в соотношении 1 : 14.
** - Фенол и ацетон.
4.6 Структурная модель ХТС
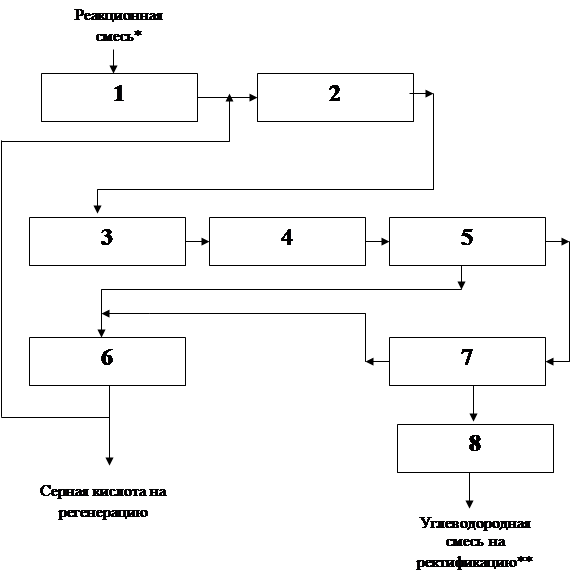
1. Холодильник
2. Центробежный насос
3. Холодильник
4. Аппарат с мешалкой
5. Разделитель
6. Холодильник
7. Разделитель
8. Нейтрализатор.
4.8 Технологическая модель ХТС
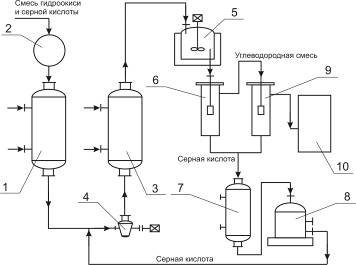
1, 3, 7 — холодильники; 2 — сборник концентрированной гидроперекиси; 4 — центробежный насос-реактор; 5 — аппарат с мешалкой; 6, 9 — разделительные сосуды; 8 — сборник смеси серной кислоты и ацетона; 10 — нейтрализатор.
Дата: 2019-05-29, просмотров: 308.