Наиболее детальную структурную информацию об очищенных мембранных белках можно получить, исследуя методом рентгеновской дифракции трехмерные белковые кристаллы. К сожалению, оказалось, что интегральные мембранные белки очень трудно кристаллизовать. Будучи удалены из своего естественного липидного окружения, неполярные участки липидных молекул склонны агрегировать с образованием неупорядоченных форм, непригодных для кристаллографического анализа. Ясно, что необходимы специальные методы, позволяющие обойти эти трудности, и в этом был достигнут определенный прогресс. Михель обратил внимание, что мембранные белки образуют кристаллы двух типов (рис.2).
Кристаллы типа I напоминают стопки мембран. В них осуществляется латеральное взаимодействие между неполярными участками, а мембраноподобные слои связывают полярные участки белков. Подобные кристаллы были получены для нескольких белков, но ни в одном случае их нельзя было исследовать с помощью дифракции с высоким разрешением. Кристаллы типа II стабилизируются за счет контактирования полярных участков белковых молекул, а небольшие амфифильные соединения или детергенты в основном заполняют промежутки между ними. Заметим, что очень важными являются размер, заряд и другие свойства детергентов; если эти параметры неблагоприятны, то детергент может дестабилизировать кристаллическую структуру. Кристаллы типа II образуют белки фотосинтетического реакционного центра Rhodopseudomonas viridis
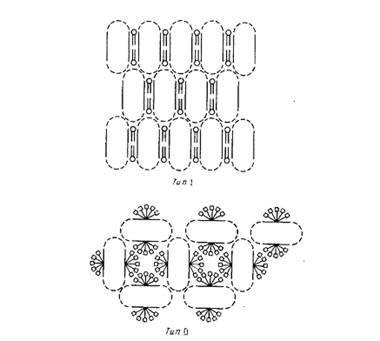
Рис.2. Два основных типа кристаллов мембранных белков.
Кристаллы типа I представляют собой двумерные стопки, упорядоченно расположенные в третьем измерении. В кристаллах типа II с гидрофобными поверхностями белков связаны молекулы детергента. Пунктиром отмечены гидрофильные домены белков.
Итак, мембранные белки можно кристаллизовать, и хотя число успешных попыток пока невелико, можно сделать несколько выводов, касающихся методологии кристаллизации.
1. Белки кристаллизуются вместе с детергентом.
2. Очень важен выбор детергента. По-видимому, наиболее пригодны цвиттерионные или неионные детергенты с высокой ККМ и малым размером мицелл
3. Кристаллизация облегчается в присутствии малых амфифильных органических молекул, по-видимому, влияющих на полярные концевые группы детергента.
4. Полиэтиленгликоль и сульфат аммония, обычно использующиеся при кристаллизации растворимых белков, применяются и для индукции кристаллизации мембранных белков.
Реконструкция изображения и двумерные кристаллы
Трехмерные кристаллы мембранных белков получить очень трудно, но многие из них образуют двумерные упорядоченные структуры. В некоторых случаях белки формируют такие структуры in vivo, (например, бактериородопсин в пурпурной мембране). При подходящих условиях такие белки, как и многие другие, образуют "двумерные кристаллы" при их очистке и реконструкции в присутствии фосфолипидов. Подобные двумерные упорядоченные структуры можно, использовать для получения трехмерной структурной информации с помощью электронной микроскопии и методов реконструкции изображения.
Пример структурных исследований мембранных белков.
Структура поринов
Порины - это основной класс белков, обнаруженных в наружной мембране кишечных бактерий
У Е. coli и Salmonella typhimurium выявлены три порина: OmpF, OmpC и PhoE. Эти белки имеют молекулярную массу примерно 35 000 и гомологичные аминокислотные последовательности. Порины экстрагируются из наружной мембраны с помощью ДСН в виде стабильных тримеров; их можно встроить в фосфолипидные бислои с образованием неспецифичных пор, способных пропускать малые (<600 Да) гидрофильные молекулы. По-видимому, именно они придают наружной мембране бактерий свойство молекулярного сита, позволяя питательным веществам проникать внутрь клетки, а отходам - выводиться наружу через неспецифические каналы.
Были проведены обширные структурные исследования белка OmpF, известного также под названием "матриксный порин"; в настоящее время осуществляется кристаллографический анализ, который позволит получить его структуру с высоким разрешением. Судя по данным о первичной последовательности, в молекуле нет никаких длинных гидрофобных участков, которые можно было бы идентифицировать как трансмембранные, и в среднем в ней содержится больше полярных аминокислот, чем неполярных. Однако трехмерная электронно-микроскопическая реконструкция изображения с использованием кристаллических пластинок реконструированного порина показала, что белок пронизывает бислой, причем за пределы мембраны выходят лишь небольшие участки молекулы. Методом негативного контрастирования были выявлены каналы, образуемые тримерами. Отдельные молекулы порина образуют у внутренней поверхности каналы, которые в середине бислоя сливаются в одиночный канал, открывающийся наружу. Есть и другие данные, свидетельствующие о том, что порин, несмотря на отсутствие в его молекуле гидрофобных участков, является трансмембранным белком. Иногда этот белок выполняет роль рецептора для бактериофага (для этого отдельные его участки должны быть экспонированы на наружной поверхности), а также проявляет сродство к компонентам клеточной стенки на периплазматической стороне. Очищенный порин можно встраивать в фосфолипидные бислои с образованием потенциалчувствительных каналов.
Данные инфракрасной спектроскопии, кругового дихроизма и широкоугольной диффузионной рентгеновской дифракции свидетельствуют о том, что две трети длины молекулы образует β-слой, а на долю α - спиралей приходится небольшая часть длины молекулы. Кроме того, эти исследования показывают, что β - цепи антипараллельны, ориентированы перпендикулярно плоскости мембраны не имеют среднюю длину 10-12 остатков, которых достаточно для пересечения неполярной области мембраны. Способ укладки β-цепей можно установить лишь с помощью рентгеновской дифракции. Как показывают модельные исследования, β-цепи могут быть уложены так, что образуется β-цилиндр, при этом полярные и заряженные аминокислотные остатки выстилают стенки наполненных водой каналов.
Все известные о структуре порина данные показывают, что гидрофобная
α-спираль не является его необходимым трансмембранным элементом. Это означает, что наиболее распространенные способы предсказания структуры трансмембранных белков имеют свои ограничения, поскольку они основываются на предположении, что пересечь бислой могут только гидрофобные сегменты. Точная структура порина до сих пор неизвестна; неясно также, сходна ли она со структурой других мембранных белков. Впрочем, имеются и другие белки наружной мембраны бактерий, которые характеризуются высоким содержанием β - структур.
Предположение о том, что необычная структура поринов связана с уникальной структурой и составом наружной мембраны бактерий, выглядит правдоподобно. Возможно, однако, что она обусловлена уникальностью способа образования больших водных каналов через бислой.
Заключение
Исследование мембранных белков все еще остается трудной задачей, требующей оригинальных подходов и нетривиальных решений. Тем не менее, каждый год появляются все новые сообщения о совершенствовании уже имеющихся методов. С разработкой новых методов очистки мембранных белков, основанных на применении различных детергентов, а так же с использованием методов секвенирования ДНК удается получить новую информацию о структуре мембранных белков. Данные по вторичной и четвертичной структуре очищенных мембранных белков можно получить с помощью биохимических и спектроскопических методов. Однако для построения моделей с высоким разрешением следует применять рентгеноструктурный анализ. Показательным в этом отношении является успех, достигнутый при изучении реакционных центров бактерий.
Список литературы
1. Геннис Р. Биомембраны: Молекулярная структура и функции: Пер. с англ. – М.: Мир, 1997,-624с.
2. Финдель Дж. Б., Эванз У.Г. Биологические мембраны. Методы: Пер. с англ. – М.: Мир, 1990, - 424с.
3. Фаллер Дж. М., Шилдс Д. Молекулярная биология клетки. Руководство для врачей: пер. с англ. – М.: Бином - Пресс, 2004,-272с.
4. Овчинников Ю.А. Биоорганическая химия Москва, Просвещение 1987.
5. Лефковитс И., Пернис Б. Иммунологические методы исследований(3 том) Пер. с англ. – М.: Мир, 1988,-530с.
6. Березов Т.Т., Коровкин Б.Ф. Биологическая химия. Москва, "Медицина", 1998 год,-704с.
7. Сим Э. Биохимия мембран: Пер. с англ. – М.: Мир, 1985,-110с.
Дата: 2019-05-29, просмотров: 313.