Применение этих методов для мембранных белков может быть сопряжено с большими трудностями, вызванными связыванием детергента.
Для нахождения молекулярной массы белка используют два метода.
1. Прямо измеряют количество связанного детергента на 1 г белка. Для этого используют спектральные методы или радиоактивно меченный детергент, а для выделения комплексов применяют различные методы, например гель-фильтрацию. Установив относительное содержание белка и детергента в комплексе, cреднее значение парциального удельного объема получают как средневзвешенное соответствующих величин для чистого белка и чистого детергента. После этого без труда находят Mк, а поскольку соотношение между белком и детергентом в комплексе известно, находят молекулярную массу белка.
2. Измеряют S0 (коэффициент седиментации) в средах с разными значениями плотности раствора ρ. Такие среды обычно получают, используя смеси Н2О и D2O. Из графика зависимости S0 от ρ находят как Mк, так и Vк (ср). При этом предполагается, что Vк - это средневзвешенное соответствующих величин для чистого белка и чистого детергента.
Vк(ср) = (Доля белка) • V(ср) белок + (Доля детергента) • V(ср) детергент.
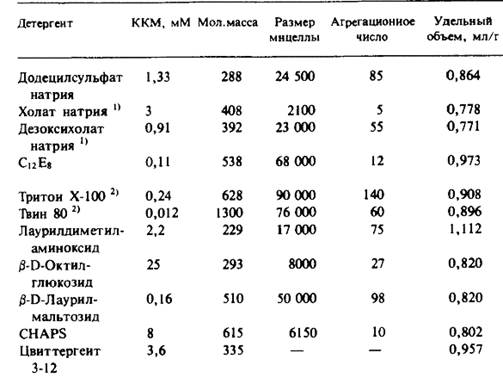
Оценив V(ср) белок и взяв V(ср) детергент из таблицы, получают молекулярную массу белковой составляющей Mк.
Для построения графика зависимости S0 от ρ проводят аналитическое центрифугирование. Можно проводить центрифугирование и в градиенте плотности сахарозы, используя смеси Н2О и D2O, но анализ результатов в этом случае гораздо сложнее, хотя принципиально не отличается от предыдущего случая.
Метод радиационной инактивации
Метод радиационной инактивации для определения размера мишени все чаще применяется при исследовании мембранных белков. Изучать можно как очищенные белки, так и неочищенные препараты, в том числе интактные биомембраны. Суть метода состоит в определении доли белковых молекул, получающих повреждения при облучении. Для этого используют ферментативные методы связывания гормонов или других лигандов или спектральные методы. Процедура состоит в следующем. Образец, обычно замороженный, подвергают высокоэнергетическому облучению (например, облучают пучком электронов из синхротрона). Через разные промежутки времени отбирают пробы, размораживают их и проводят измерения. Повреждения белка под действием излучения (в частности, разрыв ковалентных связей) выявляют, например, с помощью электрофореза в ПААГ с ДСН. Как показывает опыт, некоторые субъединицы полностью утрачивают биологическую активность при внесении радиационного повреждения в любое место полипептидной цепи. Ключевым моментом является то, что, чем крупнее белковая молекула, тем больше вероятность ее повреждения и, следовательно вероятность инактивации. Эта вероятность зависит не от формы молекулы, а от ее массы. Обычно для того, чтобы облегчить интерпретацию результатов, параллельно облучают белок с известной молекулярной массой. Если исследуемый белок содержит более одной субъединицы, возникают определенные трудности при анализе результатов.
Спектральные методы
Для определения содержания α - спиралей и β - слоев в мембранных белках используют несколько методов. В отсутствие трехмерной организации на их основе можно попытаться построить соответствующие модели. Чаще всего используется метод кругового дихроизма (КД). Все более широкое применение находят инфракрасная и рамановская спектроскопия, а также ЯМР.
Метод кругового дихроизма
Метод основан на измерении разности поглощения лево - и правополяризованного света; эта оптическая активность является мерой хиральности молекул, или мерой их асимметрии. В дальней ультрафиолетовой области (от 190 до 240 нм) КД определяется в основном поглощением амидов карбонильных групп полипептидного остова. При наличии участков вторичной структуры, например α-спиралей, спектр КД имеет вполне определенные особенности, связанные с особенностями электронного окружения амидных групп в этих структурах. Анализируя спектр КД белков, его обычно представляют как сумму компонентов, отвечающих поглощению разных участков белковой молекулы: α-спиралей, β-слоев и случайных клубков. Определив тем или иным способом спектры каждой из этих структур, производят их суммирование, подбирая соответствующие коэффициенты таким образом, чтобы было достигнуто наилучшее соответствие измеренному спектру. Подобранные весовые коэффициенты представляют собой ту долю, которая приходится в молекуле на каждый из типов вторичной структуры.
Эти методы были разработаны для растворимых белков, но нет никаких оснований сомневаться, что их можно с успехом применять и для мембранных белков. Скорее всего, у последних имеются участки с такими же типами вторичной структуры, как и у растворимых белков, и при их изучении возникнут такие же трудности. Некоторые белки можно изучать in situ, используя суспензии мембран. Примерами такого рода являются бактериородопсин из пурпурной мембраны Halobacterium halobium и Са2 + - АТР-аза из мембраны саркоплазматического ретикулума. Очищенные мембранные белки можно исследовать с помощью КД и в присутствии детергентов, если поглощение последних в дальней УФ-области не слишком велико, или в составе реконструированных везикул. Здесь возникают две проблемы:
1) дифференциальное светорассеяние, когда размер мембранных частиц гораздо больше длины волны света;
2) выравнивание поглощения из-за концентрирования белка в мембранах или везикулах, т.е. из-за негомогенности его распределения в растворе. Эти артефакты могут быть весьма существенными, однако их можно учесть с помощью соответствующих методов.
К сожалению, для внутренних мембранных белков отсутствуют структурные данные высокого разрешения, поэтому точная интерпретация спектров КД невозможна. За исключением нескольких случаев, разные спектральные методы не использовались для изучения одного и того же белка и количественное сравнение результатов не проводилось. Интересно, что для бактериородопсина, который исследовали методами КД, ИК и ЯМР, во всех трех случаях были получены одинаковые результаты, свидетельствующие о значительном содержании в этом белке β-слоев. Тем не менее у каждого метода имеются существенные недостатки. Так, данные о высоком содержании в бактериородопсине β-слоев (-46%) в значительной мере зависят от способа учета оптических артефактов. Судя по данным электронно-микроскопической реконструкции, характеризующимся относительно низким разрешением, в бактериородопсине 80% приходится на долю α-спиралей, а β-слои отсутствуют совсем. Чтобы понять причину этих несоответствий, необходимо провести структурный анализ белка с атомным разрешением.
Дата: 2019-05-29, просмотров: 270.