Розвиток техніки, яка зробила якісний стрибок у другій половині ХХ століття, істотно підвищив вимоги до джерел електричної енергії. Поява компактних ХДС стала дуже актуальною. Потрібні були ХДС, здатні зберігати заряд і працювати безупинно роками. Крім того зростає дефіцит кольорових металів, особливо срібла, що вимагає їхньої заміни іншими матеріалами. Рішення цих задач стало можливим на основі створення джерел струму з електролітами у неводних розчинниках.
У хімічних джерелах струму як відновники, як правило, використовують метали. Із зіставлення значень електродних потенціалів у ряді напруг металів випливає, що найбільш енергоємні анодні матеріали розташовані у верхньому лівому куті періодичної системи елементів. Теоретичні значення питомої енергії, що можуть забезпечити ці метали, складають (у Втгод/кг): для Li - 11757, Mg - 5216, Al - 4946, Са - 3837, Na - 3163. У той же час теоретичні значення питомої енергії для традиційних матеріалів ХДС дорівнюють: для Zn - 623, Fe - 423, Ni - 278, Cd - 190 Втгод/кг. Однак високі електродні потенціали роблять метали І, ІІ, ІІІ групи періодичної системи нестійкими у водному середовищі, що практично виключає їх використання у ХДС. Енергетичні можливості легких металів вдалося реалізувати лише після того, як було показано, що багато з них, і в першу чергу літій, стійкі і здатні анодно розчинятись у неводних розчинниках.
Існує ряд органічних сполук, які не містять у своїй молекулі рухливого атома водню і відносяться до класу апротонних диполярних розчинників (АДР.). В електролітах на основі цих розчинників літій не тільки може зберігатися на протязі багатьох років, але і виявляє поведінку, властиву рівноважним електродам. Зокрема, його потенціал підпорядковується рівнянню Нернста у широкому інтервалі концентрацій іонів літію, не залежить від перемішування розчину, швидко повертається до вихідного значення після малих катодних і анодних поляризацій.
Головним критерієм, за яким були прийняті до використання розчинники групи АДР, є їхня сумісність з літієм. У даний час відсутній строгий теоретичний підхід до вибору оптимального розчинника, тому у промисловому виробництві використовується ряд різних розчинників. До них відносяться у першу чергу прості і складні ефіри, головним чином циклічні: 1,2 - диметоксіетан (1,2 - ДМЕ), 1,3 - діоксолан (1,3 - ДО), метил форміат (МФ), пропілен карбонат (ПК), тетрагідрофуран (ТГФ).
Термодинамічними розрахунками було доведено, що система Li - АДР не є стійкою. Значення потенціалів для реакцій взаємодії літію з АДР можуть досягати 2,5 - 4,3 В, а продуктами реакції є сполуки, нерозчинні в АДР.
АДР мають невисоку сольватуючу здатність, і внаслідок цього в них добре розчиняються лише деякі літієві солі. Це, головним чином, сполуки із комплексними аніонами, що містять як центральний атом елементи третьої і п’ятої груп періодичної системи. Як електроліти у промисловому виробництві використовуються LiAs6, LiBF4, LiAlCl4, LiCl4, LiBr. Усі ці солі сильно гігроскопічні, що значно ускладнює і здорожує виробництво через труднощі глибокого осушування та необхідності захисту всього технологічного процесу від впливу атмосферної вологи.
Зараз у літієвих ХДС використовуються як тверді, так і рідкі катодні матеріали. Високий електродний потенціал літію дозволяє застосовувати не занадто активні окислювачі і при цьому одержувати електродні пари з ЕРС, більшою 3 В. Промисловість випускає елементи з простими (MnO2, CuO, V2O5) і складними (2PbOPbO2, 2PbOBi2O3, Ag2OCrO3) оксидними катодами, з катодами з SO2, SOCl2.
Розряд негативного літієвого електрода веде до його іонізації:
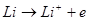
Присутність на поверхні літію оксидно - сольової плівки впливає на його потенціал і швидкість розряду.
У залежності від природи катодного матеріалу схеми електрохімічних реакцій можна зобразити рівняннями:
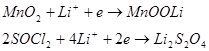
Найбільш поширене виробництво циліндричних та дискових елементів різних конструкцій.
Створення ХДС на основі неводних електролітів стимулювало розвиток теоретичних уявлень в області теорії розчинів, поверхневих явищ, нових типів неорганічних сполук, нестехіометричних сполук, теорії пористих електродів тощо. Теоретичні досягнення, у свою чергу, дозволяють очікувати істотного поліпшення нових поколінь ХДС.
ВИСНОВКИ
В наш час залишаються дуже актуальними акумулятори, адже більшість автомобільних транспортних засобів не може обходитись без цих хімічних джерел струму. Також дуже поширені цинково-манганові елементи, що дістали назви звичайної батарейки. Всі вони є надійними джерелами струму і слугують порівняно тривалий час.
Вичерпність природних ресурсів призводить до створення нових хімічних джерел струму, зараз ведеться активна робота по їх створенню. І допоможуть в цьому лужні метали. Вже зроблені перші кроки - створено хімічні джерела струму на основі літію, що знаходиться у контакті з органічним апротонним розчинником. Літієві джерела струму зарекомендували себе як дуже надійні. Зараз важко зустріти галузь деб не застосовувались такі елементи. Батареї мобільних телефонів і рацій, батарейки для годинників, калькуляторів, різноманітних приладів - майже скрізь працюють літієві хімічні джерела струму.
Саме вони стають найбільш актуальними у подальшому розвитку суспільства.
Паливні елементи є не актуальні, адже вони дуже енергоресурсоємкі, а коефіцієнт корисної дії порівняно низький.
Акумулятори також ще застосовуються, але вже існують пристрої, значно спрощеної дії ніж акумуляторів, і виконують ті ж самі функції.
Отже ера хімічних джерел струму продовжується, і невпинно крокує вперед.
ВИКОРИСТАНА ЛІТЕРАТУРА
1. Герасимов Я.И., Курс физической химии, т. ІІ, издание 2, испр., М., "Химия", 1973.
2. Лебідь В.І., Фізична хімія, Харків, "Фоліо", 2005.
3. Льоцци М., История физики, М., "Мир", 1970.
Дата: 2019-05-29, просмотров: 294.