Анодом є пориста цинкова пластинка, катодом оксиди срібла Ag2O і AgO, отримані електролітичним окисненням металічного срібла. Електроліт - концентрований розчин КОН, насичений цинкатом калія Zn(OK) 2. Заряджений акумулятор може бути представлений у вигляді:
(-) Zn | Zn(OK) 2 + KOH(40%) | Ag2O або AgO | Ag (+)
Сумарна реакція в цьому елементі
AgO + Zn = ZnO + Ag
Процес проходить у дві стадії: AgO відновлюється спочатку до Ag2O, далі до металічного срібла. ЕРС елементів з катодом AgO рівна 1,86 В, з катодом Ag2O - 1,58-1,60 В. При малій густині струму напруга падає на 0,3 В при переході від першої стадії до другої. Практично використовується лише друга стадія.
Після розряду акумулятора:
(-) Zn | ZnO, Zn(OK) 2 + KOH (40%) | Ag (+)
В таких акумуляторах на відміну від свинцевих і лужних електроліт в реакціях заряду і розряду не приймає участі, саме цьому його можна брати в малій кількості. Це дозволило сконструювати акумулятори, що мають дуже ефективну конструкцію: електроди знаходяться один біля одного і розділені тонким шаром целофану. Весь електроліт знаходиться в порах електродів. Срібно - цинкові акумулятори мають велику ємність, високу енергію і високу потужність на одиницю маси і об’єму, саме цьому вони широко застосовуються там, де необхідні акумулятори невеликого розміру.
ПАЛИВНІ ЕЛЕМЕНТИ
У наш час велика частина електроенергії виробляється на теплових електростанціях при спалюванні природних енергоносіїв (вугілля, нафти, природного газу). При цьому процес перетворення хімічної енергії палива в електричну проходить через три стадії: перетворення хімічної енергії у теплову при згоранні палива; далі - теплової енергії у механічну роботу у паровій машині; нарешті, перетворення механічної роботи в електроенергію у генераторі. На всіх цих стадіях втрачається енергія і коефіцієнт корисної дії (ККД) сучасних теплових електростанцій становить близько 40%, а для більшості електростанцій - 25%.
Термодинамічний аналіз, проведений ще в кінці XIX ст. ., показав, що в гальванічних елементах немає такого обмеження ККД, як у теплових машинах. У 1893 р. Нернст обчислив, що якби вдалося перетворювати хімічну енергію вугілля в електричну електрохімічним шляхом, то максимальний теоретичний ККД такого процесу становив би 99,75%. Однак через чисельні технічні труднощі перші працездатні паливні елементи вдалося створити лише у 30 - 40 - х роках ХХ ст. .
Паливними елементами називають гальванічні елементи, в яких електрохімічно активними речовинами слугують звичайні горючі речовини і кисень, а процесом генерування струму є окислення горючих речовин. При роботі елемента проводиться безперервна подача реагентів і відвідення продуктів реакції, так що склад системи практично не змінюється.
При роботі будь-якого хімічного джерела струму проходить сумарна хімічна реакція взаємодії окисника з відновником. Максимальна електрична робота, отримана при роботі джерела струму, рівна зменшенню ізобарного потенціалу для цієї реакції:
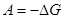
Перетворення енергії у електричну шляхом паливних елементів доволі складний процес. Максимальна електрична робота, отримана при складному перетворенні, визначається тепловим ефектом реакції 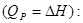
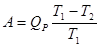
Найбільш реакційно здатним видом палива є водень. Воднево - кисневі елементи зазвичай виготовляють з застосуванням мілко дрібних вугільних або нікелевих електродів, що занурені в лужний розчин електроліту. Схематично такий елемент можна уявити в такому вигляді:
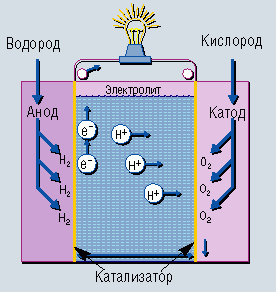 |
(-) (Ni) H2 | KOH (30-40%) | O2(Ni) (+)
Малюнок 4. Воднево-кисневий паливний елемент
При роботі елемента на негативному електроді протікає електродна реакція:
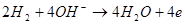
На позитивному
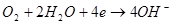
Сумарна реакція
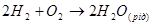
Теоретичне значення ЕРС воднево - кисневого елемента при 250С дорівнює 1,229 В і не залежить від складу розчину - електроліту.
При розряді воднево - кисневих елементів напруга тримається у межах 07, - 0,9 В, в залежності від густини розрядного струму на електродах (в лучних конструкціях елементів густина струму сягає 200-300 ма/см2).
Інші види газоподібного палива (оксид вуглецю, вуглеводні) практично можуть бути застосовані у паливних елементах тільки при підвищених температурах (вище 400-5000С). У таких високотемпературних елементах у якості електроліту використовують або розплави вуглецевих солей лужних металів, або тверді електроліти з аніонною (кисневою) проводністю.
Спроби безпосередньо використовувати тверде вугілля у паливних елементах поки безуспішні. Вугілля може бути використане тільки після попередньої газифікації його. Якщо газифікацію проводити за допомогою СО2, спостерігається наступна послідовність реакцій:
Газифікація 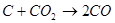
В паливному елементі 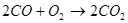
Сумарна реакція 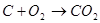
Водень - кисневий елемент можна створити, наприклад, за допомогою двох платинових електродів, занурених у водний розчин гідроксиду калію. Один електрод омивається воднем, інший - киснем;
Pt(H2) | KOH, насичений H2 | KOH, насичений О2 | (O2) Pt.
У цьому елементі окиснення водню і відновлення кисню просторово розділені, і струм генерується у процесі реакцій:
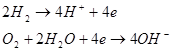
Тобто сумарний процес зводиться до окиснення водню киснем з утворенням води. Істотним недоліком, такого паливного елемента є дуже мала густина струму. Для збільшення густини струму використовують підвищений тиск і температуру, спеціальні конструкції електродів, перемішування розчину тощо.
Розробка паливних елементів продовжується. Принципово доведена можливість використання деяких видів палива в паливних елементах і перетворення їх хімічної енергії в електричну з практичним ККД до 75 - 90%.
Дата: 2019-05-29, просмотров: 324.