Как уже было сказано выше, наиболее характерной для органических соединений является ковалентная связь. Она образуется за счет общих электронных пар. Образование ковалентной связи выгодно обоим атомам (они приобретают завершенный электронный слой), поэтому ковалентная связь прочная. Органические соединения обычно имеют молекулярное строение. Ковалентная связь обычно образуется за счет неспаренных электронов двух атомов. Углерод использует все свои валентные электроны и образует четыре связи. Но некоторые атомы (азот, кислород, сера) для образования связей в молекуле могут используют не все свои валентные электроны, а только неспаренные. Неподеленные пары электронов таких атомов могут участвовать в образовании дополнительных связей по донорно-акцепторному механизму. Кроме того, такой атом с неподеленной парой электронов, может взаимодействовать с атомом с пониженной электронной плотностью ( δ+) из другой молекулы или другой части большой органической молекулы. Чаще всего таким атомом является водород. В результате такого взаимодействия возникает водородная связь, которую графически обозначают обычно тремя точками. Энергия водородной связи невелика (1—40 кДж/моль) и в основном определяется электростатическим взаимодействием. Водородные связи способствует стабилизации формы сложных органических молекул (белки) или ассоциации небольших молекул в димеры (спирты и карбоновые кислоты).
При образовании соединения атом углерода переходит в «возбужденное состояние» и один из двух s- электронов переходит на свободную р-орбиталь. Таким образом атом получает четыре неспаренных электрона и может образовать четыре ковалентные связи. Но это разные орбитали и одна из этих связей должна отличаться от остальных. Но изучение связей в органических соединениях привело к необходимости использовать понятие гибридизации орбиталей. Гибридизация электронных орбиталей – это выравнивание их по размерам и форме, а значит и по энергии. (Гибридизацию следует понимать, как математическую модель, а не некий физический процесс.) В зависимости от числа орбиталей, принимающих участие в гибридизации различают три вида: sp3 , sp2 и sp-гибридизацию.
Рассмотрим первую из них - sp3 – гибридизацию.
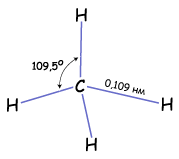
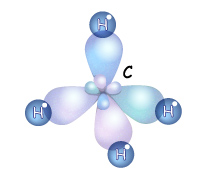
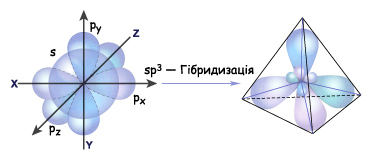
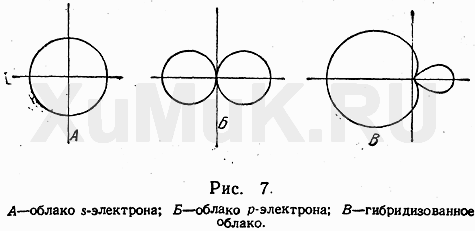
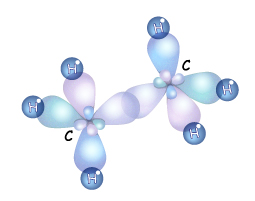
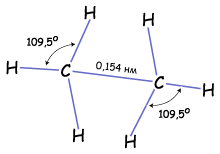 Итак, если гибридизации подвергаются четыре разных орбитали, то и образуется четыре орбитали. Но это уже одинаковые гибридные орбитали. Форма гибридной орбитали – неправильная объемная восьмерка. Орбитали максимально удалены друг от друга (электронные облака заряжены отрицательно и отталкиваются друг от друга), и поэтому их вершины направлены к вершинам тетраэдра. Угол между связями примерно 1090. Если атом углерода находится в состоянии sp3 – гибридизации, то все четыре гибридные орбитали перекрываются с гибридными или негибридными орбиталями других атомов на прямых, связывающей центры этих атомов и углерода и образуют прочные
Итак, если гибридизации подвергаются четыре разных орбитали, то и образуется четыре орбитали. Но это уже одинаковые гибридные орбитали. Форма гибридной орбитали – неправильная объемная восьмерка. Орбитали максимально удалены друг от друга (электронные облака заряжены отрицательно и отталкиваются друг от друга), и поэтому их вершины направлены к вершинам тетраэдра. Угол между связями примерно 1090. Если атом углерода находится в состоянии sp3 – гибридизации, то все четыре гибридные орбитали перекрываются с гибридными или негибридными орбиталями других атомов на прямых, связывающей центры этих атомов и углерода и образуют прочные  -связи (сигма-связи). в молекулах углеводородов. Т.е. если атом углерода образует четыре связи с четырьмя разными атомами, то он находится в состоянии sp3-гибридизации, и угол между ними 1090.
-связи (сигма-связи). в молекулах углеводородов. Т.е. если атом углерода образует четыре связи с четырьмя разными атомами, то он находится в состоянии sp3-гибридизации, и угол между ними 1090.
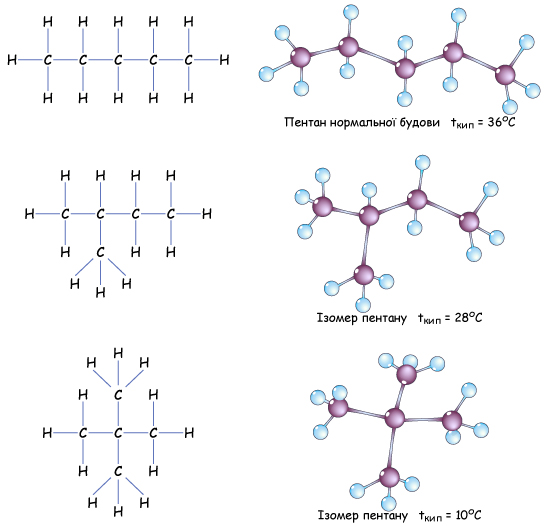 Этот тип гибридизации является самым распространенным в органических соединениях. Это означает что молекулы органических соединений не имеют линейного строения, а зигзагообразно изогнуты в пространстве. А так как вокруг одинарных связей возможно свободное вращение без разрыва этой связи, то форма органической молекулы в пространстве может меняться.
Этот тип гибридизации является самым распространенным в органических соединениях. Это означает что молекулы органических соединений не имеют линейного строения, а зигзагообразно изогнуты в пространстве. А так как вокруг одинарных связей возможно свободное вращение без разрыва этой связи, то форма органической молекулы в пространстве может меняться.
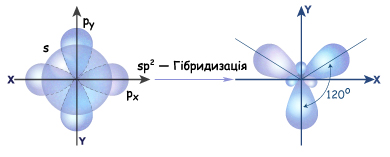
Если атом углерода находится в состоянии sp2-гибридизации, значит смешиваются одна s-орбиталь и две р-орбитали и образуются три гибридные sp2-орбитали. Они по форме очень похожи на sp3-орбитали, но немного короче (меньше вклад р-орбиталей). Все три гибридные орбитали лежат в одной плоскости и максимально удалены друг от друга (т.е. находятся под углом 1200). Одна из р-орбиталей сохраняет форму правильной объемной восьмерки и располагается перпендикулярно плоскости, в которой лежат эти три гибридные орбитали. При сближении двух атомов, которые находятся в sp2гибридном состоянии, перекрываются их гибридные орбитали на прямой, которая соединяет центры этих атомов. Т.е. образуется  -связь.
-связь.
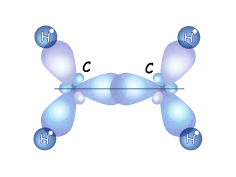
 Но при сближении атомов происходит перекрывание и двух негибридных р-орбиталей, расположенных
Но при сближении атомов происходит перекрывание и двух негибридных р-орбиталей, расположенных
параллельно друг другу. Область перекрывания лежит над и под плоскостью, в которой находятся  -связи этих атомов. Так между двумя sp2 –гибридными атомами образуется дополнительная связь, которую называют
-связи этих атомов. Так между двумя sp2 –гибридными атомами образуется дополнительная связь, которую называют 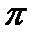 -связью. Такое боковое перекрывание оказывается менее эффективно, чем осевое, и значит связь менее прочной. Итак,
-связью. Такое боковое перекрывание оказывается менее эффективно, чем осевое, и значит связь менее прочной. Итак, 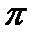 -связь образована за счет перекрывания негибридных р-орбиталей вне прямой соединяющей центры атомов, перпендикулярно плоскости в которой лежат
-связь образована за счет перекрывания негибридных р-орбиталей вне прямой соединяющей центры атомов, перпендикулярно плоскости в которой лежат  связи. Комбинацию из одной
связи. Комбинацию из одной  -связи и одной
-связи и одной 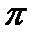 -связи называют двойной связью и обозначают двумя черточками.
-связи называют двойной связью и обозначают двумя черточками.
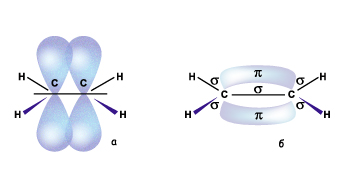
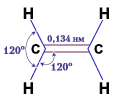 Например,
Например,  -связь в молекуле этена образована за счет перекрывания гибридных электронных орбиталей на прямой соединяющей центры атомов (С-С и С-Н). А
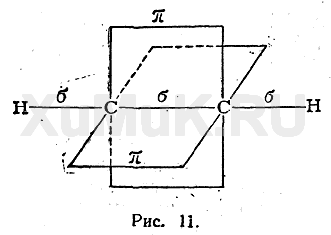
-связь в молекуле этена образована за счет перекрывания гибридных электронных орбиталей на прямой соединяющей центры атомов (С-С и С-Н). А 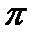 -связь образуется между атомами углерода за счет негибридных р-орбиталей. Таким образом между атомами углерода в этене образуется двойная связь. Структурную формулу этена записывают обычно СН2=СН2. Но мы должны помнить, что связи в молекуле расположены по углом в 120о и лежат все в одной плоскости.
-связь образуется между атомами углерода за счет негибридных р-орбиталей. Таким образом между атомами углерода в этене образуется двойная связь. Структурную формулу этена записывают обычно СН2=СН2. Но мы должны помнить, что связи в молекуле расположены по углом в 120о и лежат все в одной плоскости.
Аналогичное строение имеет двойная связь между атомами С= О и С=N, только такая связь полярна. Надо помнить, что несмотря на то что в структурной формуле мы рисует одинаковые черточки, это две разные связи.  -связь более прочная, а
-связь более прочная, а 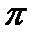 -связь намного слабее и легко разрывается. Но вокруг
-связь намного слабее и легко разрывается. Но вокруг 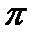 -связи невозможно свободное вращение, она делает молекулу «жесткой». Двойные связи характерны для углеводородов (алкены и алкадиены) и для карбонильных соединений (альдегидов, кетонов).
-связи невозможно свободное вращение, она делает молекулу «жесткой». Двойные связи характерны для углеводородов (алкены и алкадиены) и для карбонильных соединений (альдегидов, кетонов).
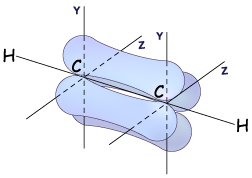
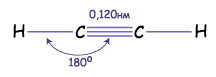
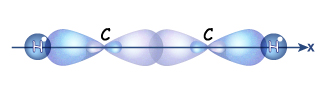
Гораздо реже встречается третий тип гибридизации углерода, в котором участвуют s-орбиталь и одна р-орбиталь. Две равноценные гибридные орбитали атома углерода в этом случае расположены на одной прямой и направлены в противоположные стороны (угол между ними – 180о). Большая доля у них еще более укорочена (вклад р-орбитали еще меньше). Они образуют в результате перекрывания с другими орбиталями  -связи. Две негибридные р-орбитали расположены перпендикулярно прямой, на которой лежат атомы углерода связанные этой
-связи. Две негибридные р-орбитали расположены перпендикулярно прямой, на которой лежат атомы углерода связанные этой  -связью, и за счет бокового перекрывания они образуют две
-связью, и за счет бокового перекрывания они образуют две 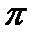 -связи. В итоге в молекуле алкинов образуется т.н. «тройная связь».
-связи. В итоге в молекуле алкинов образуется т.н. «тройная связь».
Надо помнить, что несмотря на то что в структурной формуле мы рисует одинаковые черточки, это связи разные, одна прочная  -связь и две
-связь и две 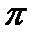 -связи, которые легко разрываются. Четыре атома в молекуле с тройной связью лежат на одной прямой.
-связи, которые легко разрываются. Четыре атома в молекуле с тройной связью лежат на одной прямой.
Итак: Химическая связь в молекулах характеризуется длиной, энергией и полярностью. Длина связи зависит от размера атомов, между которыми возникает, но дополнительное 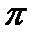 связывание приводит к уменьшению расстояния между ядрами, поэтому тройная связь короче двойной, а двойная короче одинарной. Энергия связи – это энергия, которая выделяется при ее образовании или необходима для ее разрыва. Энергия двойной связи (620 кДж/моль) меньше удвоенного значения энергии одинарной связи (350 кДж/моль). А это значит, что энергия
связывание приводит к уменьшению расстояния между ядрами, поэтому тройная связь короче двойной, а двойная короче одинарной. Энергия связи – это энергия, которая выделяется при ее образовании или необходима для ее разрыва. Энергия двойной связи (620 кДж/моль) меньше удвоенного значения энергии одинарной связи (350 кДж/моль). А это значит, что энергия 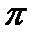 -связи меньше, чем у
-связи меньше, чем у  -связи. Полярность связи характеризует неравномерность распределения электронной плотности между атомами с различной ЭО. Появление зарядов на атомах (даже частичных!) очень сильно изменяет реакционную способность вещества.
-связи. Полярность связи характеризует неравномерность распределения электронной плотности между атомами с различной ЭО. Появление зарядов на атомах (даже частичных!) очень сильно изменяет реакционную способность вещества.
Дата: 2019-04-23, просмотров: 340.