Реакция почвы обусловлена наличием и соотношением в почвенном растворе водородных (H+) и гидроксильных (ОН-) ионов и характеризуется рН — отрицательным логарифмом активности водородных ионов в растворе. В зависимости от состава растворенных веществ и характера их взаимодействия с твердой фазой почв, почвы могут иметь нейтральную (рН 7), кислую (рН<7)или щелочную (рН>7) реакцию.
Реакция почвы зависит от совокупного действия ряда факторов: химического и минералогического состава минеральной части почвы, наличия свободных солей, содержания и качества органического вещества, состава почвенного воздуха, влажности почвы, жизнедеятельности организмов. Важнейшим регулятором реакции почвы являются находящиеся в ней соли. Нейтральные,
кислые, щелочные соли, переходя из твердой фазы в раствор при увлажнении и обратно при иссушении, оказывают соответствующее влияние на характер реакции почвенного раствора.
Одной из наиболее распространенных в почве минеральных кислот является угольная кислота. В зависимости от термодинамических условий и биологической активности она может поддерживать рН почвы в пределах 3,9—4,5—5,7. Режим углекислоты в почвах тесно связан с суточно-сезонными ритмами погоды, с активностью микроорганизмов.
При окислении сернистых металлов (сульфидов) в почвах и почвообразующих породах может образоваться серная кислота, которая вызывает сильное подкисление почв (при осушении мангровых или маршевых почв их рН может упасть с 7—8 до 2—3).
Значительное подкисление почвенного раствора могут вызывать ненасыщенные катионами гуминовые кислоты и фульвокислоты (рН может снижаться до 3—3,5). Малоразложившиеся остатки органического вещества лесной подстилки имеют рН 3,5—5, мхов — 2,5—3. В результате жизнедеятельности грибов и бактерий, разложения растительного опада, выделения корнями или насекомыми в почве могут присутствовать свободные органические кислоты типа уксусной, щавелевой, лимонной и др. В процессе своей жизнедеятельности растения, потребляя из почвы в различных пропорциях анионы и катионы, выделяя в почву эквивалентное количество ионов Н+, ОН-, НСО-3, СО3-2, могут вызывать сдвиг реакции почвенного раствора в ту или иную сторону. Значительная роль в регулировании реакции почвенного раствора принадлежит микроорганизмам. Например, деятельность бактерий нитрификаторов может вызвать появление на короткое время в почвенном растворе азотной и азотистой кислот и снизить рН на 0,5—2,0. При разложении белков под воздействием микроорганизмов происходит поступление в раствор небольшого количества серной кислоты.
Кислотность почв
Различают актуальную (активную) и потенциальную кислотность почв в зависимости от того, при каком взаимодействии она проявляется и измеряется.
Актуальная кислотность почвы обусловлена наличием водородных ионов (протонов) в почвенном растворе, активность которых зависит от свойств (ионной силы) раствора, влияющих на коэффициент активности иона. Актуальная кислотность почвы измеряется при взаимодействии почвы с дистиллированной водой [водный рН, рНН2О, рН(Н2O)] при разбавлении 1:2,5 либо в пасте. Иногда рН почвы измеряют непосредственно в почве при естественной влажности, но для этого она должна быть достаточно увлажненной и гомогенной для обеспечения надежного контакта с измерительным электродом. Можно актуальную кислотность почвы измерять и путем титрования. И величина актуальной кислотности определяется теми вышеперечисленными веществами, химическими соединениями и продуктами жизнедеятельности почвенных микроорганизмов.
Потенциальная кислотность — способность почвы при взаимодействии с растворами солей проявлять себя как слабая кислота.
Потенциальная кислотность определяется свойствами твердой фазы почвы, обусловливающей появление дополнительного количества протонов в почвенном растворе .
Кислая реакция солевых вытяжек из почв объясняется появлением в растворе ионов водорода (гидроксония Н3О+) в результате вытеснения из почвенного поглощающего комплекса
В зависимости от характера взаимодействующего с почвой раствора различают две формыпотенциальной кислотности почв — обменную и гидролитическую, характеризующиеся как последовательные этапы выделения в раствор дополнительных количеств протонов из твердой фазы.
Обменная кислотность обнаруживается при взаимодействии с почвой растворов нейтральных солей. При этом происходит эквивалентный обмен катиона нейтральной соли на ионы водорода, алюминия и другие, находящиеся в поглощающем комплексе. Обычно для определения обменной кислотности почв используют 1 н. раствор КСl (рН около 6,0).
Природа обменной кислотности зависит от состава и свойств почвенных коллоидов. Кислотность органических почвенных коллоидов (гумусовые кислоты) обусловлена главным образом обменным водородом, причем непосредственным источником обменного водорода служат органические кислоты, включая гумусовые. Кислотность минеральных коллоидов связана с наличием в почвенном поглощающем комплексе обменных ионов водорода, алюминия или железа. Источником обменных алюминия и железа служат ионы кристаллической решетки глинистых минералов и гидроксидов.
При взаимодействии кислой почвы с раствором хлорида калия в результате обмена калия на водород в растворе появляется соляная кислота, а при обмене на алюминий — хлорид алюминия.
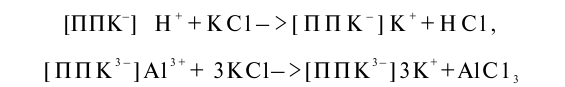
АlСlз — это соль слабого основания и сильной кислоты, гидролитически расщепляющаяся с образованием соляной кислоты и гидроксида алюминия.
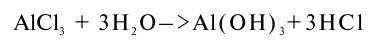
Образующаяся в растворе кислота оттитровывается щелочью (кислотность выражается в мг-экв/100 г) или определяется по рН раствора, который в данном случае характеризуется как солевой рН, рНKCl, рН(КСl) По значениям рН можно ориентировочно определить роль различных ионов в образовании кислотности. При рН меньше 4,0 кислотность обусловлена главным образом обменным водородом, при рН от 4,0 до 5,5 — обменным алюминием. В кислых почвах (подзолистые, серые лесные, красноземы) солевой рН всегда меньше, чем водный рН, поскольку в этих почвах имеется обменный водород и (или) алюминий Для насыщенных основаниями почв солевой рН не определяется.
Гидролитическая кислотность обнаруживается при воздействии на почву раствора гидролитически щелочной соли сильного основания и слабой кислоты, при котором происходит более полное вытеснение поглощенных водорода и других кислотных ионов. Для определения гидролитической кислотности обычно используют 1 и раствор CH3COONa с рН 8,2 При взаимодействии уксуснокислого натрия с почвой могут происходить реакции
в зависимости от содержания в ней алюминия или водорода, аналогичные приведенным выше.
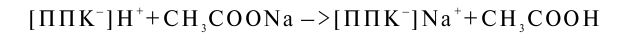
Количество образующейся уксусной кислоты, определяемое титрованием, характеризует гидролитическую кислотность почвы.
При наличии в почве обменного алюминия образующийся в результате обменной реакции уксуснокислый алюминий распадается на гидроксид алюминия и уксусную кислоту. Так как нейтральная соль вытесняет лишь часть поглощенного водорода, а гидролитически щелочная соль — почти весь, то гидролитическая кислотность обычно больше обменной. Иногда гидролитическая кислотность оказывается меньше обменной за счет поглощения почвой анионов уксусной кислоты и вытеснения ионов ОН–, в результате чего уменьшается кислотность вытяжек.
Наличие потенциальной кислотности характерно для почв, обедненных основаниями (Са2+, Mg2+ и др.). Чем больше почва обеднена основаниями, тем резче проявляет она кислотные свойства.
В природе распространение кислых почв связано с определенными условиями почвообразования (подзолистые, бурые лесные, красноземы, желтоземы). Большое значение в образовании почв с той или иной реакцией имеет характер почвообразующей породы. Подзолистые почвы, бедные основаниями, в основном приурочены к выщелоченным, бескарбонатным породам. Характер почвообразовательного процесса откладывает существенный отпечаток на формирование реакции почв. В одних случаях этот процесс приводит к потере оснований и подкислению (подзолистый процесс), в других — наблюдается постепенное обогащение почвы основаниями (дерновый процесс). Большое значение в формировании кислых почв имеют климатические условия. Промывной характер водного режима приводит к выносу солей из почвы, способствует выходу в раствор поглощенных Са2+, Mg2+в обмен на водородные ионы и их последующему выщелачиванию. Растительность также оказывает влияние на характер почвенной реакции. Хвойные леса и сфагнум способствуют усилению кислотности благодаря кислым свойствам их органических остатков; лиственные леса и травянистая растительность благоприятствуют накоплению оснований. Сельскохозяйственная деятельность человека вызывает изменение почвенной реакции. Само отчуждение урожаев с полей приводит к постепенному обеднению почв элементами, входящими в состав растений, в том числе и основаниями. Длительная обработка почвы в условиях зоны подзолистых почв способствует обеднению ее Са2+ и Mg2+. Снизить рН почвы может и внесение физиологически кислых минеральных удобрений.
Кислая реакция почв неблагоприятна для большинства культурных растений и полезных микроорганизмов. Кислые почвы обладают плохими физическими свойствами. Из-за недостатка оснований органическое вещество в этих почвах не закрепляется, почвы обеднены питательными веществами. Степень отрицательного влияния кислой реакции почв на растения зависит от того, какой элемент является причиной почвенной кислотности — водород или алюминий. Алюминий оказывает на растения более сильное токсическое действие, чем водород.
Доля участия в почвенном поглощающем комплексе обменных катионов водорода и алюминия, определяемых как обменная или гидролитическая кислотность, характеризует ненасыщенность почв основаниями. Степень насыщенности почв основаниями — это количество обменных оснований (обычно Са2++Mg2+), выраженные в процентах от емкости поглощения.
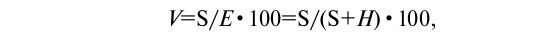
где V — степень насыщенности основаниями, %, S — сумма обменных оснований, мг-экв/100 г, Е — емкость поглощения, мгэкв/100 г, Н—гидролитическая кислотность, мг-экв/100 г. Таким образом, ненасыщенность почв основаниями характеризуется разностью между емкостью поглощения при избранном значении рН и содержанием в почве обменных оснований.
Основным методом повышения продуктивности кислых почв, снижения их кислотности служит известкование. При внесении извести СаСО3 при наличии избытка углекислоты переходит в растворимый Са(НС03)2, который взаимодействует с почвой по следующей схеме:
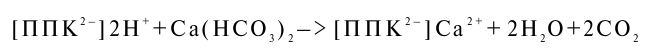
Почвы с высокой степенью насыщенности не нуждаются в известковании Путем сопоставления степени насыщенности почв с отзывчивостью на известкование в полевых опытах установлена следующая примерная шкала.

Щелочность почв
Щелочная реакция почвенных растворов и водных вытяжек может быть обусловлена различными по составу соединениями: карбонатами и гидрокарбонатами щелочных и щелочно-земельных элементов, силикатами, алюминатами, гуматами натрия. Щелочная реакция, может быть обусловлена анионами слабых кислот, которые переходят из твердой фазы почв в почвенные растворы и водные вытяжки и могут проявлять основные свойства. Роль оснований-анионов будет тем выше, чем большей константой
Кb они будут характеризоваться. Так, карбонат-ион — более сильное основание, чем гидрокарбонат-ион, так как константа равновесия процесса
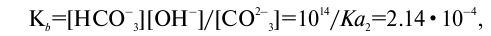
тогда как константа равновесия процесса HCO3–+ H2O <–><–> Н2СO3 + ОН–
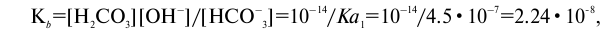
что свидетельствует о том, что ион НСО3– — более слабое основание, чем ион СО32-.
В создании щелочной реакции почвенных растворов и вытяжек принимают участие и другие анионы:
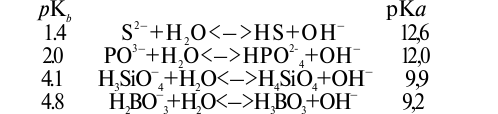
Определяющим моментом в создании щелочной реакции является присутствие в почве гидролитически щелочных солей (слабых кислот и сильных оснований): карбонатов натрия и калия, гидрокарбонатов натрия и калия, карбонатов кальция и магния, гидрокарбоната кальция и др. Так же себя ведут гуматы и фульваты щелочей.
Различают актуальную (активную) и потенциальную щелочность почвы.
Актуальная щелочность обусловлена наличием в почвенном растворе гидролитически щелочных солей, при диссоциации которых образуется в значительных количествах гидроксильный ион. При характеристике актуальной щелочности природных вод и почвенных растворов различают общую щелочность, щелочность от нормальных карбонатов и щелочность от гидрокарбонатов. Эти виды щелочности различаются по граничным значениям рН. Щелочность почвы определяется путем титрования водной вытяжки или почвенного раствора кислотой в присутствии различных индикаторов и выражается в миллиграм-эквивалентах на 100 г почвы. Общая щелочность определяется титрованием по индикатору метиловому оранжевому. Кроме общего содержания гидролитически щелочных солей на общую щелочность будут влиять и анионы — основания. Щелочность от нормальных карбонатов является результатом обменных реакций почв, содержащих поглощенный натрий. Она появляется также в результате жизнедеятельности сульфатредуцирующих бактерий, восстанавливающих в анаэробных условиях и в присутствии органического вещества сернокислые соли натрия с образованием соды. Определяется щелочность от нормальных карбонатов титрованием в присутствии фенолфталеина. При этом на результаты анализа будет влиять и наличие анионов-оснований с ярко выраженными основными свойствами: сульфид- и фосфат-ионов, анионов кремниевой и борной кислот; а также гидроксокомплексов некоторых металлов, например Аl(Н2O)2(ОН)–4 :
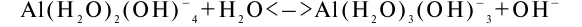
Потенциальная щелочность проявляется у почв, содержащих поглощенный натрий. При взаимодействии почвы с углекислотой поглощенный натрий в почвенном поглощающем комплексе замещается водородом и появляется сода, которая подщелачивает раствор: [ППК2–]2Na++H2CO3<–>[ППК2–]2H++Na2CO3.
Сильнощелочная реакция неблагоприятна для большинства растений. Высокая щелочность обусловливает низкое плодородие многих почв, неблагоприятные физические и химические их свойства. При рН около 9—10 почвы отличаются большой вязкостью, липкостью, водонепроницаемостью во влажном состоянии, значительной твердостью, цементированностью и бесструктурностью в сухом состоянии.
Для химической мелиорации щелочных содово-засоленных почв необходимы замещение обменного натрия на кальций и нейтрализация свободной соды:
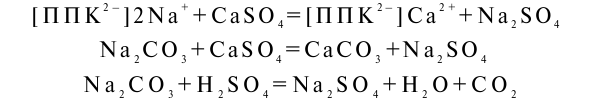
Химическая мелиорация щелочных почв производится путем внесения гипса.
Буферность почвы
Буферностью называется способность почвы противостоять изменению ее актуальной реакции под воздействием различных факторов.
Различают буферность почв против кислотных и буферность против щелочных агентов. Буферность почвы определяется свойствами ее твердой фазы, главным образом почвенных коллоидов. Кислота или щелочь, появляющиеся в почвенном растворе, вступают во взаимодействие с почвенными коллоидами, что ослабляет сдвиг реакции.
При взаимодействии почвы с кислотой происходит реакция обмена между обменными катионами и водородным ионом кислоты, в результате чего водородный ион оказывается связанным с твердой фазой почвы, а в растворе появляются катионы:
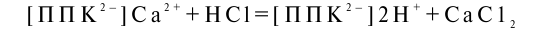
Если в почве появляется щелочь, водород или алюминий поглощающего комплекса обмениваются с катионами щелочи, которая нейтрализуется:
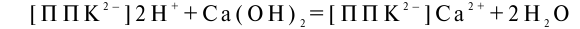
Кроме почвенных коллоидов твердая фаза почв может содержать другие факторы буферности — малорастворимые простые соли основного или кислотного характера, которые могут взаимодействовать с растворами и ослаблять сдвиг реакции.
Буферность почвы зависит от: 1) количества почвенных коллоидов (чем больше коллоидов в почве, тем выше ее буферность; песчаные почвы почти не обладают буферностью); 2) состава почвенных коллоидов (чем выше в почвах содержание гумуса, монтмориллонита и почвенных коллоидов с широким отношением кремнезема к глинозему, тем выше их буферность по отношению к изменениям реакции как в кислом, так и в щелочном интервале; буферность возрастает параллельно увеличению емкости поглощения почв); 3) состава обменных катионов (наличие большого количества катионов Са2+, Mg2+, Na+ и других оснований создает значительную буферность в кислую сторону; почвы, имеющие в составе обменных катионов Н+ или Аl3+ и способные поглощать щелочь, обнаруживают буферность в щелочную сторону).
Буферность почв и почвенных растворов определяется путем их титрования:
1) по отношению к кислотам — растворами кислот; 2) по отношению к щелочам — растворами едких щелочей; 3) по отношению к соде — растворами соды.
При добавлении небольших порций реактива (кислоты или щелочи) производится измерение рН почвенного раствора и строится кривая титрования, описывающая буферную способность почв.
Для почв высокой буферности кривая изменения рН при титровании отличается постепенностью изменений, в то время как для почв малой буферности она характеризуется резкостью переходов (рис. 40).
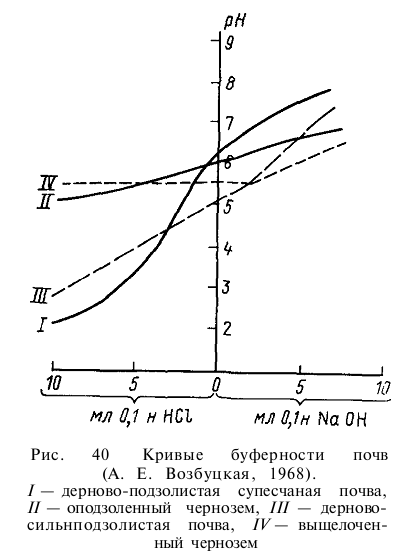
Высокой буферностью в отношении кислот и низкой — против щелочей — отличаются гумусированные маловыщелоченные, богатые углекислыми солями почвы степных, полупустынных и пустынных областей. Высокой буферностью против щелочных агентов обладают глинистые почвы, содержащие значительные количества обменных Н+ и Аl3+ и кислых гумусовых соединений (табл. 38).
Кислотно-основная буферность основных типов почв
Таблица 38

Буферная способность является одним из элементов почвенного плодородия. Она позволяет сохранять благоприятные для растений свойства почв. Буферность почвы необходимо учитывать при проведении химической мелиорации (при известковании и гипсовании), так как при повышенной кислотности или щелочности почва, обладающая буферностью, сопротивляется изменению реакции, что требует внесения повышенных доз химических мелиорантов.
Дата: 2019-05-28, просмотров: 1120.