Основным механизмом физико-химической, или обменной, поглотительной способности почв является процесс сорбции. Неспецифическая, или обменная, сорбция катионов — способность катионов диффузного слоя почвенных коллоидов обмениваться на эквивалентное количество катионов соприкасающегося с ним раствора. Обменные катионы составляют небольшую часть от их общего содержания в почве. В обменном состоянии в
почвах обычно находятся Са2+, Mg2+, К+, NH+4, Na+, Mn2+, Fe2+, F3+, Al3+.
В незначительных количествах могут встречаться и иные катионы (Li+, Sr2+ и др.)
Основными закономерностями обменной сорбции катионов являются: 1. эквивалентность обмена между поглощенными катионами почвы и катионами взаимодействующего раствора. Термодинамическая константа полностью обратимого (равновесного) обмена двух одинаково заряженных катионов А и В должна быть равна 1:
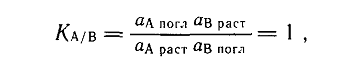
где аA и аВ — активности катионов в поглощенном состоянии и в равновесном окружающем растворе;
2) в ряду разновалентных ионов энергия поглощения возрастает с увеличением валентности иона: Li+ < Na+ < K+ < <NH+4 < Cs+ << Mg2+< Са2+<< Al3+ <Fe3. Под энергией поглощения понимается относительное количество поглощения катионов почвами при одинаковой их концентрации в растворе;
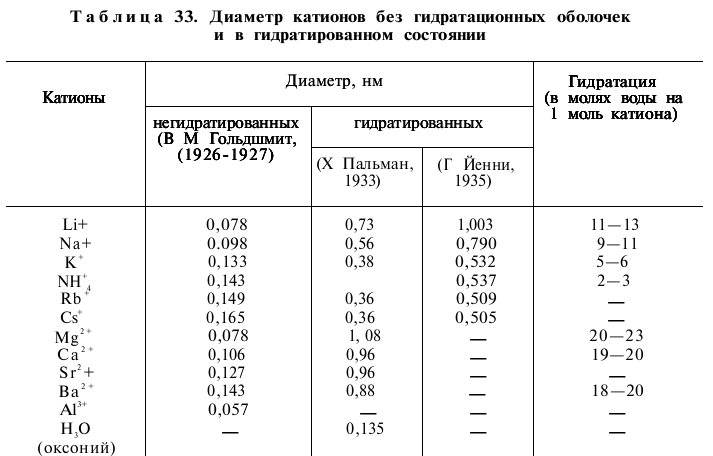
3) энергия поглощения определяется радиусом негидратироанного иона: чем меньше радиус, тем слабее связывается ион. Это объясняется большей плотностью заряда, а следовательно, и большей гидратированностью иона (табл. 33). Гидратационные оболочки изменяют свойства ионов: уменьшают их чувствительность к электростатическому притяжению, изменяют соотношение между размерами ионов;
4) внутри рядов ионов одной валентности энергия поглощения возрастает с увеличением атомной массы, атомного номера. В соответствии с указанными общими закономерностями имеются следующие ряды поглощения ионов: одновалентные: 7Li<23Na<18(NH4)<39K<89Pb; двухвалентные: 27Mg<40Ca< <59Co<12Cd; трехвалентные: 27Аl < 56Fe.
Ион Н+ или Н3О+ (оксоний) сорбируется аномально прочно, что обусловлено его малым размером и способностью давать со многими анионами слабо диссоциированные соединения. Постоянного положения в ряду поглощения Н не имеет, так как его поглощение во многом зависит от состава твердой фазы (сорбента).
Процесс обмена иона электролита с ионом сорбента проходит через пять последовательных стадий: 1) перемещение вытесняющего иона из раствора к поверхности твердой фазы 2) перемещение вытесняющего иона внутри твердой фазы к точке обмена; 3) химическая реакция двойного обмена; 4) перемещение вытесняемого иона внутри твердой фазы от точки обмена к поверхности; 5) перемещение вытесняемого иона от поверхности в раствор.
Скорость катионного обмена в почвах определяется главным образом внутридиффузионными процессами. Катионы, обладающие большей энергией поглощения, прочнее удерживаются в поглощенном состоянии и труднее замещаются. 75—85% поглощенных катионов десорбируется за первые 3—5 мин, затем обмен резко замедляется и продолжается до двух-трех суток.
Это связано с неоднородностью состава почвенного поглощающего комплекса, с наличием энергетически неравноценных центров, со строением поверхности коллоидных частиц, изменением состава почвенного поглощающего комплекса в процессе поглощения катионов, его агрегатного состояния.
почва представляет собой сорбент с 5 группами активных мест:
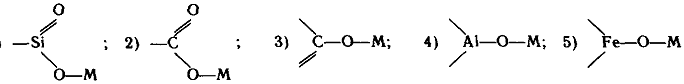
Так как 3, 4 и 5-я группы проявляют активность при рН>7, большинство почв в широком интервале концентраций десорбируемых ионов ведут себя как адсорбенты с двумя группами активных мест. Излом прямой линии изотермы ионообменной сорбции (рис. 37) обусловлен тем, что одна группа катионов связана с органической частью поглощающего комплекса, в которой при рН 6,5—7,5 отсутствуют разнородные активные центры, другая - с минеральной частью. Минеральная часть почвы может иметь несколько энергетически неравноценных центров. 70—80% обменных катионов глинистых минералов связаны с поверхностью базальных граней кристаллов и легче обмениваются, чем катионы, удерживаемые активными центрами сколов кристаллов.
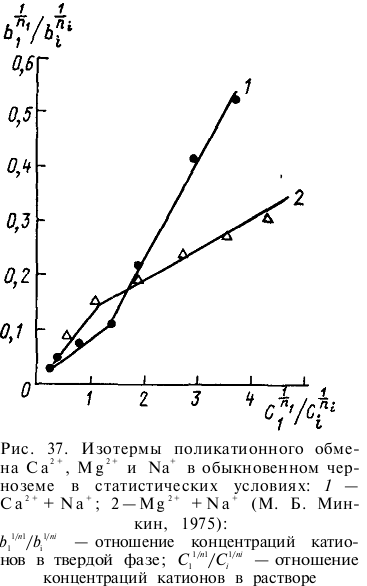
Для характеристики количественных закономерностей ионообменной сорбции предложено значительное число эмпирических и теоретически выведенных уравнений, отражающих функциональную зависимость поглощения катионов от их равновесной концентрации в растворе. Большинство из этих уравнений может быть приведено к виду уравнения закона действующих масс. В одних случаях было установлено строгое подчинение ионообменных реакций этому закону, в других — коэффициенты ионного обмена являлись величинами переменными. Наилучшее совпадение с экспериментальными данными обнаружено при использовании логарифмической изотермы сорбции.
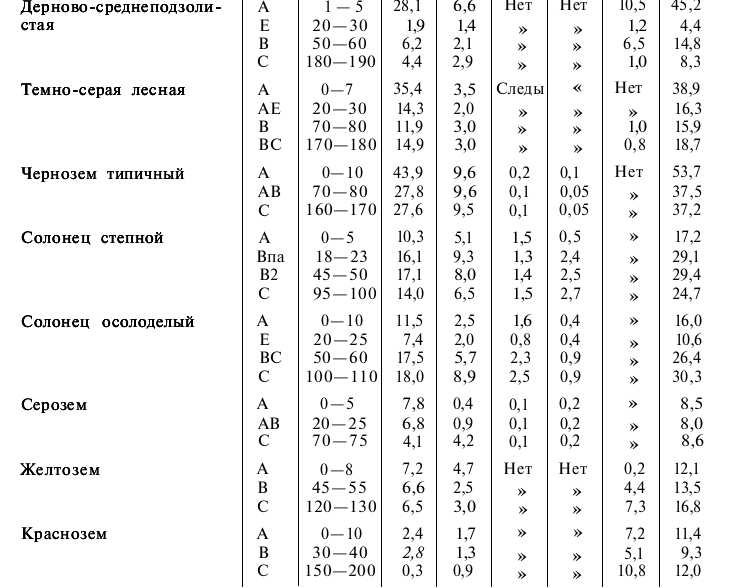
Общее количество всех поглощенных (обменных) катионов, которые могут быть вытеснены из почвы, называется емкостью поглощения или емкостью катионного обмена (ЕКО) (понятие введено К. К. Гедройцем) и выражается в миллиграмм-эквивалентах на 100 г почвы. ЕКО зависит от содержания в почве коллоидной и предколлоидной фракций, строения их поверхностей, природы почвенного поглощающего комплекса, реакции среды (табл. 34 и 35). При увеличении степени дисперсности входящих в состав поглощающего комплекса коллоидных и предколлоидных частиц емкость поглощения катионов возрастает.
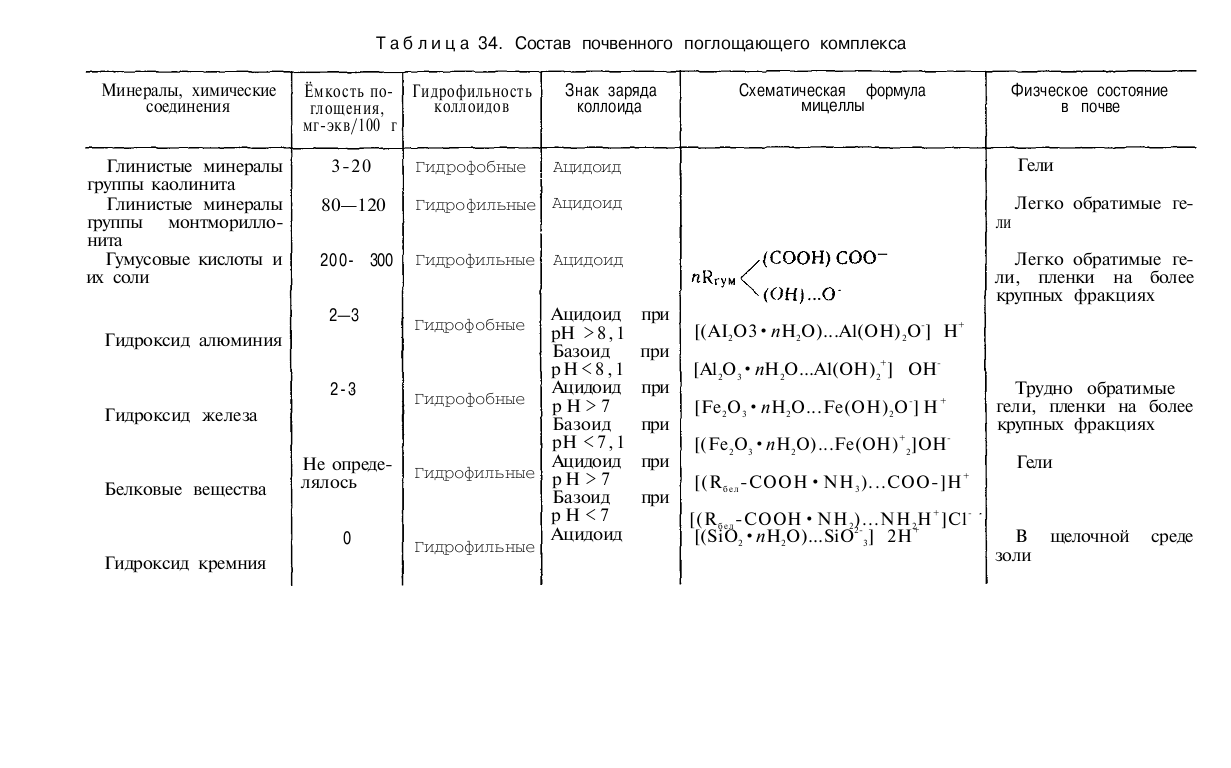

Органическая часть почвенного поглощающего комплекса обладает значительно большей емкостью поглощения, чем минеральная. Высокая емкость поглощения минералов монтмориллонитовой группы обусловлена расширением при увлажнении межплоскостных пространств и обменом расположенных в межплоскостных пространствах катионов на катионы взаимодействующих растворов (табл.34). С ростом рН возрастает ионизация функциональных групп гумусовых кислот, глинистых минералов, уменьшается положительный заряд полуторных оксидов и возрастает ЕКО (рис. 38).
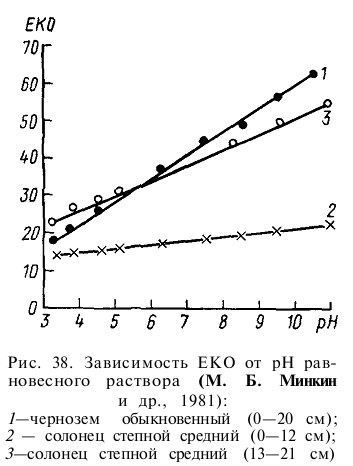
Соответственно определение ЕКО почв должно проводиться при определенном стандартном рН.
Сорбция анионов почвами
Сорбция анионов зависит от заряда, строения и химических свойств почвенного поглощающего комплекса. По способности сорбироваться на почвенных частицах анионы располагаются в следующий ряд: Сl-~NO3- <SO42-<< РO4-3< SiO4-4< ОН-. По мере увеличения в почвенном поглощающем комплексе содержания алюминия и железа и наличия сколов почвенных минералов, а также при понижении рН среды сорбция анионов возрастает. Так как анионы менее гидратированы, чем катионы, они характеризуются высокой селективностью поглощения. Анионы Сl- и NO3- практически не поглощаются почвой. Известна отрицательная сорбция Сl- и NO3-, которая впервые была описана К. К. Гедройцем как отрицательное поглощение веществ. Отрицательная сорбция этих анионов обусловлена снижением их концентрации во внутренней части сорбционной пленки, за счет чего концентрация анионов в более рыхло связанных, а следовательно, и в более подвижных слоях водной пленки возрастает. Отрицательная адсорбция нитратов усиливает процессы вымывания их из почвы, что приводит к обеднению почв соединениями азота. Отрицательная адсорбция хлоридов благоприятствует быстрой промывке почв при хлоридном засолении.
В поглощении анионов большую роль играют процессы солеобразования. При взаимодействии растворимых солей образуются новые, нерастворимые в воде соли (сульфаты, карбонаты, фосфаты), переходящие в твердую фазу почвы. Таким –путем интенсивно поглощаются почвой ионы H2PO4-, HPO42-
PO43-.
.
Однако механизм поглощения фосфат-ионов почвами сложен и разнообразен Можно выделить следующие виды поглощения почвой фосфат-ионов: 1) образование малорастворимых фосфатов в результате взаимодействия внесенных в почву растворимых фосфатов с солями почвенного раствора (химическое поглощение). Такой вид поглощения возможен во многих почвах при наличии ионов кальция, алюминия, железа при нейтральной или щелочной реакции среды; 2) образование слаборастворимых фосфатов с катионами поглощающего комплекса после вытеснения их катионами раствора; 3) поглощение фосфат-ионов при взаимодействии их с минералами-солями; гипсом, кальцитом, доломитом. Часть фосфат иона связывается с кальцием, перешедшим в раствор Возможно поглощение фосфат-иона на поверхности минералов без вытеснения кальция, частичное окклюдирование фосфата в минерале; 4) хемосорбция фосфат-ионов гидроксидами алюминия и железа. Связь осуществляется с твердой фазой на внешней поверхности коллоида. Одна из схем реакции:
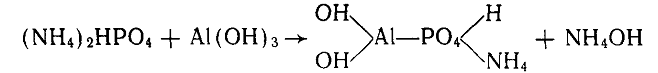
При этом поглощение фосфат-ионов сильно зависит от дисперсности. Свежеосажденные оксиды поглощают фосфаты в большом количестве (Р2О5 составляет 10—15% от массы поглотителя).
При кристаллизации полуторных оксидов (уменьшении внешней поверхности) поглощение фосфатов уменьшается в 10 раз, 5) поглощение фосфат-ионов глинистыми и неглинистыми алюмо- и ферросиликатными минералами. На внешней, иногда на внутренней поверхности минералов происходит необменное поглощение фосфат-иона. При этом фосфат-ион адсорбируется в потенциалопределяющем слое отрицательных коллоидов, притягиваясь к Аl кристаллической решетки; 6) возможна обменная сорбция анионов на положительно заряженных участках коллоидной мицеллы:
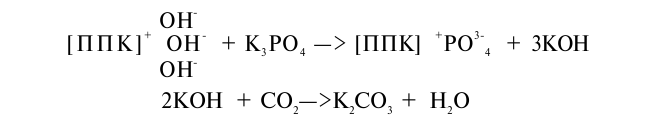
7) аморфный кремнезем поглощает фосфаты путем механического захвата – окклюдирования. Органические вещества, насыщенные основаниями, также
поглощают фосфаты, но значительно меньше, чем полуторные оксиды и глинистые минералы (табл 36). Поглощение фосфатов приводит к накоплению фосфора в почве, но снижает степень доступности его растениям. Уменьшение поглощения фосфатов может происходить за счет образования комплексных алюмо- и железогумусовых соединений.

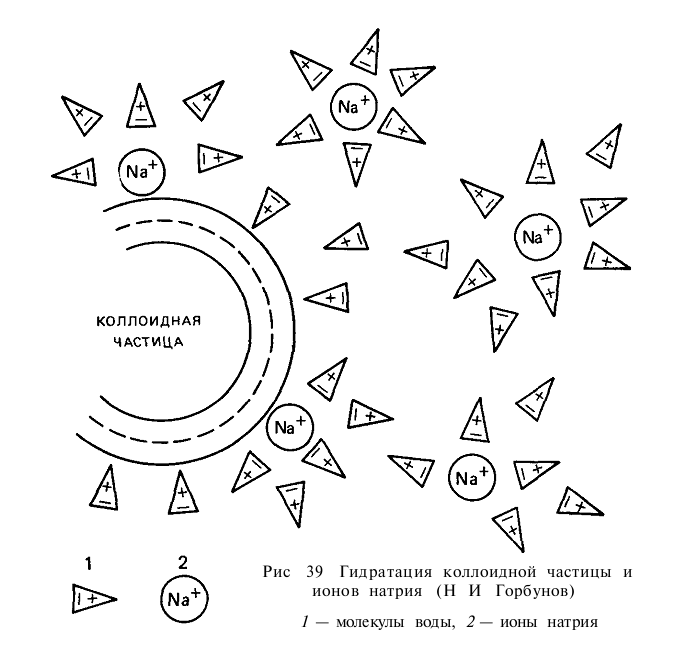
Физическое состояние почвенных коллоидов. Коллоиды в почве находятся главным образом в форме гелей, в которых частицы сцепляются между собой и образуют пространственную структурную сетку, в ячейках которой удерживается вода. Во влажной почве небольшое количество коллоидов может находиться в состоянии золя (частицы разделены водной фазой). Раздельное существование коллоидных частиц в состоянии золя связано с наличием электрокинетического потенциала и водной (гидратационной) оболочки на поверхности частиц. Одноименно заряженные частицы отталкиваются друг от друга, могут долго находиться в суспензии, не образуя осадка.
При падении электрокинетического потенциала и уменьшении заряда частиц разноименно заряженные коллоиды, сталкиваясь друг с другом при хаотическом движении, склеиваются, увеличиваются в размерах и выпадают в осадок. Процесс соединения коллоидных частиц и образования геля из золя называется коагуляцией, дальнейшее осаждение — седиментацией. Переход коллоида из состояния геля в состояние золя называется пептизацией. Коллоиды, которые могут легко переходить из золя в гель и обратно, называются обратимыми. В почве много коллоидов, трудно переходящих в состояние золя и составляющих группу необратимых коллоидов. Взаимодействию и соединению коллоидных частиц мешают водные пленки, которые удерживаются на их поверхности. По количеству воды, удерживаемой коллоидами, они разделяются на гидрофильные и гидрофобные. Гидрофильные коллоиды сильно гидратированы, труднее коагулируют. К ним относятся некоторые органические вещества, встречающиеся в почвах, минералы монтмориллонитовой группы. Гидрофобные коллоиды содержат небольшое количество воды. Это - гидроксид железа, минералы каолинитовой группы. Деление коллоидов на гидрофильные и гидрофобные несколько условно, поскольку при измельчении твердых коллоидных частиц степень гидратации их возрастает.
Физическое состояние коллоидов в значительной степени зависит от состава поглощенных катионов. Чем больше валентность поглощенных ионов, больше их заряд, тем меньше будет диссоциация их от коллоидной частицы, меньше электрокинетический потенциал частицы, тем легче идет процесс коагуляции.
К К. Гедройц расположил все катионы но их коагулирующей способности в ряд, который он назвал лиотропным:

Коллоиды, насыщенные одновалентными катионами, находятся в основном в состоянии золя; при замене одновалентных катионов двух- и трехвалентными они переходят в гель. Так, насыщение почвенного поглощающего комплекса натрием способствует образованию золя, распылению почвы, увеличению заряда почвенных коллоидов и их гидратации (рис. 39). Замещение натрия кальцием способствует коагуляции и образованию водопрочной структуры.
Реакция почвы также влияет на состояние коллоидов. Кислая реакция способствует растворению некоторых коллоидов, например гидроксида алюминия; щелочная реакция стимулирует выпадение в осадок коллоидов полуторных оксидов и переход в состояние золя органических и некоторых минеральных коллоидов.
Часть коллоидов в почве находится в свободном состоянии, часть образует пленки на поверхности более крупных гранулометрических фракций путем адгезии, под которой понимается слипание (склеивание) поверхностей каких-либо веществ различного химического состава, соприкасающихся друг с другом.
Таким путем в почве при периодическом высушивании, приводящем к дегидратации коллоидов, происходит закрепление гумусовых кислот и их солей на поверхности коллоидных частиц, а минеральных, органических и органоминеральных коллоидов - на поверхности частиц пылеватых и песчаных гранулометрических фракций.
Особым явлением представляется процесс тиксотропии коллоидов. Она имеет две особенности: 1) образующийся из золя гель не отделяется от дисперсной среды, а застудневает вместе с ней; 2) полученный гель обратим и может быть переведен в золь путем механического воздействия (встряхивания, помешивания), по прекращению которого золь снова с течением времени переходит в гель.
В почвах результатом тиксотропии является возникновение особого рода коагуляционно-тиксотропной микроструктуры, которая характеризуется образованием рыхлого каркаса из коллоидных частичек в основном удлиненной формы, внутри которого находится почвенный раствор. Тиксотропия особенно развита в криогенных почвах, вызывая их плывунность. Тиксотропные почвы плохо проницаемы для воды и воздуха, в них часто развиваются восстановительные процессы.
В почве под влиянием различных факторов — периодическое высушивание, нагревание, увлажнение, промораживание, изменение реакции среды и др. - происходит изменение вновь образующихся при выветривании и почвообразовании органических и минеральных коллоидов. Одним из таких изменений является процесс старения коллоидов, под которым понимается самопроизвольное уменьшение их свободной поверхностной энергии.
Старение обычно не сопровождается изменением химического и минералогического состава коллоидов, но при этом резко изменяются их свойства: они становятся более гидрофобными, уменьшается их сорбционная способность, связь с дисперсионной средой, может произойти частичная кристаллизация гелей. Для некоторых коллоидов причиной старения является окисление кислородом воздуха, например переход оксида Fe (II) в оксид Fе (III). Свет, особенно ультрафиолетовое излучение, ускоряет старение коллоидов.
Дата: 2019-05-28, просмотров: 810.