Составной триод имеет очень высокий коэффициент усиления по току.
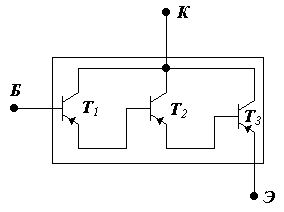
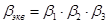
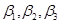 - коэффициенты усиления по току триодов Т1, Т2, Т3.
- коэффициенты усиления по току триодов Т1, Т2, Т3.
Схема компенсационного стабилизатора с составным триодом имеет вид:
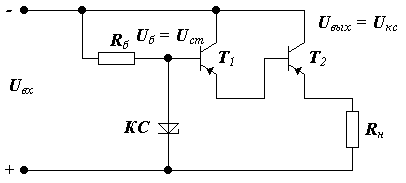
Такая схема позволяет получить ток в нагрузке амперы и десятки ампер.
Недостатком рассмотренных схем является малый коэффициент стабилизации, т.к. отсутствует усилитель сигнала рассогласования. Для устранения этого недостатка применяется:
Компенсационный стабилизатор с усилителем сигнала рассогласования.
Схема такого компенсационного стабилизатора, имеющая для усиления транзистор, имеет вид:
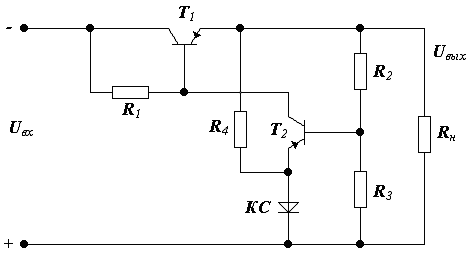
Регулирующим элементом является эмиттер коллектор Т1.
Задающим элементом является параметрический стабилизатор, выполненный на кремниевом стабилитроне (КС) и сопротивление R 4.
Эталонное напряжение подаётся на эмиттер Т2, на базу Т2 подаётся выходное напряжение через делитель напряжения R 2 и R 3 следовательно, схемой сравнения является база эмиттер Т2.
Усилитель сигнала рассогласования выполнен на Т2 и R 1.
Рассмотрим пример: предположим, что U вх увеличивается, тогда U вых тоже начинает увеличиваться, это приводит к увеличению напряжения на базе триода Т2, а на эмиттере Т2 потенциал постоянен, разница потенциалов возрастает и Т2 начнёт открываться, следовательно сопротивление эмиттер коллектор уменьшается. Напряжение на коллекторе Т2 и базе Т1 уменьшается. Поэтому Т1 закрывается и напряжение на выходе стремится к первоначальному значению.
Химические источники.
Химические источники преобразуют химическую энергию в электрическую, при этом происходит расход активных веществ из которых состоит источник (разряд).
Химические источники подразделяются на: первичные – гальванические, вторичные – аккумуляторы.
Гальванические элементы являются приборами однократного действия, т.е. в конце разряда, когда активные вещества будут израсходованы, они подлежат замене.
Аккумуляторы при заряде, подключаются к внешнему источнику постоянного тока. При этом электрическая энергия переходит в химическую энергию и снова образуются активные вещества. Аккумулятор является источником многократного действия (в средним 1000 циклов заряд-разряд).
Аккумуляторы.
В зависимости от типа применяемых активных веществ аккумуляторы бывают двух типов: кислотные (кислотно-свинцовые) и щелочные.
Кислотные аккумуляторы.
В качестве электролита используется серная кислота.
Принцип действия.
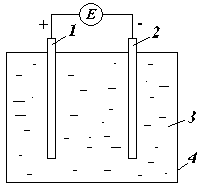
1 – положительная пластина PbO 2.
2 – отрицательная пластина Pb.
3 – электролит (раствор серной кислоты).
4 – сосуд из кислотоупорного материала.
Рассмотрим процессы, которые происходят в аккумуляторах при разряде:
Молекулы серной кислоты распадаются, диссоциируют на положительные ионы водорода и отрицательные ионы кислотного остатка, при этом положительные ионы перемещаются к положительной пластине, а отрицательные ионы к отрицательной пластине.
Ионы отдают свой заряд пластине, нейтрализуются и вступают в реакцию с материалом пластины. При этом на положительной пластине происходит реакция:
PbO2 + 2H + H2SO4 = PbSO4 + 2H2O
На отрицательной пластине более простая реакция:
Pb + SO 4 = PbSO 4
Из реакции следует:
1. Активная масса как положительной, так и отрицательной пластины превращается в сульфат свинца;
2. В процессе разряда расходуется серная кислота и образуется вода, следовательно плотность электролита будет уменьшаться, это имеет большое практическое значение, т.е. измеряя плотность электролита определяют степень разряда кислотного аккумулятора.
При заряде к электродам подключается внешний источник, между пластинами создаётся электрическое поле. Движение ионов, под действием поля идет в обратном направлении и химические реакции идут в обратном направлении. При этом активная масса пластин восстанавливается до первоначального химического состава, а плотность электролита возрастает до первоначального состояния.
Дата: 2019-04-23, просмотров: 430.