План описания:
1. Положение в ПСХЭ
2. Состав атома
3. Строение атома
4. Свойства
5. Вывод
Описание Na .
1. 3 период (малый), I группа, главная подгруппа, подгруппа Щелочных металлов. Порядковый номер 11. Аr = 23.
2. 1123Na (11p+; 12n0) 11e-
3. 1123Na 1s2 2s2 2p6 3s1
s2
| 1 | ↑↓ |
s2 p6
| 2 | ↑↓ | ↑↓ | ↑↓ | ↑↓ |
s1 p0 d0
| 3 | ↑ |
*
* n 3 l 0 ml 0 ms +1/2
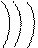 |
11Na0
2 8 1
это s-элемент, на внешнем энергетическом уровне 1 электрон.
4.  Na0 – 1e- Na+ катион натрия, восстановитель, окисляется
Na0 – 1e- Na+ катион натрия, восстановитель, окисляется
5. Na – типичный металлический элемент, щелочной металл, проявляет восстановительные свойства.
Описание As .
1. Положение в ПСХЭ 4 период (большой), V группа, главная подгруппа, подгруппа азота. Порядковый номер 33. Аr = 75.
2. Состав атома 3375As (33p+; 42n0) 33e-
3. Строение атома 3375As 1s2 2s2 2p6 3s13p64s23d104p3
s2
| 1 | ↑↓ |
s2 p6
| 2 | ↑↓ | ↑↓ | ↑↓ | ↑↓ |
s2 p6 d10
| 3 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ |
s2 p3 d0 f0
| 4 | ↑↓ | ↑ | ↑ | ↑ |
 *
*
* n 4 l 1 ml +1 ms +1/2
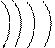 |
33aAs0
2 8 18 5
это p-элемент, на внешнем энергетическом уровне 5 электронов.
4. Свойства As0 + 3e- à As-3 анион мышьяка, окислитель, восстанавливается
As0 – 3e- à As+3 катион мышьяка, восстановитель, окисляется
As0 – 5e- à As+5 катион мышьяка, восстановитель, окисляется
5. Вывод As – неметаллический элемент, проявляет и окислительные, и восстановительные свойства.
Описание Ga .
- Положение в ПСХЭ 4 период (большой), III группа, главная подгруппа, подгруппа бора. Порядковый номер 31. Аr = 70.
- Состав атома 3170Ga0 (31p+; 39n0) 31e-
- Строение атома 3170Ga0 1s2 2s2 2p6 3s13p64s23d104p1
s2
| 1 | ↑↓ |
s2 p6
| 2 | ↑↓ | ↑↓ | ↑↓ | ↑↓ |
s2 p6 d10
| 3 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ |
s2 p1 d0 f0
| 4 | ↑↓ | ↑ |
 *
*
* n 4 l 1 ml -1 ms +1/2
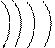 |
31Ga0
2 8 18 3
это p-элемент, на внешнем энергетическом уровне 3 электрона.
- Свойства Ga0 – 3e- à Ga+3 катион галлия, восстановитель, окисляется
- Вывод Ga – амфотерный металлический элемент, проявляет восстановительные свойства.
Вопросы: (для контроля знаний)
- Как формулировал периодический закон Д. И Менделеев и его современная формулировка? В чем отличие?
- Охарактеризуйте атом.
- Что образуется при изменении частиц атома? Дайте определение образующимся идам атома.
- Что такое орбиталь? Какие виды орбиталей выделяют? В чём между ними разница?
- Что такое энергетические уровни и подуровни?
- Какая электронная формула, какое имеется строение по энергетическим ячейкам, сколько электронов на внешнем энергетическом уровне у элемента:
а) 51Sb0;
б) 61Pm0;
в) 74W0.
Список используемых источников:
1. «Репетитор по химии» под редакцией А. С. Егорова; «Феникс», Ростов-на-Дону, 2006г.
2. http://www.1variant.ru/2011-10-27-22-57-07/51-2012-04-08-12-21-19/318-2012-08-10-21-59-47.html
3. http://onx.distant.ru/posobie-1/chemistry/part_4.htm
4. http://www.hemi.nsu.ru/ucheb145.htm
5. http://interneturok.ru/chemistry/11-klass/bstroenie-atoma-periodicheskij-zakonb/stroenie-atoma
6. http://www.hemi.nsu.ru/ucheb125.htm
7. http://www.hemi.nsu.ru/ucheb126.htm
Дата: 2019-04-23, просмотров: 362.