Электрон поступает на ту орбиталь, энергия которой минимальна. Согласно правилу В. М. Клечковского, порядок заполнения энергетических состояний определяется стремлением атома к минимальному значению суммы главного и побочного (орбитального) квантовых чисел, причем в пределах фиксированного значения (п + l) в первую очередь заполняются состояния, отвечающие минимальным значениям п.
Электроны заполняют энергетические подуровни и орбитали в порядке увеличения их энергии. Этот порядок определяется значением суммы главного и побочного квантовых чисел (n+l): 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d.
Например, для атома кальция при распределении электронов по орбиталям предпочтительнее 4s-орбиталь (п + l = 4 + 0 = 4), чем 3d-орбиталь (n + l = 3 + 2 = 5). А для атома скандия предпочтение следует отдать 3d-орбитали (п + l = 3 + 2 = 5), а не 4р-орбитали (п + l = 4 + 1 = 5), так как при одинаковых суммах квантовых чисел (п + l) Зd-орбиталь имеет меньшее значение п = 3.
Принцип Паули.
В атоме не может быть двух электронов с одинаковыми значениями всех четырех квантовых чисел.
Поэтому на каждой орбитали может находиться не более двух электронов (у которых главное, орбитальное и магнитное квантовые числа одинаковы), но обязательно с противоположными спинами. Используя этот принцип, можно подсчитать максимальное число электронных состояний N, соответствующих различным значениям главного квантового числа п: N = 2п2.
3. Правило Гунда (или Хунда).
Электроны располагаются на одинаковых орбиталях таким образом, чтобы суммарное спиновое число их было максимальным.
Таким образом, наиболее устойчивому состоянию атома соответствует максимально возможное число неспаренных электронов с одинаковыми спинами. Например, на р-подуровне 3 электрона будут занимать орбитали так
| ↑ | ↑ | ↑ | , но не так | ↑↓ | ↑ | и не так | ↑ | ↓ | ↑ |
(+1/2)+(-1/2)+(+1/2)= (+1/2)+(-1/2)+(+1/2)= (+1/2)+(-1/2)+(+1/2)=
=(+3/2) =(+1/2) = (+1/2)
В этой записи каждая электронная орбиталь обозначена клеткой (квантовой ячейкой), а электрон — стрелкой, направление которой соответствует направлению спина.
Например, электронные формулы магния, железа и теллура имеют вид:
Mg(+12) 1s22s22p63s2;
Fe(+26) 1s22s22p63s23p64s23d6;
Te(+52) 1s22s22p63s23p64s23d104p65s24d105p4.
Исключения в четвертом периоде составляют атомы хрома и меди, в которых происходит проскок (переход) одного электрона с 4s-подуровня на 3d-подуровень, что объясняется большой устойчивостью образующихся при этом электронных конфигураций 3d5 и 3d10. Таким образом, электронные формулы атомов хрома и меди имеют вид:
Cr(+24) 1s22s22p63s23p64s13d5, а не Cr(+24) 1s22s22p63s23p64s23d4;
Cu(+29) 1s22s22p63s23p64s13d10, а не Cu(+29) 1s22s22p63s23p64s23d9.
Структура ПСХЭ Д. И. Менделеева
 3Li 1s2 2s1
3Li 1s2 2s1
4Be 1s2 2s2
5B 1s2 2s2 2p1
6C 1s2 2s2 2p2
7N 1s2 2s2 2p3
Периоды ПСХЭ – это отдельные горизонтальные ряды, объединяющие элементы, у которых одинаковое число внутренних энергетических уровней, но разное число электронов на внешнем энергетическом уровне.
1H 1s1
3Li 1s2 2s1
11Na 1s2 2s2 2p6 3s1
19K 1s2 2s2 2p6 3s2 3p6 4s1
37Rb 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1
Группы ПСХЭ – это отдельные вертикальные столбцы, объединяющие элементы, у которых разное число внутренних энергетических уровней, но одинаковое число электронов на внешнем энергетическом уровне.
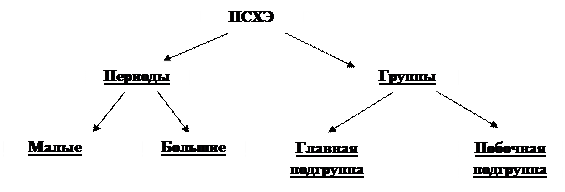
Внешний энергетический уровень образуется только s - или s- и p - подуровнями.
Номер периода соответствует номеру энергетического уровня (по s - и p - подуровням).
Число электронов на внешнем энергетическом уровне для элементов s - и p - подуровней соответствует номеру группы.
Количество электронов на внешнем уровне элементов у d - и f - подуровней равно от 0 до 2 электронов (смотри ПСХЭ).
Структура ПСХЭД.И. Менделеева (Изменение свойств в периодах и группах).
Свойства элементов в периодах и группах изменяются периодически:
Радиус
 |
Электроотрицательность
 |
Металличность
 |
Неметалличность
 |
Энергия ионизации
 |
Сродство к электрону
 |
Обозначение:
 - увеличение
- увеличение
Электроотрицательность – свойство атомов данного химического элемента в соединениях притягивать к себе электроны, участвующие в образовании химической связи (валентные электроны), или свойство атомов данного химического элемента оттягивать на себя электроны от атомов других элементов в соединениях.
Металличность – это способность атома химического элемента отдавать электроны со своего энергетического уровня.
Неметалличность – это способность атома химического элемента отбирать электроны с энергетического уровня другого химического элемента.
Энергия ионизации – это энергия, затрачиваемая для отрыва электрона от атома и превращения последнего в соответствующий ион.
Сродство к электрону – это количество энергии выделяющееся при присоединении электрона к атому, молекуле или радикалу.
Характеристики химических элементов и их соединений закономерно изменяются в группах и периодах.
В периодах (с увеличением порядкового номера, т.е. слева и направо):
· увеличивается заряд ядра,
· увеличивается число внешних электронов,
· уменьшается радиус атомов,
· увеличивается прочность связи электронов с ядром (энергия ионизации),
· увеличивается электроотрицательность,
· усиливаются окислительные свойства простых веществ ("неметалличность"),
· ослабевают восстановительные свойства простых веществ ("металличность"),
· ослабевает основный характер гидроксидов и соответствующих оксидов,
· возрастает кислотный характер гидроксидов и соответствующих оксидов,
· валентность в соединении с кислородом возрастает от 1 до 7, высшая валентность равна номеру группы.
В группах (с увеличением порядкового номера, т.е. сверху вниз):
· увеличивается заряд ядра,
· увеличивается радиус атомов (только в главных подгруппах),
· уменьшается прочность связи электронов с ядром (энергия ионизации; только в главных подгруппах),
· уменьшается электроотрицательность (только в главных подгруппах),
· ослабевают окислительные свойства простых веществ ("неметалличность"; только в главных подгруппах),
· усиливаются восстановительные свойства простых веществ ("металличность"; только в главных подгруппах),
· возрастает основный характер гидроксидов и соответствующих оксидов (только в главных подгруппах),
· ослабевает кислотный характер гидроксидов и соответствующих оксидов (только в главных подгруппах),
· снижается устойчивость водородных соединений (повышается их восстановительная активность; только в главных подгруппах),
· валентность элементов не изменяется и равна номеру группы.
Самый активный металл Fr – легче всего отдает свои электроны с внешнего энергетического уровня. (Самый большой радиус атома в периоде и группе –у него только один электрон на внешнем энергетическом уровне, поэтому электрон притягивает к ядру очень слабо).
Самый активный неметалл F – легче всего притягивает электроны от атомов других элементов (очень маленький радиус атома в периоде и группе, и у него 7 электронов на внешнем энергетическом уровне, т.е. до 8 не хватает только 1 электрона, поэтому электроны притягиваются к ядру очень сильно и расстояние от ядра до внешнего энергетического уровня другого химического элемента очень небольшое).
В соединениях атомы химических элементов стремятся иметь наибольшее энергетически выгодное состояние: на внешнем энергетическом уровне должно быть или 8 электронов (полное заполнение электронами s- и p-подуровней) или 0 электронов (полное отсутствие электронов на s- и p-подуровне). Исключение составляет только первый период – там только один подуровень, а значит и максимальное число электронов – 2 электрона.
Все химические элементы в ПСХЭ можно разделить на две группы: металлы и неметаллы (по химическим и физическим свойствам), но среди металлов есть химические элементы, которые в соединениях с другими химическими элементами могут проявлять и некоторые свойства неметаллов.
Элементы
 |  |  | |||
Металлы Амфотерные элементы Неметаллы
(порядковый номер (порядковый номер (порядковый номер
- не обозначен) - обозначен полукругом) - обозначен квадратом)
Местоположение химического элемента в ПСХЭ обуславливает свойства этих элементов, и, наоборот, свойства элементов обуславливают их местоположение в ПСХЭ.
Металлы свои электроны внешнего энергетического уровня в соединениях всегда отдают. Неметаллы свои электроны внешнего уровня могут и отдавать, и принимать электроны у атомов других химических элементов (с их внешнего энергетического уровня).
d-элементы и f-элементы: все металлы;
s-элементы: кроме H и He, металлы;
p-элементы – по «правилу треугольника»: если провести в таблице Периодической системы диагональот B до At, то – «правый верхний треугольник и сама диагональная линия» это неметаллы, а «левый нижний треугольник» – это металлы.
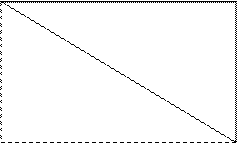 |
B C N O F Ne
Cl Ar
Br Kr
I Xe
At Rn
Дата: 2019-04-23, просмотров: 866.