Фотокалорометрический метод
Основан на колориметрировании избытка раствора феррицианида после реакции с редуцирующими веществами.
Массу навески рассчитывают по формуле:
m= 0,002×  ×1000,
×1000,
где 0,002- оптимальная для данного метода концентрация редуцирующих веществ в одной вытяжке,г/см3;
V- вместимость мерной колбы, используемой для приготовления водной вытяжки,см3;
П - предпологаемая массовая доля редуцирующих веществ в исследуемом объекте,%.
Навеску измельчённого объекта исследования берут в стаканчике и сразу растворяют в тёплой дистиллированной воде. Если объект исследования растворяется без остатка, то раствор из стаканчика количественно переносят в мерную колбу (200…250 см3). Объём раствора доводят при 20◦С дистиллированной водой до метки и хорошо перемешивают.
Предварительно экспериментально находят их эквивалентное соотношение. Для этого пипеткой отмеривают 10 см3 раствора сульфата цинка, вводят 40…50 см3дистиллированной воды, 3 капли спиртового раствора с массовой долей фенолфталеина 1% и титруют приготовленным раствором гидроксида калия или натрия. При титровании раствор взбалтывают так, чтобы хлопья выпадающего осадка равномерно распределились в жидкости. Титрование прекращают после появления незначительного, не исчезающего в течение 1 минуты розового окрашивания. Отмечают какой объём раствора гидроксида натрия или калия был затрачен на титрование. Необходимый для осветления объём раствора сульфата цинка зависит от массы навески. Если масса навески более 5 г, то вводят 15 см3 сульфата цинка, содержимое мерной колбы перемешивают, и только после этого вводят раствор гидроксида натрия или калия в соответствии с установленным предварительно соотношением.
Осветлив жидкость, доводят её объём в мерной колбе дистиллированной водой до метки, взбалтывают её и через 2…3 минуты отфильтровывают в сухую или сполоснутую раствором колбу.
В коническую колбу вместимостью 250см3 вносят пипеткой25 см3 щелочного раствора феррицианида, 10,0 см3 раствора водной вытяжки объекта исследования и 6,0 см3 дистиллированной воды. Содержимое колбы доводят до кипения, кипятят ровно 1 минуту и сразу охлаждают. После охлаждения заполняют жидкостью кювету и определяют оптическую плотность.
Массовую долю редуцирующих веществ РВ,% вычисляют по формуле:
РВ= 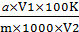 ,
,
Где а- массовая доля глюкозы, мг;
V1- объём мерной колбы, использованной для приготовления водной вытяжки объекта исследования,см3;
V2- объём водной вытяжки объекта исследования, взятый для реакции с феррицианидом,см3;
1000- коэффициент пересчёта мг в г;
m- масса навески объекта исследования,мг;
К- поправочный коэффициент, учитывающий частичное окисление сахарозы.
Определение кислотности
Метод основан на нейтрализации кислоты, содержащейся в навеске, гидроокисью натрия (калия) в присутствии фенолфталеина до появления розовой окраски.
5 г измельчённого исследуемого продукта, взвешенного на технических весах с погрешностью до 0,01 г, помещают в химический стакан или коническую колбу вместимостью 200…250 см3, приливают около 100 см3 дистиллированной воды, нагретой до 69…70◦С, хорошо размешивают, охлаждают, приливают 3…4 капли фенолфталеина и титруют 0,1 моль/дм3 раствором NaOH (KOH) до бледно-розового окрашивания, не исчезающего в течение 1 минуты. Кислотность Х, град вычисляют по формуле:
Х= 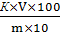 ,
,
Где К- поправочный коэффициент раствора гидроокиси натрия или калия с концентрацией 0,1 моль/дм3, используемого для титрования;
V- объём раствора гидроокиси или калия , израсходованный на титрование ,см3;
m- масса навески продукта, г;
100- коэффициент пересчёта на 100 г продукта;
10- коэффициент пересчёта раствора гидроокиси натрия или калия концентрации 0,1 моль/дм3 в 1 моль/дм3
Дата: 2019-05-28, просмотров: 300.