Информационно-энтропийный подход, разработанный Майковым с сотрудниками, можно рассматривать как разновидность эвристического метода, хотя он имеет определенное теоретическое обоснование. Согласно этому методу оптимальная схема разделения сопоставляется с наиболее эффективным процессом получения информации [16]. Следовательно, оптимальной системе соответствует максимум суммы информационных критериев разделительной способности всех разделительных аппаратов. Применение информационно - энтропийного подхода приводит к тем же результатам, что и при использовании эвристического правила дихотомии. Сравнение получаемых этим методом оптимальных вариантов технологических схем с вариантами, являющимися оптимальными по приведенным затратам, показали значительное его расхождение.
Кроме рассмотренных применяется также рекурсивный метод и метод «случайных матриц». В ряде случаев можно использовать сочетание нескольких методов.
1.3.7.Метод графов.[17,18 ]
В работах [17,18] предложена стратегия синтеза множества схем, состоящих из колонн с разным числом секций, основанная на трансформации графов структур схем из простых двухсекционных колонн.
В данном методе используются ориентированные графы. При этом их вершинами выступают входы и выходы колонн, а ориентированными ребрами – потоковые связи. Тогда, схема ректификации (рис. 1.10 а) приобретает вид ориентированного мультиграфа с кратными разнонаправленными ребрами – образ секции колонны и одинарными ориентированными ребрами – образ потоковых связей между колоннами (рис. 1.10 б). Для упрощения структуры графа каждую кратную пару ребер можно заменить одним неориентированным ребром (рис. 1.12в).
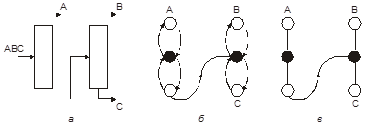
Рис. 1.10. Иконографическое (а) и графовое (б, в) представление технологической схемы ректификации, ориентированные ребра – потоки, неориентированные ребра – секции,  – вершины-выходы,
– вершины-выходы,  – вершины-входы колонн
– вершины-входы колонн
Используя такую операцию перехода от иконографического изображения схемы к графовому, авторы представляют разделение трехкомпонентной смеси (рис. 1.10 а) как граф G1 (рис. 1.11). Он имеет две идентичные по свойствам вершины (ВС), соответствующие кубовому продукту первой (выход) и питанию (вход) второй колонны. Объединением этих двух вершин и удалением из графа ориентированного ребра получается граф G2. Видно, что он является образом сложной колонны с боковой секцией. Вершина (ВС) (граф G2) есть вход жидкой фазы из боковой секции и выход паровой фазы в боковую секцию. Граф G3, соответствующий сложной колонне с боковым отбором, можно получить из G2 объединением вершин (ВС) и (В). Аналогичным образом осуществляется и операция перехода G4 ® G5 ® G6.
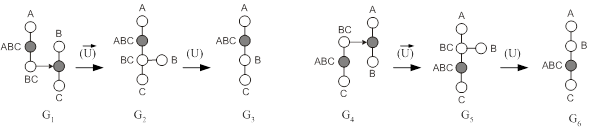
Рис.1.11. Преобразование графов, соответствующих схемам из простых колонн (G1, G4), в графы, соответствующие сложным колоннам с боковыми секциями (G2, G5) и с боковыми отборами (G3, G6)
Технологические схемы, соответствующие исходным графам (G1, G4), называют схемами-прообразами, а все схемы, соответствующие графам, полученным путем их трансформации, – схемами-образами. При этом полученные графы имеют на одно ребро и на одну вершину меньше, чем их прообраз. Эта операция названа авторами [17,18] операцией стягивания (u). При этом, если стягивание проводится по ориентированному ребру ее обозначают ( 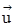 ). В целом рассмотренные преобразования представляют собой отображения одного множества графов на другое (одного множества схем на другое). Если обозначить множество схем из простых колонн П, множество схем из одной сложной колонны с боковыми секциями как Ф, множество схем из одной сложной колонны как I, то
). В целом рассмотренные преобразования представляют собой отображения одного множества графов на другое (одного множества схем на другое). Если обозначить множество схем из простых колонн П, множество схем из одной сложной колонны с боковыми секциями как Ф, множество схем из одной сложной колонны как I, то 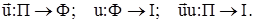
Таким образом, метод трансформации графов структуры схем-прообразов предоставляет строгий алгоритм синтеза всех возможных вариантов схем разделения, включающих сложные колонны.
Еще один способ представления технологической схемы основан на анализе топологии траекторий ректификации [19]. Вне зависимости от числа компонентов в смеси и выделяемых фракций траектория является одномерным многообразием, отдельные части которого разделяются точками стыковки, питания и продуктов (многообразия с нулевой размерностью). Такая структура просто отображается в графовой форме. Вершины соответствуют точкам, а ребра – линиям траектории ректификации. Разработанные в [19,20] методы позволяют синтезировать технологические схемы в различных классах эквивалентности, не только преобразуя графы, но и заменяя их матричным представлением.
Поскольку траектория есть изменение концентраций компонентов по высоте колонны, то ее можно рассматривать как путь процесса, который, как и каждая технологическая схема, обладает определенной термодинамической эффективностью. Коренным отличием предложенных авторами , 36, 37подходов к синтезу схем ректификации от традиционных комбинаторных методов является то, что структуры в различных классах эквивалентности можно рассматривать как образы и прообразы. Следовательно, такой графовый метод синтеза может предсказывать энергетическую эффективность схем.
В частности высказано предположение, что если структура оптимальной технологической схемы, представленная в том или другом виде, сохраняет все или основные свои связи при операциях преобразования, то она порождает оптимальные решения в других классах эквивалентности.
Применение тополого-графового подхода к синтезу и анализу технологий ректификации многокомпонентных смесей позволило разработать ряд технологических решений, обеспечивающих существенное снижение энергозатрат. В частности, предложены схемы разделения:
· широкой фракции легких углеводородов со снижением энергозатрат на 13,0 – 24,7% ;
· олигомеров пропилена со снижением энергозатрат на 7,0% ;
· продуктов алкилирования фенола бутиленами, с получением паратретбутилфенола первого и высшего сорта ;
· синтетических жирных кислот, обеспечивающая снижение энергозатрат на 2,1% .
Таким образом, тополого-графовый подход к синтезу технологических схем ректификации многокомпонентных смесей обеспечивает выбор научно обоснованного энергосберегающего технического решения.
1.4. Некоторые свойства, токсическое действие, получение и применение компонентов.[22]
Толуол (метилбензол) C 6 H 5 CH 3
Физические свойства. Молярная масса 92,14; бесцветная жидкость с ароматическим запахом;ТПЛ=-94,99 ОС,ТКИП=110,62 ОС. Плотность 0,8669 г/см3. Смешивается со спиртами, углеводородами, хорошо растворим в большинстве органических растворителей; растворимость в воде 0,014% по массе (20 ОС); растворимость воды в толуоле 0,4% (20 ОС).
Химические свойства. По химическим свойствам толуол – типичный представитель ароматических углеводородов. Легко образует комплексы с переносом заряда: с переходными металлами (Co, Mo и др.) комплексы «сэндвичевого» типа, с трикарбонилхромом- «зонтичного» типа, а также со многими органическими акцепторами электронов (тринитробензол и др.). В реакции электрофильного замещения (нитрование, галогенирование, сульфирование и др.) вступает легче бензола, образуя моно-, ди- и тризамещенные, главным образом по пара- и орто-положениям. При окислении по метильной группе (в зависимости от условий) основные продукты реакции- бензиловый спирт (окислитель- О2), бензальдегид (Cr2O3) или бензойная кислота (О2,Br2, бензоаты Co и Mn). При галогенировании в боковую цепь под действием УФ облучения превращается в смесь бензилхлорида, a,a-дихлортолуола (бензальхлорид) и (трихлорметил)бензола (бензотрихлорид); процесс сопровождается хлорированием в ядро. Гидрирование толуола на цеолитных и оксидных (Cr2O3, MoO3, CoO) катализаторах при высоких температурах (600-800 ОС, давление 3,5-6МПа) приводит к бензолу(промышленный метод, до 2 млн. т/год в США), гидрирование в присутствии Ni, Pt и др. в жидкой (10-30 МПа, 100-200 ОС) или газовой (0,1 МПа, 110-180 ОС) фазе к метилциклогексану.
Получение. Получают толуол преимущественно из нефти при вторичной её переработке: риформинге низкокипящих продуктов, полученных при прямой перегонке нефти или каталитическом крекинге, пиролизе газойля и рафинатов риформинга, направленном одновременно на получение непредельных и ароматических углеводородов. Очистку нефтяного толуола осуществляют методом экстракции (экстрагенты ди- и триэтиленгликоли, N-метилпирролидон, ДМФА) или экстактивной ректификации.
Каменноугольный толуол, образующийся в процессе коксования, извлекают из коксового газа в виде компонента сырого бензола, подвергают сернокислотной очистке (для удаления непредельных и серосодержащих соединений) и выделяют ректификацией. Чистоту и качество толуола контролируют методами ГЖХ. Значительное количество толуола получают как побочный продукт при синтезе стирола из бензола и этилена.
Применение. Основное количество толуола перерабатывают в бензол, фенол, капролактам, толуилендиизоцианаты; остальное количество используют в качестве растворителя для пластических масс, нитроцеллюлозных, алкидных лаков и эмалей, высокооктанового компонента моторных топлив, исходного вещества для получения многочисленных производных (в т.ч. галоген-, сульфо- и нитропроизводных).
Безопасность, токсичность. Толуол легко воспламеняется, температура вспышки 4 ОС, температура самовоспламенения 536 ОС, концентрационные пределы воспламенения(КПВ) 1,25-6,7% по объему. Поражает человека через органы дыхания и кожу, вызывает нервное возбуждение, рвоту, при больших концентрациях- потерю сознания; ПДК 0,6 мг/м3,ПДК в воде 0,05 мг/л.
Метилэтилкетон (2- бутанон) CH 3 COC 2 H 5
Физические свойства. Молярная масса 72,12; бесцветная легколетучая жидкость с запахом, напоминающим запах ацетона; ТПЛ=-86,3 ОС, ТКИП=79,6 ОС. Плотность 0,8054 г/см3. Растворимость в воде 26,8% по массе при 20 ОС, воды в метилэтилкетоне-12,5%. Смешивается с органическими растворителями.
Химические свойства. Обладает всеми химическими свойствами, характерными для алифатических кетонов. Образует кристаллические соединения с гидросульфитами щелочных металлов, например с NaHSO3 – C2H5(CH3)C(OH)SO3Na. Только сильные окислители, например щелочной раствор KMnO4 и хромовая кислота, окисляют метилэтилкетон до муравьиной, уксусной и пропионовой кислот и далее до CO2 и H2O. Каталитически восстанавливается до изо-бутанола, амальгамами Mg и Zn, а также Zn с CH3COOH до CH3(C2H5)C(OH)C(OH)(C2H5)CH3. Атомы водорода легко замещаются при галогенировании, нитрозировании и т.д. Метилэтилкетон окисляет вторичные спирты до кетонов. Вступает в альдольную конденсацию с образованием диацетонового спирта, а также в кротоновую конденсацию.
Получение. В промышленности метилэтилкетон получают из бутенов, содержащихся в бутан-бутиленовой фракции газов переработки нефти. Первая стадия - гидратация бутенов 70-80%-ной H2SO4 при 30-40 ОС и давлении ~0,1 МПа в 2-бутанол с промежуточным образованием 2-бутилсульфата CH3CH(OSO3H)C2H5. 2-Бутанол выделяют ректификацией и превращают в метилэтилкетон дегидрированием при 400-500 ОС (кат. –ZnO на пемзе, цинк-медный) или окислительным дегидрированием при 500 ОС в присутствии Ag на пемзе. Недостатки процесса: образование большого количества сточных вод на стадии гидратации, высокие энергозатраты, связанные с необходимостью концентрирования H2SO4. Разработаны и внедрены процессы прямой гидратации бутенов с использованием гетерополикислот и сульфокатионитов в качестве катализаторов, не имеющие указанных недостатков. Перспективно получение метилэтилкетона окислением бутенов на гомогенном катализаторе – водном растворе соли Pd и обратимо действующего окислителя (например, фосфорномолибденванадиевой гетерополикислоты).
Применение. Используется как растворитель перхлорвиниловых, нитроцеллюлозных, полиакриловых лакокрасочных материалов и клеев, типографских красок, депарафинизации смазочных масел и обезмасливания парафинов (удаление смеси масла и низкоплавкого парафина); промежуточный продукт в производстве пероксида метилэтилкетона (отвердитель полиэфирных смол), втор-бутиламина, оксима метилэтилкетона (антиоксидант) и др.
Безопасность, токсичность. Температура вспышки -2,2 ОС, КПВ 1,97-10,2%. Раздражает слизистые оболочки глаз, носа, горла; ПДК 200мг/м3.
Этилцеллозольв (2-этоксиэтанол) C 2 H 5 OCH 2 CH 2 OH
Физические свойства. Молярная масса 90,12; бесцветная горючая жидкость со слабым спиртовым запахом; ТПЛ=-70 ОС; ТКИП=135,6 ОС. Плотность 0,9311 г/см3. Смешивается со спиртами и органическими растворителями во всех соотношениях.
Химические свойства. Этилцеллозольв обладает свойствами, характерными для этиленгликоля и простых эфиров. Металлы и их гидроксиды легко замещают водород гидроксильной группы; при взаимодействии с карбоновыми кислотами образуются сложные эфиры, например с уксусной кислотой – целлозольвацетат
С2Н5ОСН2СН2ОН + СН3СООН = С2Н5ОСН2СН2ОСОСН3
При оксиэтилировании – эфиры этиленгликолей.
Получение. В промышленности этилцеллозольв получают взаимодействием этиленоксида с этанолом при 150-200 ОС и давлении 2-4МПа в присутствии гомогенных (кислоты, щелочи) или гетерогенных (цеолиты, алюмосиликаты, силикагели и др.) катализаторов. Возможно также получение взаимодействием этиленхлоргидрина и алкоголята Na.
Применение. Применяется в качестве растворителя лакокрасочных материалов, производстве растворителей для нитратов, ацетатов целлюлозы, фенолформальдегидных, полиэфирных и эпоксидных смол. Используется как присадка к моторным и реактивным топливам. Входит в состав антиобледенительных жидкостей. Применяется в чистящих средствах, при печатании, в производстве кино- и фотопленки.
Безопасность, токсичность. Легковоспламеняющаяся токсичная жидкость. Температура вспышки 48,9 ОС, температура самовоспламенения 237,8 ОС, КПВ 2,6-15,7%. Пары ядовиты; накапливаясь в организме, может вызвать изменения в печени и почках; при хронических отравлениях поражают, главным образом, центральную нервную систему и слизистые оболочки. Всасываются через кожу, вызывают дерматит, при приеме внутрь - смерть. ПДКРЗ – 10мг/м3.
Дата: 2019-05-28, просмотров: 297.