Все активные формы кислорода обладают высокой цитотоксичностью в отношении любых типов клеток и клеточных образований, что определяется их химической активностью. Можно выделить 4 наиболее вероятные мишени окислительной цитотоксической атаки АФК: индукция процессов ПОЛ в биологических мембранах, повреждение мембраносвязанных белков, инактивация ферментов и повреждение ДНК клеток.
Одним из важнейших следствий избыточного образования АФК является избыточная в этих условиях активация процессов ПОЛ [Барабой, 1991]. В нормальных условиях активность этих процессов находится на невысоком уровне, обеспечивающим протекание ряда физиологических процессов. Чрезмерная, патологически усиленная активация процессов ПОЛ под действием АФК приводит к необратимому изменению или повреждению мембранных структур, нарушению их проницаемости для ионов. Процессы ПОЛ можно условно подразделить на 3 последовательных этапа, или фазы развития: процесс зарождения цепей, процессы развития цепных реакций и обрыв цепей [Зенков, Ланкин, Меньщикова, 2004].
В биологических мембранах окислению подвергаются преимущественно полиненасыщенные жирные кислоты, входящие в состав фосфолипидов [Dix, Aikens, 2005]. На стадии инициирования под действием свободных радикалов О2, ионизирующей радиации, ультрафиолетового облучения и ряда химических веществ, относящихся к прооксидантам, происходит отрыв атома водорода в альфа-положении по отношению к двойной связи. Присутствие двойной связи в жирной кислоте (ЖК) ослабляет связь С-Н в смежных углеродных атомах и тем самым облегчает отщепление Н∙. Чем длиннее ненасыщенная боковая цепь кислоты жирного ряда, тем сильнее у неё склонность подвергнуться липидному окислению [Хавинсон, Баринов, Арутюнян, 2003]. Радикал с углеродом в центре претерпевает молекулярную перегруппировку с образование диена, содержащего сопряженные двойные связи, который в дальнейшем соединяется с О2 и образует радикал пероксида, способный отделить атом водорода от другой ЖК. Возникновение в результате этой реакции органических перекисей и нового радикала способствует продолжению окислительных реакций, приобретающих цепной характер [Зенков, Ланкин, Меньщикова, 2004].
Таким образом, перекисное окисление липидов представляет собой процесс, связанный с активацией кислорода, особенность которого заключается в том, что молекула О2 присоединяется к свободному радикалу [Meral, Tuncel, Surmen-Gur, 2000]:
О2 + L∙ → LO2
В результате получается новый пероксильный радикал органического соединения. В дальнейшем происходит взаимодействие этого радикала с новой молекулой органического соединения, в результате чего протекает процесс цепного ПОЛ.
LO2∙ + LH → LOOH + L
L∙ + O2 → LO2∙
Реакции перекисного окисления липидов указаны на рис. 1.
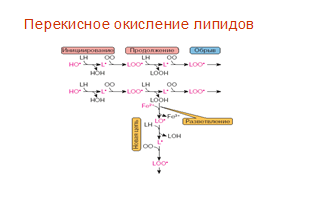
Рис.1. Реакции перекисного окисления липидов [Владимиров, 1998]
Считается, что образование перекисей липидов осуществляется двумя путями: неферментативным – аскорбатзависимым (аскорбиновая кислота регенерирует ионы за счет обратного восстановления Fe3+ до Fe2+), активируемым металлами с переменной валентностью, и ферментативным (НАДФН-зависимым). По первому пути образование перекисей липидов происходит во всех мембранных структурах, а по второму – преимущественно в эндоплазматическом ретикуломе [Gutteridge, 2005].
Ферментативное ПОЛ относится только к генерации липидных перекисей в активном центре фермента. Образованные при этом гидроперекиси и эндоперекиси являются стереоспецифическими и имеют важные биологические функции. В частности, это относится к циклооксигеназе и липооксигеназе.
Особенность неферментативного цепного окисления в биологических мембранах заключается в том, что оно практически не происходит в отсутствие металлов с переменной валентностью, в частности ионов двухвалентного железа [Владимиров, Арчаков, 2003]. Резко выраженное прооксидантное действие Fe2+ на ненасыщенные жирные кислоты (НЖК) в биологических мембранах обусловлено разложением продуктов реакции гидроперекисей, в результате которого в системе появляются новые свободные радикалы, инициирующие новые цепи окисления:
Fe2+ + LOOH → Fe3+ + OH + LO
При этом радикал LO вступает в дальнейшие реакции цепного окисления:
LO + LH → LOH + L
L + O2 → LO2
В последние годы появилось много данных, свидетельствующих, что ионы железа активируют процессы перекисного окисления также за счет того, что они участвуют в образовании гидроксильного радикала [Владимиров, 1998].
В ходе ПОЛ субстрат (полиненасыщенные ЖК) продолжают расходоваться, если только в этот процесс не вмешивается глутатионпероксидаза, восстановленный глутатион, витамин Е или другой антиоксидант [Birringer, EyTina, Salvatore, 2003], что ведет к прерыванию цепной реакции. Благодаря наличию в организме антирадикальной защиты, процессы пероксидации ограничиваются [Зенков, Ланкин, Меньщикова, 2004]. Физиологическая роль перекисного окисления заключается в участии в процессах самообновления, самоперестройки биологических мембран, ионного транспорта, регуляции активности мембраносвязанных ферментов и других физиологических реакций [Galeotti, Masotti, Borello, 2003]. При интенсивном воздействии на организм химических или физических факторов процессы ПОЛ многократно усиливаются, образование АФК возрастает, а когда происходит срыв механизмов антирадикальной защиты, развивается окислительный стресс, который может проявляться на клеточном, тканевом и организменном уровнях. При этом усиление перекисного окисления липидов, чрезмерная продукция органических перекисей приводят к развитию патологических процессов [Суханова, 2004; Барабой с соавт., 2004].
Повышение уровня ПОЛ наблюдается при многих заболеваниях, различных патологических состояниях и интоксикациях. При этом считают, что в случае болезни и интоксикации происходит возрастание ПОЛ, продукты которого и являются ответственными за повреждение клеток и тканей. Однако, как было установлено [Halliwell, Gutteridge, 2004], поврежденные ткани подвержены перекисному окислению липидов в гораздо большей степени, чем здоровые. Причина этого явления – инактивация некоторых биоантиоксидантов, утечка антиоксидантов из поврежденных клеток и выделение ионов металлов (особенно железа и меди) из мест их накопления в клетках и из металлопротеинов, гидролизованных освободившимися из разрушенных липосом ферментами [Воскресенский, Левицкий, 2003].
Состав продуктов перекисного окисления липидов достаточно сложен. К продуктам цепной реакции ПОЛ, прежде всего, относятся разновидности гидроперекисей, которые способны подвергаться нерадикальным окислительным превращениям, что приводит к образованию первичных (диеновые коьюгаты), и конечных продуктов ПОЛ (малоновый диальдегид, основания шиффа) [Журавлева с соавт., 2003].
Избыточное образование продуктов пероксидации приводит к целому комплексу цитотоксических эффектов, включающих инактивацию ряда ферментных систем, угнетение синтеза белка, повреждение и угнетение синтеза ДНК, лизис клеточных структур, нарушение репродуктивных процессов деления клеток.
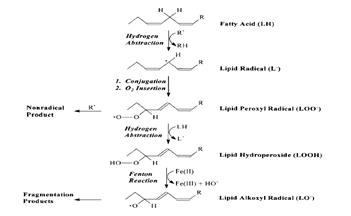
Рис.2. Радикальные и нерадикальные продукты ПОЛ [Aibert W, Girotty, 1998]
Особенно важно подчеркнуть, что происходит нарушение мембранных структур, изменение транспорта ионов Са2+, создающее угрозу жизни клетки [Michiel, Remacle, 2004].
Антиоксидантная система .
Образование АФК, известных как прооксиданты, наблюдается во многих метаболических процессах и является обязательным атрибутом нормальной аэробной жизни. Функционирование и развитие клеток, а так же организма в целом, в кислородсодержащем окружении не могло бы быть возможным без существования защитных систем, основу которых составляют ферментативные и неферментативные антиоксиданты [Петрович, Гуткин, 2005]. Постоянное образование прооксидантов в живых организмах уравновешено их дезактивацией антиоксидантами, поэтому для поддержания гомеостаза необходима непрерывная регенерация антиоксидантной способности. Отсутствие или сбои этой непрерывности сопровождаются накоплением окислительных повреждений и приводят к возникновению окислительного стресса [Меньщикова с соавт., 2006].
Основными функциями антиоксидантной системы являются: ограничение интенсивности реакции свободнорадикального и перекисного окисления; защита чувствительных к окислительным повреждениям биомолекул мембран, внутри - и внеклеточных структур от действия свободных радикалов и перекисных соединений; восстановление окислительных молекулярных повреждений [Шепелев с соавт., 2004]. В целом основная задача системы антиоксидантной защиты состоит в предотвращении и ограничении развития патологических состояний, вызываемых окислительными повреждениями структур организма [Владимиров, 1998; Журавлев, 2003].
Общепринятой номенклатуры антиоксидантов в настоящее время нет. По химической природе биоантиокислители представляют собой широкий класс соединений: ферменты (СОД, каталаза, глутатионпероксидаза (ГПО)), фенолы и полифенолы (токоферолы, эвгенол), флавоноиды (рутин, кверцетин), стероидные гормоны и многие другие соединения [Бурлакова, Храпова, 2004]. В зависимости от растворимости различают жирорастворимые (витамин Е, А, К, убихинон) и водорастворимые (витамин С, SH-содержащие соединения) биоантиокислители, по молекулярной массе выделяют группу низкомолекулярных антиоксидантов (глутатион, α-токоферол, мочевая кислота) и высокомолекулярных ( ферритин, каталаза) [Кения, Лукаш, Гуськов, 1993].
К числу энзимных антиоксидантов относят прежде всего супероксидредуктазу (СОР), восстанавливающую О2- в пероксид водорода, СОД, катализирующую реакцию дисмутации О2- с образованием пероксида водорода и молекулярного кислорода [Cord, Fridovich, 2000], каталазу, восстанавливающую Н2О2, глутатионзависимые пероксидазы и трансферазы (ГТ) [Wendel, 2004].
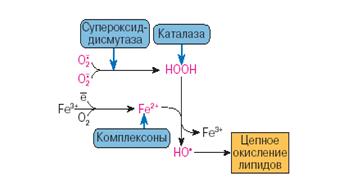
Рис.3. Антиоксиданты водной фазы [Владимиров, 1998]
Главной ферментативной системой плазмы крови является ГПО внеклеточных жидкостей и ГПО гидроперекисей липидов (ГПО 4), которая будучи липофильным соединением эффективно взаимодействует с гидроперекисями фосфотидилхолина, холестерина и эфиров холестерина в липопротеинах низкой плотности (ЛПНП), восстанавливая их, следовательно, защищая от окислительной модификации [Thomas at al., 2006; Abiaka, Al-Awadi, Olusi, 2003]. Кроме того ГПО 4 совместно с токоферолом практически полностью подавляет ПОЛ в биологических мембранах благодаря тому, что витамин Е эффективно восстанавливает пероксирадикалы, а фермент разлагает гидроперекиси, препятствуя тем самым их вовлечению в окислительный цикл [Ursini, Bindoli, 2005; Бондарь, Ланкин, Антоновский, 1989].
ГТ, в отличие от селенсодержащей ГПО, для которой лучшими субстратами являются гидрофильные гидроперекиси с малым размером молекул, эффективно восстанавливает гидрофобные гидроперекиси с большим объемом молекулы: гидроперекиси полиненасыщенных жирных кислот (линолевой и арахидоновой), фосфолипидов [Бобырев, Почерняева, Стародубцев, 2005; Колесниченко, Кулинский, 2004].
Вместе с тем во всех водных и липидных фазах организма могут протекать радикальные окислительные процессы, в защите от которых важную роль играют антиоксиданты-ингибиторы органических радикалов, среди которых важное место занимают соединения фенольного типа. В настоящее время выделено несколько тысяч фенольных соединений, среди которых выраженным антиоксидантным эффектом обладают витамины Е и К, убихиноны, триптофан и фенилаланин, а так же большинство растительных (флавоноиды) и животных пигментов [Дубина, 2005].
В антирадикальной защите липопротеинов плазмы крови и клеточных мембран α-токоферолу принадлежит ведущая роль – одна его молекула защищает ≈10000 молекул ненасыщенных жирных кислот [Евстигнеева, Волков, Чудинова, 2003], при этом считается, что α-токоферол способен обезвредить не менее 60% образующихся пероксильных радикалов [Тиунов, 1995]. Окисление α-токоферола со свободными радикалами компенсируется биорегенерацией молекул этого антиоксиданта в реакциях восстановления коантиоксидантами (АН), редокс-потенциал которых ниже, чем у радикала α-токоферола (α-Тф-О.) [Бурлакова, Крашков, Храпова, 1998]. В результате такой реакции не только происходит восстановление витамина Е, но и предотвращается возможность инициации α-токофероксильным радикалом окисления липидов:
α-Тф-О. + RH→ α-Тф-ОH + R. (1)
α-Тф-О. + АH→ α-Тф-ОH + А. (2)
В физиологических условиях вторая реакция обычно превалирует над первой, так как константа скорости реакции α-Тф-О. с НЖК не превышает 103М-1с-1, в то время как для реакции (1) константа скорости может достигать значений 104-107М-1с-1.К наиболее изученным коантиоксидантам относятся убихинол, аскорбиновая кислота (АК), билирубин [Менщикова, Зенков, 1993].
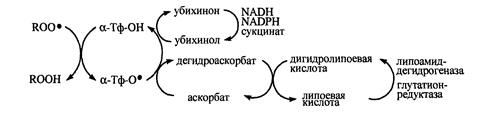
Рис.4. Окислительно-восстановителные превращения α-токоферола и сопряженных с ним коантиоксидантов [Меньщикова с соавт., 2006].
АК превосходит другие антиоксиданты плазмы в защите липидов от перекисного окисления, так как только это соединение достаточно реакционноспособно, чтобы эффективно ингибировать инициацию ПОЛ в водной фазе [Padayatty, Katz, Wang, 2003].
Важными внеклеточными антиокислителями являются альбумины – простые гидрофильные белки плазмы крови, которые являются основными носителями SН групп. SН содержащим соединениям принадлежит ведущая роль в защите клеток от ОН-радикала, образующегося в реакции Фентона или в результате разложения молекул воды под действием ионизирующих излучений.
Необходимо отметить наличие антирадикальных свойств у белков, хелатирующих ионы железа и других металлов с переменой валентностью. В первую очередь это трансферрин, лактоферрин и церулоплазмин. Основная роль трансферрина и близкого ему по структуре лактоферрина, содержащегося в молоке и выделяющегося фагоцитами при их активации, состоит в акцептировании «свободного» железа, что препятствует образованию радикалов НО.в реакциях Фентона, катализируемых ионами Fe [Зборовская, Банникова, 2000].Значимую роль в этом процессе играет церулоплазмин, Cu-содержащий белок, обеспечивающий окисление Fe 2+ до Fe3+ и делающий тем самым железо доступным для связывания трансферрина [Воскресенский с соавт., 2004; Krsek-Staples, Wbster, 2004; Василец, 2004]
Наиважнейшим антиоксидантом внеклеточной жидкости является мочевая кислота (МК). Ввиду высокого ее содержания в плазме крови человека некоторые исследователи считают, что на нее приходится 35-65% защиты липопротеинов от окисления, 10-15% ингибирования НО. и 12% ингибирования синглетного кислорода. Кроме того МК может выступать синергистом с радикалами α-токоферола и аскорбиновой кислотой, что усиливает их антиоксидантное действие [Булгакова, 2006].
Дата: 2019-05-28, просмотров: 408.