Первой работой по кинетике углекислотной конверсии метана (3) была работа, выполненная в лаборатории М.И. Темкина [11]. Основываясь на схеме
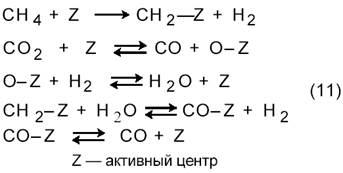 |
они показали, что в случае протекания процесса на никелевой фольге при 800─900 °С реакция описывается таким же кинетическим уравнением, что и паровая конверсия (1) на этом же катализаторе [27]:
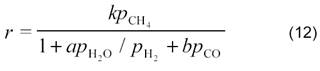
где k, a и b ─ константы; ρСН4, ρН2О, ρН2 и ρСО ─ парциальные давления метана, воды, водорода и СО, соответственно.
Если в смеси имеется водяной пар, то фактически протекает паровая конверсия СН4 с повторным быстрым образованием воды по реакции, обратной (6). В работе [11] подтверждается, что конверсия смесей СН4+СО2 и СН4+Н2О на катализаторе Ni/МgО соответствует одинаковому кинетическому уравнению.
В дальнейшем были найдены и другие уравнения. Например, для реакции, соединяющей углекислотную конверсию метана (3) и паровую конверсию СО (6):
СН4 + 2СО2 → Н2 + Н2О + 3СО (13)
на Ni/C, Ni/SiO2, Ni/TiO2 и Ni/MgO, а также на нанесенных Pt-катализаторах [12] было получено кинетическое уравнение:
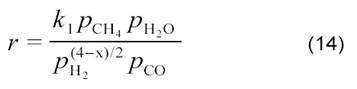 |
По мнению авторов [12], оно соответствует схеме:
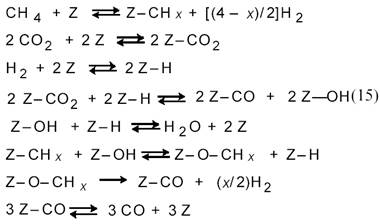 |
Для процесса на катализаторе Ni/Al2O3 было получено уравнение:
r = kp1/2 (16)
Существует сводка данных (взятых из более 60 статей) по исследованию кинетики углекислотной конверсии метана. Ниже дана краткая оценка этих данных.
Значения энергии активации Еа изменяются в интервале:
· по расходованию CH4 и CO2 соответственно от 30 до 350 кДж/моль и от 35 до 130 кДж/моль,
· по выходу CO и H2 соответственно от 38 до 218 кДж/моль и от 38 до 250 кДж/моль.
Наиболее выпадающие значения ЕСН4 относятся к реакции на Re/Al2O3 350 кДж/моль) и Pt (73 кДж/моль). Некоторые исследователи считают, что из числа достоверных данных следует также исключить значения энергии активации для реакции на Pb/MgO, т.к. EСО > EН2, причем ЕСО = 921 кДж/моль. Большинство остальных данных для Ni-катализаторов находятся вблизи значения 239 ± 20 кДж/моль, которое довольно близко к энергии активации диссоциации СН4 на Ni(110) и Ni(111): 233 ± 27 и 221 ± 20 кДж/моль, соответственно. Для катализа с участием благородных металлов Еа ближе к 314─377 кДж/моль.
На кажущиеся значения энергии активации углекислотной конверсии метана сильно влияет реакция (6), что отражается, по-видимому, в увеличении ЕСН4 с ростом объемной скорости. При этом снижается конверсия и влияние обратной реакции (гидрирование СО в СН4)становится менее значительным.
Каталитическая активность при 450 °С (экстраполяция), выраженная через число оборотов реакции tn, изменяется в интервале от 0,1 до 1,0.
Большие значения tn получены для Ru/TiO2 (4,3.7,2), Ru/Al2O3 (1,5─4,3), Rh/VOx/SiO2 [4]. Для кристалликов Rh на носителе получен следующий ряд tn: ZrO2 > TiO2 ≥ Al2O3 > La2O3 = SiO2 > MgO. Этот ряд совпадает с рядом: TiO2 > Al2O3 > SiO2 и не совпадает с рядами: Al2O3 > La2O3 > CeO2 > MgO > TiO2 и MgO > TiO2 ≈ Al2O3 > SiO2 [13].
Было установлено, что число оборотов реакции не зависит от природы носителя: ZrO2 ≈ TiO2 ≈ Al2O3 ≈ SiO2. Такие противоречия могут быть объяснены влиянием обратной реакции, измерениями при разных объемных скоростях или неправильностью экстраполяций. Для нанесенных Ni-катализаторов получен следующий ряд tn:TiO2 > Al2O3 ≈ SiO2 ≈ MgO.
В подавляющем числе исследований установлено, что скорость углекислотной конверсии метана пропорциональна давлению СН4 в первой степени, в то время как величина ρCOn входит в кинетические уравнения, приведенные в разных работах, в числитель и знаменатель с показателем степени n от 0 до 2. Это указывает на то, что взаимодействие метана с катализатором является лимитирующей стадией.
Константы скорости взаимодействия СН4 и СО2 с единичным Ni-центром на Ni/TiO2 были измерены при 420 °С. С повышением температуры восстановления катализатора способность к диссоциации СН4 растет, а диссоциации СО2 не изменяется.
Положительный кинетический изотопный эффект (КИЭ) kCH4/kCD4, наблюдавшийся в процессе на Ni/γ-Al2O3, Ni/SiO2, Rh/SiO2 , Ni/La2O3 [13], также указывает на то, что стадия активации метана является лимитирующей, а диссоциация СО2 происходит легко. Для реакций на Ni/Al2O3 и Ni/La2O3 величина КИЭ растет с повышением температуры, причем в случае Ni/La2O3 КИЭ значительно выше, чем в процессе на Ni/Al2O3.
Исследование кинетики углекислотной конверсии метана на Ni/SiO2 при 700 0С и атмосферном давлении [13] позволило получить следующие данные: реакция первого порядка по ρСО2 и по ρН2, с ростом ρСН4 скорость реакции быстро увеличивается и достигает насыщения.
Для описания кинетики предложена схема
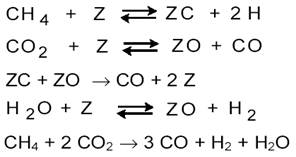 |
Лимитирующей стадией является поверхностное взаимодействие адсорбированных углерода и кислорода. По данным [13], кинетика углекислотной конверсии метана сильно зависит от обратной реакции ─ гидрирования CO:
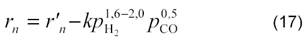 |
Энергия активации реакции по расходованию метана (ECH4) растет в ряду Ru/TiO2, Ru/Al2O3, Ru/C: 76,4; 107,4; 107,6 кДж/моль, соответственно. Такая же закономерность наблюдается для ECO2: 71,6; 75,4; 86,2 кДж/моль, что отвечает эффекту сильного взаимодействия металл-носитель.
EH2 = 17,1; 18,0; 20,6 кДж/моль, соответственно, была всегда больше ECO: 97,1; 125,2; 111,3 кДж/моль.
Для реакции на сульфидных катализаторах MoS2 и WS2 при 600 °С получено следующее кинетическое уравнение:
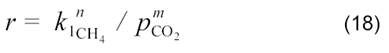 |
которое отличается от уравнений (14, 16, 17) для реакции на нанесенных металлических катализаторах. Расхождения объясняются большой адсорбцией СО2 и малой адсорбцией СН4. Наличие СО2 на поверхности подавляет разложение метана.
Для реакции на оксидно-марганцевых катализаторах в наших работах [14] было получено кинетическое уравнение
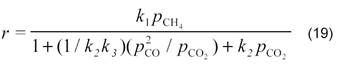 |
В случае малых конверсий уравнение имеет более простой вид:
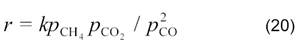 |
Практически все исследователи отмечают, что конверсия СО водяным паром протекает с большими скоростями, чем углекислотная конверсия СО2.
4.3 Механизм конверсии смеси CH 4 + CO 2
В большинстве предлагаемых механизмов углекислотной конверсии метана рассматривается диссоциативная адсорбция метана и СО отличающаяся от схемы (11) отсутствием стадии взаимодействия СНх с водой [15]. Предполагается последовательная диссоциация СН4 на поверхности образованием частиц СНх и С и их взаимодействие адсорбированным атомом О, а не с водой. Эти процессы отражает схема:
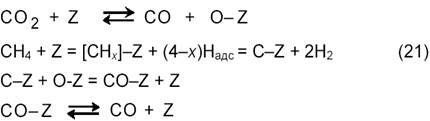 |
Диоксид углерода может также непосредственно реагировать с поверхностным углеродом по реакции, обратной реакции Будуара (9). По данным [18] диссоциация метана на никеле протекает преимущественно на малых кристалликах металла. Обнаружен также эффект структурной чувствительности диссоциации метана, на гранях кристалла Ni диссоциация CH4 следует ряду: Ni(110) > Ni(100) > Ni(111). Как показано импульсным методом, в условиях реакции (3) в зависимости от природы катализатора образуются различные промежуточные соединения CHx: х = 2,7 для Ni/MgO, 2,5 для Ni/SiO2, 2,4 для Ni/Al2O3, 1,9 для Ni/TiO2, 1,0 для Со/SiO2 и 0,75 для Co/Al2O3. Вещества СНх с малыми значениям х легче дают углеродные отложения. По мнению, Н-спилловер на носитель минимизирует углеобразование, сдвигая равновесие в сторону CHx с большими значениями х. Скорость разложения СН4 в условиях реакции (3), по-видимому, выше, чем скорость разложения одного СН4, без участия CO2. Поэтому схема (11) нуждается в соответствующих уточнениях.
С механизмом (21) согласуется ряд экспериментальных данных. Так, величина КИЭ для конверсии смеси CH4 + CO2 на Ni/SiO2 больше, чем в случае образования СО только из метана. Это объясняется двумя маршрутами генерации СО: одна молекула СО образуется из СН4, а другая ─ из СО2 [11]:

Подобный же результат был получен с помощью метода изотопного обмена и ИК-спектроскопии диффузного рассеяния.[16] Диссоциативная адсорбция метана и СО2 на нанесенном родиевом катализаторе была доказана в экспериментах с мечеными молекулами 13СН4 и С18О2. Таким образом, на основании проведенных исследований можно заключить, что реакция (3) протекает по окислительно-восста-новительному механизму (21): СО2 окисляет поверхность катализатора, а СН4 восстанавливает ее.
Большой цикл работ по исследованию механизма углекислотной конверсии метана на Ni/SiO2, Ni/La2O3, Ru/SiO2, Ru/Al2O3 и других катализаторах методами ТАР-реактора (TAP ─ temporary analysis of products), изотопного обмена, рентгеновской фотоэлектронной спектроскопии, ферромагнитного резонанса, электронной микроскопии и ИК-спектроскопии выполнен К. Миродатосом с сотр. [16─17]. Исследование конверсии CH4 на Ni/SiO2 методом изотопного обмена (12СН4 и 13СО2) показало, что после импульса 12СН4 наблюдается быстрое выделение Н2, а на поверхности катализатора, очевидно, остается слой карбида Nix12C, наиболее вероятный его состав Ni2C или Ni3C. Карбидоподобные формы в условиях реакции остаются стационарными и могут гидрироваться обратно в СН4. После импульса 13СО2 регистрируются два импульса СО: сначала образуется 13СО из 13CO2, на поверхности остается Оадс, затем образуется 12СО за счет взаимодействия Оадс с СН4 или с 12Садс после разложения СН4. Решеточный подповерхностный кислород в образовании CO и H2 не участвует. Диоксид CO2 находится в обратимом равновесии с поверхностью и с первой молекулой СО. Образование второй молекулы СО является лимитирующей стадией и лимитирует здесь медленная диффузия атомов С и О. Таким образом, согласно [16─17] и вопреки мнению большинства других исследователей, в углекислотной конверсии метана на Ni/SiO2 лимитирующая стадия не включает диссоциацию С─Н-связи, а небольшое значение КИЭ (kCH4/kCD4) может быть объяснено разрывом С─Н-связи в обратимой стадии диссоциации метана.
В отличие от реакции на Ni/SiO2, для процессов на Ru/SiO2, Ru/Al2O3, Ru/C лимитирующей стадией является диссоциация СН4, а затем СО2 реагирует с адсорбированным углеродом с образованием СО. Накопление углерода здесь минимально и, следовательно, выделение водорода и последующее его окисление подавлено.
На катализаторе Ru/SiO2, поскольку SiO2 является довольно инертным носителем, вся реакция CH4 + CO2 протекает на фазе Ru. Быстрое отравление катализатора вызвано образованием промежуточного
углерода, склонного к полимеризации и дальнейшей графитизации. В случае реакции на Ru/C носитель-графит собирает частички CHx, что уменьшает время жизни образующегося углерода на Ru и обусловливает
очень высокую стабильность этого катализатора. В реакции на Ru/Al2O3 участвуют также группы AlOH, подпитываемые спилловером адсорбированных частиц H и O с Ru, что ограничивает дезактивацию катализатора.
В общем случае на Ru-фазе нанесенных рутениевых катализаторов протекают необратимая диссоциация CH4 и следующие процессы:
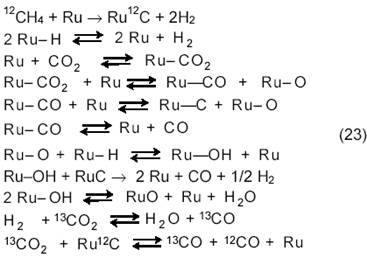 |
Последнее уравнение показывает, что обе молекулы СО образуются в одной реакции на катализаторе Ru/SiO2, но имеют разное происхождение.
На Ru/Al2O3 протекают еще реакции с участием AlOH-групп:
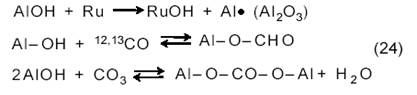 |
К выводу о простом механизме со стехиометрическим разложением СН4 на основании импульсных измерений приходят также в работах [13, 14]. Однако здесь следует иметь в виду, что импульсный метод может и не выявить образования частиц СНх, которые принимаются большинством авторов как промежуточные. Есть данные [15], что на нанесенных Ni-катализаторах число оборотов для разложения СН4 на С и Н2 много ниже, чем для конверсии СН4 с СО2.
Более сложная картина наблюдается в случае реакции на Ni/La2O3. Как показывает метод изотопного обмена, молекулы 13СО и 12СО получаются при взаимодействии СН4 и СО2 с катализатором:
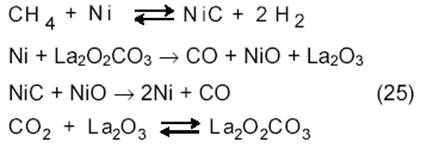 |
На металлах, нанесенных на оксид с основными свойствами, реакция протекает на границе металл-оксид, причем метан диссоциирует на металлической поверхности, а СО2 образует карбонат на носителе. Таким образом, катализатор Ni/SiO2 является монофунциональным, а катализатор Ni/La2O3 ─ бифункциональным.
Методы ТАР-реактора и ИК-спектроскопии показали, что интенсивность линий СО2 после впуска смеси СО2 + СН4 на Rh/γ-Al2O3 проходит через максимум, а затем образуется СО32─, так что механизм с участием реакции Будуара весьма вероятен.
Методы ТАР-реактора и ИК-спектроскопии применили также для исследования конверсии смеси СН4+СО2 на катализаторах ZrO2 и Pt/ZrO2. Установлено, что селективность образования СО определяется одним и тем же промежуточным веществом и зависит от содержания атомарного кислорода на каталитической поверхности. Оксид ZrO2 ответственен за активацию СО2, он частично восстанавливается и реокисляется в условиях реакции. Замещение решеточного кислорода в ZrO2 кислородом из СО2 ─ медленная стадия процесса. После импульса СО2 единственными регистрируемыми частицами, которые остаются достаточно долго на поверхности, являются поверхностные ОН-группы. Очевидно, Оадс после активации СО2 реагирует с метаном. Природа Оадс неясна, это могут быть и реакционноспособные ОН- или СО3-группы. Метан не диссоциирует на ZrO2, но диссоциирует на Pt/ZrO2.
Катализатор Pt/ZrO2 активнее, чем платина на других носителях. Возможно, при этом образуется сплав Pt1─xZr. Предложена следующая схема механизма конверсии на Pt/ZrO2:
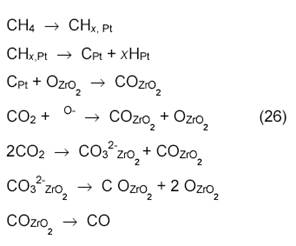
Еще в одной работе с использованием метода ТАР-реактора [18] показано, что не атомы О, а поверхностные ОН-группы реагируют с поверхностными частицами С или СНх:
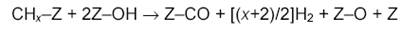 |
Однако в большинстве работ ключевыми промежуточными частицами считают адсорбированные атомы кислорода. В работе [13] предполагается корреляция скорости образования СО в смешанной конверсии СН4+СО2+Н2О с прочностью связи металла с Оадс. Такую корреляцию нельзя считать достоверной и даже если она существует, это еще не доказывает, что атомы Оадс являются ключевыми интермедиатами.
Исследование реакции (3) на NiO/MgO при 800 °С (изотопный метод) показало, что в этих условиях на катализаторе присутствуют два типа кислорода: адсорбированный, взаимодействующий с Садс, и решеточный, реагирующий значительно медленнее. Реакция (3) протекает по окислительно-восстановительному механизму.
Окислительно-восстановительный механизм углекислотной конверсии метана на Ni-катализаторах, нанесенных на MgO, принимается и в работах Института химической физики РАН. Окисление Ni и восстановление NiO ускоряется на катализаторе Ni-Cr2O3/MgO. Процесс протекает через промежуточное образование шпинели по суммарному стехиометрическому уравнению:
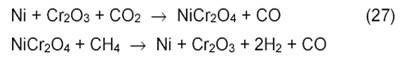 |
Диссоциация метана происходит, по-видимому, на Ni или NiC, а активация CO2 осуществляется за счет участия кислорода шпинели NiCr2O4, вероятно, через промежуточное образование карбоната MgCO3.
Рассмотрена возможность окислительно-восстановительного механизма углекислотной конверсии метана на системе Pt/CeO2. Здесь Pt активирует CH4, а CeO2─x активирует (восстанавливает) CO.
В ряде работ фиксировали образование карбонатов на металлических катализаторах, нанесенных на основные носители. Например, было показано [13], что на Pt/ZrO2 восстановление СО2 происходит через образование карбоната циркония вблизи границы ZrO2 с Pt. Углерод на металле восстанавливает этот карбонат до формиата.
Далее протекают реакции:
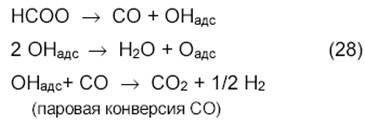 |
Можно предположить, что на разных катализаторах механизм различен: на чистых металлах и на металлах, нанесенных на нейтральные носители типа SiO2, более вероятна полная диссоциация СН4 и СО2, а на металлических катализаторах с основными носителями вероятнее промежуточное образование карбоната.
В ИК-спектрах поверхностных соединений, а также после завершения реакции (3), были обнаружены монодентатные и бидентатные комплексные карбонаты, гидрокарбонаты, формиатные комплексы, линейные и мостиковые карбонилы, группы СНх и НСО. Предполагается участие в некоторых механизмах и этих промежуточных веществ. Показано, что атомы Н способствуют разложению карбонатов.
В условиях углекислотной конверсии метана на Pt/TiO2, Pt/SiO2, Pt/ZrO2, Pt/Cr2O3 преобладающим поверхностным соединением является адсорбированный СО. Обнаружен также СН2О. По мнению авторов [12], важнейшим интермедиатом на поверхности является СНхО., хотя прямых ИК-спектроскопических подтверждений пока нет. Тем не менее авторы [12,13] считают, что полученные ими данные свидетельствуют в пользу механизма (15) с вероятными стадиями: обратимая диссоциация СН4 с образованием СНх и Н2, недиссоциативная адсорбция СО2 на носителе, диссоциация адсорбированного СО2 с участием Н на границе металл-носитель, реакция СНх с О (или с ОН) на границе металл-носитель с образованием СНхО. и последующее разложение этого интермедиата с образованием продуктов реакции СО и Н2.
По ИК-спектроскопическим данным других исследователей [14] на катализаторах Pt/TiO2 и Pt/ZrO2 адсорбция и активация СО2 протекают по механизму обратной конверсии водяного газа (6) на носителе с участием поверхностных ОН-групп. Образуются группы СНхО, а при их разложении ─ СО и Н2.
Механизм начальных стадий конверсии СН4+СО2 на никеле, нанесенном на SiO2, La2O3•SiO2 или La2O3, изучали импульсным методом отклика [18]. На NiO адсорбция СО2 конкурирует с диссоциацией СН4. На La2O3 диоксид углерода адсорбируется с образованием карбонатов и формиатов, которые затем разлагаются с выделением СО и восстановлением кислородных вакансий. Ресурсы О для образования СО из СН4 обеспечиваются за счет перехода кислорода от La2O3 к Ni. Метан восстанавливает NiO и образует вакансии в La2O3.
По данным [10], в случае катализа на NiMgO, промотированном Pt, Pd или Rh, лимитирующей стадией реакции (3) становится диссоциация СО2 или поверхностная реакция СНх + Оадс вместо диссоциации СН4 (для непромотированного NiMgO).
Есть также предположения о промежуточном образовании метильных радикалов. Для выяснения этого механизма на примере конверсии СН4+СО2 на Rh/SiO2 на катализатор адсорбировали радикалы СН3, полученные разложением азометана [18]. По ИК-спектрам было установлено, что частицы СН3,адс реагируют с О2 и СО2 из газовой фазы при температуре более 100 °C, поэтому кокс не отлагается на катализаторе. При этой же температуре радикалы СН3,адс разлагаются в вакууме, причем разложение ускоряется под действием СО2.
Большая часть СН3 адсорбируется на носителе SiO2, а Rh участвует в дальнейших превращениях. Метан при этой температуре на катализаторе не адсорбируется.
Предполагается протекание следующих реакций:

Существование СН3-групп в условиях реакции СН4+СО2 на Ni/SiO2 показано также методами температурно-программируемого восстановления и температурно-программированной реакции (ТПР) [18]. Наблюдалось образование С2Н6. Группы СН3 на поверхности могут взаимодействовать с адсорбированными атомами О с образованием групп СНхО. и далее СО и Н2. Проводилось изучение механизма углеобразования. Установлено, что после диссоциации СО на Ni атомы углерода мигрируют в подповерхностный слой никеля, индуцируя его реконструкцию, удлинение связей Ni─Ni и последующее более глубокое проникновение в металлический кристаллит вплоть до отложения углерода на обратной поверхности кристаллита. Электронно-микроскопическое исследование показало разные свойства углерода, образовавшегося по реакциям (8) и (9). В случае смеси СО+СО2 углерод капсулируется, а из смеси СН4+Н2 формируются графитовые пластинки и нити. Отсюда следует вывод, что вначале образуется С из СО/СО2, а вторичный углерод осаждается при диссоциации метана.
Методом температурно-программированного гидрирования после завершения реакции на Ni/MgO были обнаружены две формы углерода: аморфный α-С, гидрирующийся при 270─420 °С и β-С, гидрирующийся выше 600 °С, по-видимому, это графит. Углерод образуется преимущественно на малых частицах никеля.
Проведение температурно-программированного процесса взаимодействия СО и СН4 на катализаторах Ni0,03Mg0,97O, 3%Ni/MgO и 3%Ni/Al2O3 позволило выявить, что углерод образуется как при диспропорционировании СО, так и при диссоциации метана [18]. При
этом происходит быстрое окисление СНх на Ni под действием СО2. На всех трех изученных катализаторах температура пика взаимодействия С+СО2 одна и та же ─ 550 °С), что указывает на отсутствие взаимодействия между катализатором и осажденным углеродом. На восстановленном катализаторе Ni0,03Mg0,97O реакция между СО2 и Ni протекает при температуре на 40 °С ниже, чем на остальных катализаторах. Авторы [18]
приходят к выводу, что возможны два маршрута активации СО2:
1) на носителе вблизи границы с Ni и 2) на частицах Ni.
Первый маршрут более благоприятен для ингибирования углеобразования.
В опытах со смесями 13СН4 + 12СО2 на катализаторе Ni/CaO-Al2O3 также было установлено, что углерод образуется как из СО, так и из СН4 [38]. Высокотемпературный пик поглощения Н2 в ТПР-экспериментах (450─600 °С) приписан спилловеру водорода с Ni на носитель.
Квантово-механический расчет реакции СО2+СН4 на Cu(111), Ni(111), Pd(111), Pt(111), Rh(111), Ru(111), Ir(111) и Fe(111) методом UBI─QEP (unity bond index ─ quantum exponential potential) [18] показал, что лимитирующими стадиями являются как диссоциация СН4, так и диссоциация СО2, причем оба процесса ускоряют друг друга. Рассмотрев 84 возможных реакции на поверхности, авторы пришли к следующей более вероятной схеме:

Ряд каталитической активности, по их расчетам, примерно соответствует экспериментальным данным:
Fe > Ni > Rh > Ru > Ir > Pd > Pt > Cu.
Однако для практики Ni предпочтительнее Fe, потому что никель менее подвержен коксоотложению, а Ru лучше Rh, поскольку рутений дешевле.
Промежуточное образование карбонатов в углекислотной конверсии метана на оксидных катализаторах было доказано в наших работах [14]. Согласно кинетическим данным и методу термодесорбции и рентгенофазового анализа на нанесенных оксидно-марганцевых катализаторах процесс протекает по механизму

Таким образом, продукт реакции ─ СО образуется в результате восстановительного разложения карбоната при его взаимодействии с углеродом (или карбидом, или СНх) или с Н2.
До сих пор не был рассмотрен вопрос о возможных гомогенных стадиях в углекислотной конверсии метана. Между тем, появились сведения о гетерогенно-гомогенном механизме другой эндотермической реакции, а именно, паровой конверсии СН4 в синтез-газ (1). Авторы [19, 20] связали наблюдаемое ими увеличение скорости реакции при уменьшении навески Ni-катализатора ГИАП-16 с реализацией гетерогенно-гомогенного механизма с вылетом в объем промежуточных частиц, например метильных радикалов. Кинетика и механизм реакций (1) и (3) близки. Поэтому не исключено наличие гомогенных стадий и в конверсии СН4+СО2. Также был обнаружен аналогичный эффект для реакции (3) ─ небольшой рост конверсии с уменьшением навески Ni-Cr/MgO-катализатора. Однако величина эффекта не настолько велика, чтобы принять его как доказательство гетерогенно-гомогенного механизма. Таким образом, совокупность данных большого числа работ доказывает существование двух основных механизмов реакции СН4+СО2:
1) диссоциация СН4 и СО2 и последующее взаимодействие атомарных фрагментов С, Н и О на массивных металлических катализаторах или на металлах, нанесенных на инертные носители, и
2) диссоциация СН4 и взаимодействие фрагментов С или СHx с СО2 или с СО32─ на металлах, нанесенных на основные носители. В последнем случае взаимодействие облегчается в присутствии добавок оксидов переходных металлов, участвующих в восстановлении CO2.
Дата: 2019-05-28, просмотров: 313.