Разделение и количественное определение белковых
Фракций сыворотки крови методом электрофореза на бумаге.
Принцип метода. Электрофорез – это движение заряженных частиц в поле постоянного электрического тока. Скорость перемещения молекул белков в электрическом поле зависит от величин заряда, молекулярной массы, pH, ионной силы раствора.
Белки сыворотки крови помещают на полоску бумаги, смоченную буферным раствором, через которую пропускают постоянный электрический ток. При pH 8,6 белки сыворотки крови заряжаются отрицательно и под воздействием электрического поля перемещаются к аноду.
Сыворотка крови человека содержит различные белки. С помощью электрофореза на бумаге выделяются 5 фракций - альбумины, α1-, α2-, β-, γ-глобулины.
Клинико-диагностическое значение. Многие патологические состояния сопровождаются количественными изменениями соотношения белковых фракций крови – диспротеинемиями. Уменьшение содержания фракции альбуминов характерно для заболеваний печени за счет снижения белок-синтезирующей функции гепатоцитов. Гипоальбуминемия также сопровождает заболевания почек вследствие потери белка с мочой. Увеличение содержания фракций α1- и α2-глобулинов наблюдается при стрессе, наличии воспалительных процессов за счет белков «острой фазы», при коллагенозах и метастазировании злокачественных новообразований. Фракция β-глобулинов растет при гиперлипопротеинемиях. Фракция γ-глобулинов повышается при иммунных реакциях, вызванных вирусными и бактериальными инфекциями. Снижение γ-глобулиновой фракции может иметь место при первичном и вторичном иммунодефиците.
Порядок выполнения работы
1. Устройство прибора для электрофореза. Прибор состоит из выпрямителя, подающего постоянный ток необходимого напряжения, и камеры для электрофореза. Сама камера состоит из 2-х ванн; в одной из них имеется неподвижная перегородка, куда помещается платиновый электрод (+ анод), а в другой находится электрод из нержавеющей стали (- катод). Между ваннами, заполненными соответствующим буфером, имеется соединительный мост, на который помещают полоски специальной фильтровальной бумаги.
2. Проведение электрофореза. Заполнить обе ванны камеры раствором вероналового буфера с pH 8,6. Буферного раствора в ваннах должно быть столько, чтобы он покрывал неподвижную перегородку, но был ниже подвижных перегородок.
Вставить в ванны электроды. Вырезать из фильтровальной бумаги полосы необходимого размера в зависимости от величины камеры (обычно шириной 4-6 см) и простым карандашом отметить место, на которое впоследствии будет наноситься сыворотка (старт). Смочить эти полоски в вероналовом буфере. Вставить в ванны-камеры соединительный мост. Поместить полоски бумаги на сухие пластинки щипцами, погрузив концы полосок в ванны с буфером, и на заранее отмеченные участки бумаги нанести сыворотку по 0,025-0,005 мл на расстоянии 5-6 см от края моста. Нанесение сыворотки производится со стороны катода.
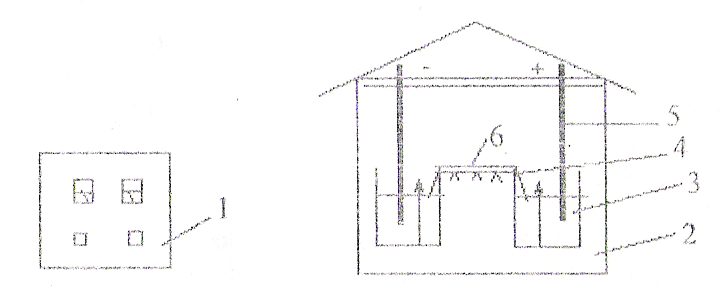
Рисунок 1. Схема камеры для электрофореза белков на бумаге:
1-стабилизатор; 2-камера для электрофореза; 3-буферный раствор; 4-поддерживающий соединительный мост-электрод; 5-фильтровальная бумага для электрофореза.
После нанесения на бумажные полоски сыворотки камера герметично закрывается крышкой. На крышке камеры расположен прижим блокировки, служащий для включения камеры. Присоединенный выпрямитель подает к камере постоянный ток от 2 до 4 мА при постоянном напряжении 110-160В. Электрофорез проводят при градиенте потенциала от 3 до 8 В на 1 см полосы при комнатной температуре. Хорошее разделение происходит за 18-20 часов.
3. Выключение прибора и выявление белковых фракций. Выключают прибор. Снимают камеры и извлекают бумажные полоски из прибора. Затем каждую полоску помещают в сушильный шкаф на 20 минут при температуре 1050С. При этом происходит фиксация белковых фракций на бумаге. Окраску белков проводят раствором бромфенолового-синего в течение 30 минут, затем промывают электрофореграммы 2% раствором уксусной кислоты. Полученные электрофореграммы сушат на воздухе. Белковые фракции окрашиваются в сине-зеленый цвет.
4. Количественное определение белковых фракций. Окрашенные белковые пятна вырезают, краситель элюируют 0,01 н раствором щелочи. Интенсивность окраски каждой фракции определяют колориметрически на ФЭКе.
Количественное определение белковых фракций на электрофореграмме можно установить двумя способами: путем элюирования краски и фотоколориметрирования и денситометрическим методом.
Содержание белковых фракций сыворотки крови, полученное с помощью электрофореза на бумаге, в среднем составляет у взрослого человека:
альбумины 55,4-65,9 %
α1-глобулины 3,4-4,7 %
α2-глобулины 5,5-9,5 %
β-гдобулины 8,9-12,6 %
γ-глобулины 13-22,2 %
Денситометрический метод. В специальном аппарате (денситометре) через электрофореграмму пропускают пучок света, поглощение которого зависит от оптической плотности окрашенных белковых пятен. Свет, прошедший через электрофореграмму, улавливается фотоэлементом и превращается в электрический ток, колебания которого фиксируют на бумажном листе в виде кривой, каждый пик кривой соответствует определенной белковой фракции.
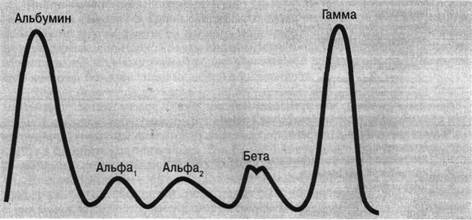
Рисунок 2. Электрофореграмма сыворотки человека.
2. Определение активности амилазы в слюне и моче по Вольгемуту.
По Вольгемуту.
Амилаза - фермент, осуществляющий гидролитическое расщепление полисахаридов до декстринов и мальтозы (химизм реакции см. занятие№6). Конечные продукты действия амилазы не дают цветной реакции с йодом. Наиболее богаты амилазой слюнные и поджелудочная железы.
Клинико-диагностическое значение имеет определение активности амилазы в крови, куда она попадает из поджелудочной железы (40%) и слюнных желез (60%). Амилазная активность крови по Вольгемуту в норме составляет 25-125 Ед/л. При остром панкреатите в первые сутки заболевания активность амилазы крови возрастает в десятки раз, а затем постепенно возвращается к норме. Амилазная активность крови увеличивается также при паротите (воспалении слюнных желез). Амилаза имеет небольшую молекулярную массу – 45 000, поэтому легко проходит почечный фильтр и попадает в мочу. В связи с меньшей инвазивностью определение амилазной активности мочи (диастазный тест) широко используется в клинике для диагностики состояния поджелудочной железы (см. УИРС).
Принцип метода. Метод основан на том, что слюну разводят в определенной последовательности, после чего приливают одно и тоже количество раствора крахмала и находят наименьшее содержание фермента, которое полностью расщепляет все количество добавленного крахмала. Затем производят перерасчет активности фермента на 1 мл слюны.
Амилазная активность слюны или амилокластичекая сила слюны выражается количеством 0,1% раствора крахмала в мл, которое может расщепляться 1 мл слюны при температуре 380 в течении 30 мин.
В норме амилазная активность слюны составляет 160-320 ед.
Расчет. Берется количество слюны в последней пробирке с желтой окраской. Если это четвертая пробирка, то разведение слюны в ней – 160 раз. Составляется пропорция: 1). 160 мл слюны расщепляет 2 мл 0,1% р-ра крахмала; 2) 1 мл слюны расщепляет Х мл 0,1% р-ра крахмала, т.е. амилокластическая активность слюны составляет 320 ед.
3. Определение содержания пировиноградной кислоты в крови.
Техника выполнения работы.
Определение АсАТ.
Одновременно готовят опытную и контрольную пробы.
Опытная проба. В пробирку вносят 0,5 мл субстратного раствора, добавляют 0,1 мл сыворотки, помещают в термостат при температуре 37° С на 1 час. Затем добавляют 0,5 мл раствора динитрофенилгидразина и выдерживают при комнатной температуре 20 мин для развития реакции. Затем приливают 5 мл 0,4 н NaOH, тщательно перемешивают и оставляют при комнатной температуре на 10 мин для развития окраски. Оптическую плотность измеряют на ФЭКе с зеленым светофильтром в кювете на 10 мм против контроля.
Контрольная проба. Содержит все ингредиенты опытной пробы за исключением сыворотки крови. Вместо нее берут 0,1 мл дистиллированной воды и инкубируют в тех же условиях, что и опытную.
Определение АлАТ.
Одновременно готовят опытную и контрольную пробы.
В опытную пробирку вносят 0,5 мл субстратного раствора для определения АлАТ, затем добавляют 0,1 мл испытуемой сыворотки и помещают в термостат при температуре 37° С на 30 мин. Дальнейший ход анализа такой же, как при определении АсАТ.
В контрольную пробирку вместо сыворотки крови берут 0,1 мл дистиллированной воды.
Расчет активности ферментов производят по калибровочному графику, отражающему зависимость оптической плотности от содержания ПВК.
9. Количественное определение остаточного азота крови.
Принцип определения: в результате сжигания безбелкового фильтрата крови азот низкомолекулярных азотистых соединений переходит в состав иона NH4. Количество азота устанавливается по количеству кислоты, необходимой для связывания образовавшегося аммония.
В норме азот остаточный составляет 20— 40 мг%. Увеличение содержания азота остаточного в крови наступает при нарушении функции почек, печени, при усиленном распаде тканей (гангрена, туберкулез, злокачественные опухоли).
10. Количественное определение мочевины в сыворотке крови и моче. Количественное определение мочевины в моче по Рашковану.
Принцип метода. Основан на том, что мочевина с гипохлоритом натрия и фенолом образует продукт зеленого окрашивания.
Принцип в крови
Мочевина под действием уреазы разлагается на углекислый газ и аммиак, который в щелочной среде с гипохлоритом натрия и фенолом образует индофенол синего цвета (метод Бертло). Светопоглощение образовавшегося продукта пропорционально содержанию мочевины в образце.
11. Количественное определение креатинина в сыворотке крови и моче.
Проба Яффе на уробилин.
К 2 мл мочи прибавить небольшую порцию раствора хлористого цинка. При встряхивании появляется хлопьевидный осадок, который растворить в концентрированном растворе аммиака (около 1мл). В норме появляется слабо-зеленая флюоресценция, ярко выраженная при патологии.
Разделение и количественное определение белковых
Дата: 2019-05-28, просмотров: 298.