Ответ. Гликопротеины – сложные белки, содержащие, помимо простого белка или пептида, группу гетероолигосахаридов. В настоящее время их принято называть гликоконъюгатами. В состав гликоконъюгата входит углеводный компонент (гликановая фракция), ковалентно связанный с неуглеводной частью (агликановая фракция), представленной белком, пептидом, аминокислотой или липидом.
Повышенный интерес к науке об углеводах – гликобиологии – в настоящее время объясняется открытием существенной роли изменений структуры гликоконъюгатов в развитии таких болезней, как рак, иммунодефицит человека, ревматоидные артриты, астма и др. Оказалось, что нарушение реакции гликозилирования двух главных классов глико-конъюгатов (гликопротеинов и ганглиозидов) приводит или к накоплению предшественников этих веществ, или к синтезу «укороченных» сахарных цепей гликоконъюгатов. Более того, установлено, что во взаимодействии между некоторыми вирусами и клетками-мишенями главную роль играют углеводные компоненты. В частности, гликопротеин gp120 вируса иммунодефицита человека (содержит большой процент углевода) имеет высокое сродство к гликопротеину CD4Т-лимфоцита. В этом взаимодействии, узнавании, являющемся высокоспецифичным, гликозилированные фрагменты, вероятнее всего, играют важную патогенетическую роль. Известно также, что при ревматоидных артритах часто синтезируются аномальные антитела (аномальные иммуноглобулины – все гликопротеины) с необычайно короткими сахарными цепями, что вызывает стимуляцию иммунной системы против самого организма. Из этих примеров видно, что, помимо гликобиологии, наступило время признания и таких наук, как гликопа-тология и гликотерапия.
Помимо гликопротеинов, различают также протеогликаны, состоящие из белка и гликозаминогликанов (прежнее название мукополиса-хариды); последние состоят из цепей сложных углеводов: аминосахаров, уроновых кислот, серной кислоты и отдельных моносахаридов. Типичными гликозаминогликанами являются гиалуроновая кислота, хондроитинсерная кислота и гепарин.
К типичным гликопротеинам относят большинство белковых гормонов, секретируемые в жидкие среды организма вещества, мембранные сложные белки, все антитела (иммуноглобулины), белки плазмы крови, молока, овальбумин, интерфероны, факторы комплемента, группы крови, рецеп-торные белки и др. Из этого далеко не полного перечня гликопротеинов видно, что все они выполняют специфические функции: обеспечивают клеточную адгезию, молекулярное и клеточное узнавание, антигенную активность опухолевых клеток, оказывают защитное и гормональное, а также антивирусное действие.
Химический состав гликопротеинов более или менее установлен, структура определена только у ряда из них. К полипептиду присоединяются гетероолигосахаридные цепи, содержащие от 2 до 10, реже 15 мономерных остатков гексоз (галактоза и манноза, реже глюкоза), пентоз (ксилоза, арабиноза) и конечный углевод, чаще всего представленный N-ацетилга-лактозамином, L-фукозой или сиаловой кислотой; в отличие от про-теогликанов гликопротеины не содержат уроновых кислот и серной кислоты.
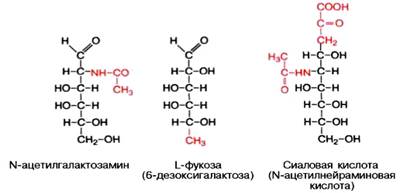
Типы связей между углеводными компонентами и белками определены только у ряда гликопротеинов, аминокислотный состав и структура которых известны (иммуноглобулины, гормоны); они включают О-гликозидные связи (с ОН-группами серина, треонина и оксилизина), N-гликозидные связи (с амидными группами аспарагина, реже глутамина или ω-NH2-группами лизина и аргинина) и эфирные гликозидные связи со свободными СООН-группами глутаминовой и аспарагиновой кислот.
Синтез гликопротеинов осуществляется в рибосомах эндоплазматиче-ского ретикулума (в цистронах), затем присоединяются сахарные цепи (постсинтетическое гликозилирование), и далее белок транспортируется до биомембран клетки и включается в состав мембранных белков или секре-тируется.
Углеводные компоненты соединены ковалентно с азотом аспарагина молекулы белка. Однако предварительно олигосахаридная часть соединяется с липидным переносчиком – долихолфосфатом (липид, содержащий от 15 до 20 изопреновых остатков) и переносится на полипептидную цепь в эндоплазматическом ретикулуме, при этом транспортер освобождается:
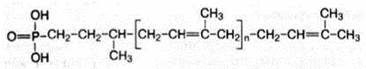
Долихолфосфат (n = 15-30)
Синтезированные гликопротеины далее переносятся в аппарат Гольджи, где осуществляются окончательное гликозилирование и сортировка по назначению.
Структура одного из нескольких гетероолигосахаридных остатков в молекуле гликопротеинов, в частности иммуноглобулинов, может быть представлена в виде следующей схемы (использованы сокращения: Глю – глюкоза, NАцГлюА – N-ацетилглюкозамин; Гал – галактоза; Ман – манно-за; NАцНейр – N-ацетилнейраминовая кислота):
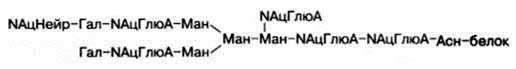
Рассмотрим известные к настоящему времени данные о синтезе, строении (структуре) и свойствах ряда гликопротеинов.
Интерфероны. Интерфероны – это ингибиторы размножения многих типов вирусов. Открыто несколько типов интерферонов (α, β и γ), некоторые из них получены методами генетической инженерии. Это сравнительно небольшие сложные белки с мол. массой у разных видов животных и человека от 25000 до 38000–40000). Они образуются в клетке в ответ на внедрение вирусной нуклеиновой кислоты, ограничивая вирусную агрессию (инфекцию). Известно также, что группа видоспецифических α-интерфе-ронов синтезируется макрофагами, в то время как γ-интерферон продуцируется Т-клетками и стимулируется интерлейкином-2. Показано также, что γ-интерферон в свою очередь повышает цитотоксическую активность макрофагов, Т-клеток и естественных клеток-киллеров. Интерфероны наделены антипролиферативной активностью и считаются основными защитными белками не только против вирусной инфекции, но и при опухолевых поражениях.
Следует отметить, однако, что до сих пор не раскрыты молекулярные механизмы, при помощи которых интерфероны тормозят размножение вирусов. Известно только, что интерфероны ингибируют биосинтез всех белков (и хозяйских, и вирусных), вероятнее всего, на уровне процесса трансляции. Возможно, что интерферон индуцирует синтез особого белка-ингибитора, который затем связывается с рибосомами и блокирует трансляцию, или интерферон переводит один из активных эукариотических белковых факторов инициации в неактивный фактор путем фосфорилиро-вания.
Иммуноглобулины. Иммуноглобулины, или антитела, также относятся к классу гликопротеинов, выполняют защитную функцию, обезвреживая поступающие в организм чужеродные вещества – антигены любой химической природы. Синтезируются иммуноглобулины плазматическими клетками, образовавшимися из лимфоцитов. Учение об иммунитете оформилось в самостоятельную науку – иммунологию, изучающую структуру и функции антител вообще и иммуноглобулинов в частности. Мы представим современные сведения о некоторых физико-химических свойствах и структуре иммуноглобулинов человека (табл. 2.4). Различают 5 классов иммуноглобулинов: IgG, IgM, IgA, IgD и IgE. Детально изучены структура и функция IgG.
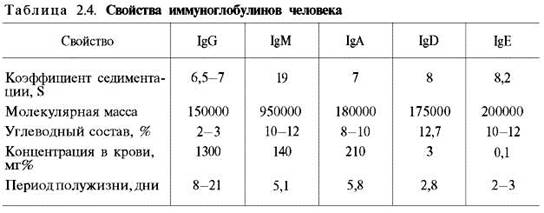
Разные классы иммуноглобулинов сильно различаются не только по молекулярной массе, но и по концентрации в крови; имеются данные, что различаются они и по биологическим свойствам.
Подробно изучена структура IgG. Он имеет Y-образную форму и тет-рамерное строение; состоит из двух идентичных легких L-цепей (от англ. light) и двух идентичных тяжелых Н-цепей (от англ. heavy) с мол. массой 23000–24000 и 50000–70000 соответственно. Известно также, что каждая из этих цепей имеет 2 типа доменов – вариабельные (V) участки, состоящие из 108 аминокислотных остатков, и константные (С) участки, состоящие из 110 и 350 аминокислотных остатков соответственно в L- и Н-цепях (рис. 2).
Из других гликопротеинов, выполняющих ряд важнейших биологических функций, следует отметить все белки плазмы крови (за исключением альбуминов), трансферрин, церулоплазмин, гонадотропный и фолликуло-стимулирующие гормоны, некоторые ферменты, а также гликопротеины в составе слюны (муцин), хрящевой и костной тканей и яичного белка (овомукоид). Углеводные компоненты, помимо информативной функции, значительно повышают стабильность молекул, в состав которых они входят, к различного рода химическим, физическим воздействиям и предохраняют их от действия протеиназ, определяя тем самым биологическую роль гликопротеинов. Являясь составной частью клеточной мембраны, гликопротеины участвуют, кроме того, в иммунологических реакциях, ионном обмене, процессах межклеточной адгезии и т.д.
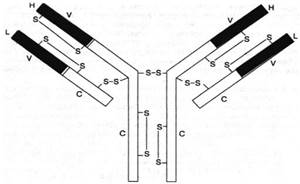
Рис. 2. Структура IgG человека. Показаны легкие (L) и тяжелые (Н) цепи, дисульфидные связи и вариабельные V (красные) и константные С (светлые) участки.
Дата: 2019-05-28, просмотров: 336.