СОДЕРЖАНИЕ
Вопрос 10. Приведите примеры биологически активных пептидов. Какие функции они выполняют?
Вопрос 20. Как связана простетическая группа фосфопротеинов с белковым компонентом. Показать ее на примере аминокислот серина и треонина
Вопрос 30. Энзинопатологии (фенилкетонурия, альбинизм и алкаптонурия)
Вопрос 40. Назвать коферментные формы витаминов биотина и В12, указать в каких обменных процессах они участвуют
Вопрос 46. Напишите формулу сиаловой кислоты. Охарактеризуйте расположением гликопротеинов в биомембране. Какую функцию они выполняют?
Вопрос 50. Написать реакцию НАД-зависимого дгидрирования малата в цикле КРЕБСА
Вопрос 52. Что такое окислительное фосфорелирование? Указать участки сопряжения окисления и фосфорелирования в цепях переноса электронов
Вопрос 64. Напишите фрагменты молекул клетчатки, крахмала. Укажите какой углевод не переваривается в ЖКТ человека и почему?
Вопрос 75. Написать в виде схемы реакции синтеза гликогена
Вопрос 84. Какие вещества необходимы для синтеза жирных кислот на синтаве жирных кислот. Как связан процесс синтеза жирных кислот с обменом углеводов?
Вопрос 88. Какими липопротеинами крови доставляются жиры из печени и кишечника к жировым депо? Каков состав этих липопротеинов?
Вопрос 96. В состав пищи входили пептиды следующего состава: ала-сер-гли-дис -сен-лиз-три-вал-лей. Назовите ферменты и соответствующие связи, которые они расщепляют: а) в желудке, б) в просвете тонкой кишки,
в) в слизистой оболочке тонкой кишки
Вопрос 106. Декарбоксилирование аминокислот. Строение кофермента
декарбоксилаз. Биологическая роль образовавшихся соединений
Вопрос 108. Напишите орнитиновый цикл мочевинообразования. Укажите локализацию процесса
Вопрос 121. Через какие активные соединения клетки гормоны реализуют свое действие?.
Вопрос 126. Охарактеризуйте механизм действия адреналина и глюкагона на липидный обмен
Вопрос 130. Клинико-диагностическое значение определения активности амилазы сыворотки крови и мочи
Вопрос 133. Нарушение прямого и соотношения непрямого билирубина при желтухах. Охарактеризуйте гемолитическую, паренсиматозную и обтурационную желтухи
Вопрос 134. С какими свойствами белков плазмы крови связана их
способность регулировать объем крови и ее онкотическое давление? Какая белковая фракция играет наиболее существенную роль в обеспечении этой функции?
Вопрос 143. Приведите схему строения антител. Обозначьте на схеме участки взаимодействия с антигеном
Список используемой литературы
Вопрос 10. Приведите примеры биологически активных пептидов. Какие функции они выполняют?
Ответ. В последние годы значительно повысился интерес к структуре и функциям встречающихся в свободном состоянии в организме низкомолекулярных пептидов, выполняющих ряд специфических биологических функций. Короткие пептиды, содержащие до 10 аминокислот, принято называть олигопептидами; в то же время полипептиды и белки считаются взаимозаменяемыми, хотя термином «полипептиды» чаще обозначают продукты с мол. м. менее 10000. В некоторых биоактивных пептидах имеются необычные аминокислоты, не встречающиеся в природных белках, или производные обычных аминокислот (гормоны, антибиотики). Мнение о том, что пептиды могут играть роль промежуточных продуктов на пути синтеза белка, не подтвердилось, поскольку этот процесс во всех клетках у всех живых организмов осуществляется de novo матричным путем.
Природные пептиды, наделенные биологической активностью, в зависимости от характера действия и происхождения принято делить на 4 группы: 1) пептиды, обладающие гормональной активностью (вазопрессин, окси-тоцин, кортикотропин, глюкагон, кальцитонин, меланоцитстимулирующий гормон, рилизинг-факторы гипоталамуса и др.; 2) пептиды, принимающие участие в процессе пищеварения (в частности, гастрин и секретин); 3) пептиды, источник которых – α2-глобулиновая фракция сыворотки крови (такие, как ангиотензин, брадикинин и каллидин); 4) нейропептиды.
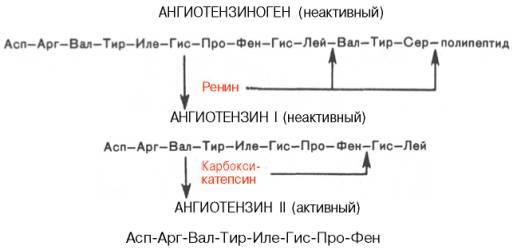
В последнее время выяснены некоторые закономерности синтеза физиологически активных пептидов из биологически инертных предшественников – белков в результате процесса, называемого посттрансляционной модификацией (постсинтетические превращения белковой молекулы). Известно, например, что ангиотензины (представленные октапептидами), оказывающие выраженное сосудосуживающее действие, образуются из присутствующего в сыворотке крови неактивного белка ангиотензиногена в результате последовательного действия ряда протеолитических ферментов (ренина и особого фермента, участвующего в превращении неактивного ангиотензина I в активный ангиотензин II).
К группе вазоактивных (оказывающих влияние на тонус сосудов) пептидов относятся, кроме того, широко применяемые в медицинской практике брадикинин и каллидин.
Брадикинин представляет собой нонапептид:
H–Apг–Про–Про–Гли–Фен–Сер–Про–Фен–Apг–ОН.
Каллидин представлен декапептидом, образующимся из неактивного плазменного белка кининогена, и отличается от брадикинина присутствием на N-конце еще одного аминокислотного остатка (Лиз):
Н–Лиз–Арг–Про–Про–Гли–Фен–Сер–Про–Фен–Apг–ОН.
Совсем недавно из экстрактов ткани предсердия (но не из желудочков сердца) человека и животных были выделены биологически активные пептиды, регулирующие тонус сосудистой системы и электролитный обмен. Физиологический эффект их оказался противоположным влиянию системы ренин–ангиотензин–альдостерон. Он выражается в сосудорасширяющем действии, усилении клубочковой фильтрации и стимуляции выведения натрия и хлоридов за счет угнетения их реабсорбции в канальцах. Эти пептиды получили название а триопептидов (от лат. atrio – предсердие). Они построены из разного числа аминокислот (от 23 до 100), но обязательным условием для проявления биологического эффекта является наличие в молекуле 17-членной кольцевой структуры, образующейся за счет дисуль-фидной связи между остатками цистеина.
Внутриклеточным посредником действия атриопептидов оказался циклический гуанозинмонофосфат (цГМФ), синтез которого осуществляется в результате активирования мембранного фермента гуанилатциклазы; действие аденилатциклазы, напротив, тормозится под влиянием атриопеп-тидов.
Во всех животных тканях и в некоторых растениях широко распространен низкомолекулярный трипептид глутатион, функции которого пока не выяснены достаточно полно, хотя он открыт сравнительно давно. Глута-тион представляет собой атипичный трипептид (в котором в образовании одной из пептидных связей участвует не α-карбоксильная, а γ-карбок-сильная группа глутамата) следующего строения: γ-глутамил-цистеинил-глицин:
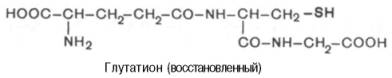
Цистеин является составной частью глутатиона, поэтому последний может находиться в восстановленной (SH) и в окисленной (S-S) формах (сокращенно обозначаются Г-SH и Г-S-S-Г), что, по-видимому, имеет отношение к биологической роли глутатиона в организме.
Интерес к природным пептидам в значительной степени обусловлен необычно высокой их биологической активностью. Они оказывают мощное фармакологическое действие на множество физиологических функций организма. В то же время были замечены низкая стабильность и быстрый распад их в организме при физиологических значениях рН среды. Все это способствовало развитию исследований как в области препаративного выделения природных пептидов из органов и тканей (включая получение биологически активных пептидов из предшественников методами ограниченного протеолиза ряда хорошо известных гормонов), так и в области химического синтеза. Получение ряда биологически активных нейропепти-дов из гормонов гипофиза, в частности эндорфинов и энкефалинов, наделенных мощным обезболивающим действием (путем связывания рецепторов определенных клеток мозга), в сотни и тысячи раз превосходящим аналгезирующий эффект морфина.
Из ткани мозга выделен также δ-пептид сна; ряд других нейропептидов принимает участие в биохимических механизмах памяти, страха, обучения и т.д. Для повышения стабильности пептидов при введении в организм предприняты попытки химического синтеза пептидов, в которых один или несколько аминокислотных остатков L-ряда замещают остатками D-аминокислот. Подобная замена, не вызывая снижения биоактивности, защищает пептид от воздействия протеиназ тканей, способствуя пролонгированию эффекта препарата.
Среди естественно встречающихся небольших пептидов следует указать на антибиотик грамицидин S, выделенный из Bacillus brevis и представляющий собой циклический декапептид:
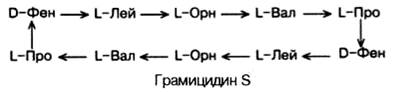
Как видно, в структуре грамицидина S имеются 2 остатка орнитина (Орн), производные аминокислоты аргинина и 2 остатка неприродных D-изомеров фенилаланина. Стрелки указывают направление синтеза от NН2-групп к СООН-группам каждого остатка, и вследствие цикличности грамицидин S не имеет конца.
Широкое применение, особенно в пищевой промышленности, в качестве заменителя сахара получил искусственный (генноинженерный синтез) ди-пептид, состоящий из L-изомеров аспарагиновой кислоты и метилового эфира фенилаланина, названный аспартамом:
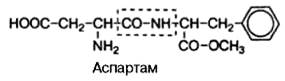
Аспартам в сотни раз слаще сахара и легко распадается в организме на две свободные аминокислоты, абсолютно безвредные для организма; поэтому он рекомендован в качестве заменителя сахара больным диабетом. Это пример пептида, наделенного огромным биологическим эффектом.
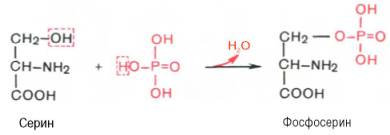
Вопрос 20. Как связана простетическая группа фосфопротеинов с белковым компонентом. Показать ее на примере аминокислот серина и треонина
Ответ. К белкам этого класса относятся казеиноген молока, в котором содержание фосфорной кислоты достигает 1%; вителлин, вителлинин и фосвитин, выделенные из желтка куриного яйца; овальбумин, открытый в белке куриного яйца; ихтулин, содержащийся в икре рыб, и др. Большое количество фосфопротеинов содержится в клетках ЦНС. Фосфопротеины занимают особое положение в биохимии фосфорсодержащих соединений не только в результате своеобразия структурной организации, но и вследствие широкого диапазона функций в метаболизме. Характерной особенностью структуры фосфопротеинов является то, что фосфорная кислота оказывается связанной сложноэфирной связью с белковой молекулой через гидроксильные группы β-оксиаминокислот, главным образом серина и в меньшей степени треонина. На одну молекулу белка обычно приходится 2–4 остатка фосфата.
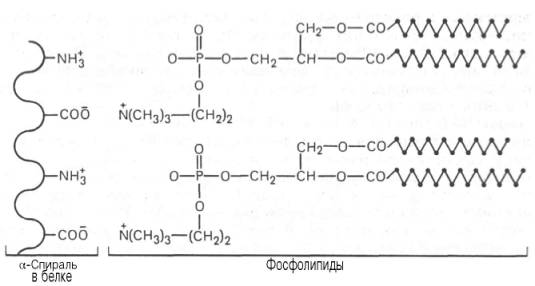
Рис. 1. Ионный тип связи между белками и фосфолипидами.
Новые данные свидетельствуют о том, что в клетках фосфопротеины синтезируются в результате посттрансляционной модификации, подвергаясь фосфорилированию при участии протеинкиназ. Таким образом, уровень фосфопротеинов в клетке зависит в значительной степени от регулирующего действия ферментов, катализирующих фосфорилирование (протеин-киназы) и дефосфорилирование (протеинфосфатазы). Следует отметить, что фосфопротеины содержат органически связанный, лабильный фосфат, абсолютно необходимый для выполнения клеткой ряда биологических функций. Кроме того, они являются ценным источником энергетического и пластического материала в процессе эмбриогенеза и дальнейшего постна-тального роста и развития организма.
Особо следует отметить, что некоторые ключевые ферменты, регулирующие процессы внутриклеточного обмена веществ, также существуют как в фосфорилированной, так и в дефосфорилированной форме. Этим подчеркивается значение фосфорилирования–дефосфорилирования в процессах химической модификации макромолекул, участвующих в интегральных процессах метаболизма.
Вопрос 134. С какими свойствами белков плазмы крови связана их способность регулировать объем крови и ее онкотическое давление? Какая белковая фракция играет наиболее существенную роль в обеспечении этой функции?
Ответ. Из 9–10% сухого остатка плазмы крови на долю белков приходится 6,5–8,5%. Используя метод высаливания нейтральными солями, белки плазмы крови можно разделить на три группы: альбумины, глобулины и фибриноген. Нормальное содержание альбуминов в плазме крови составляет 40–50 г/л, глобулинов – 20–30 г/л, фибриногена – 2,4 г/л. Плазма крови, лишенная фибриногена, называется сывороткой.
Синтез белков плазмы крови осуществляется преимущественно в клетках печени и ретикулоэндотелиальной системы. Физиологическая роль белков плазмы крови многогранна.
1. Белки поддерживают коллоидно-осмотическое (онкотическое) давление и тем самым постоянный объем крови. Содержание белков в плазме значительно выше, чем в тканевой жидкости. Белки, являясь коллоидами, связывают воду и задерживают ее, не позволяя выходить из кровяного русла. Несмотря на то что онкотическое давление составляет лишь небольшую часть (около 0,5%) от общего осмотического давления, именно оно обусловливает преобладание осмотического давления крови над осмотическим давлением тканевой жидкости. Известно, что в артериальной части капилляров в результате гидростатического давления безбелковая жидкость крови проникает в тканевое пространство. Это происходит до определенного момента – «поворотного», когда падающее гидростатическое давление становится равным коллоидно-осмотическому. После «поворотного» момента в венозной части капилляров происходит обратный ток жидкости из ткани, так как гидростатическое давление стало меньше, чем коллоидно-осмотическое. При иных условиях в результате гидростатического давления в кровеносной системе вода просачивалась бы в ткани, что вызвало бы отек различных органов и подкожной клетчатки.
2. Белки плазмы принимают активное участие в свертывании крови. Ряд белков, в том числе фибриноген, являются основными компонентами системы свертывания крови.
3. Белки плазмы в известной мере определяют вязкость крови, которая, как отмечалось, в 4–5 раз выше вязкости воды и играет важную роль в поддержании гемодинамических отношений в кровеносной системе.
4. Белки плазмы принимают участие в поддержании постоянного рН крови, так как составляют одну из важнейших буферных систем крови.
5. Важна также транспортная функция белков плазмы крови: соединяясь с рядом веществ (холестерин, билирубин и др.), а также с лекарственными средствами (пенициллин, салицилаты и др.), они переносят их к тканям.
6. Белки плазмы играют важную роль в процессах иммунитета (особенно это касается иммуноглобулинов).
7. В результате образования с белками плазмы недиализируемых комплексов поддерживается уровень катионов в крови. Например, 40–50% кальция сыворотки связано с белками, значительная часть железа, магния, меди и других элементов также связана с белками сыворотки.
8. Наконец, белки плазмы крови могут служить резервом аминокислот. Современные физико-химические методы позволили открыть и описать около 100 различных белковых компонентов плазмы крови. Особое значение приобрело электрофоретическое разделение белков плазмы (сыворотки) крови.
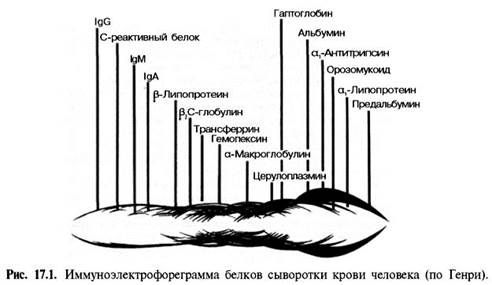
В сыворотке крови здорового человека при электрофорезе на бумаге можно обнаружить 5 фракций: альбумины, α1-, α2-, β-, γ-глобулины. Методом электрофореза в агаровом геле в сыворотке крови выделяют 7– 8 фракций, а при электрофорезе в крахмальном или полиакриламидном геле – до 16–17 фракций. Следует помнить, что терминология белковых фракций, получаемых при различных видах электрофореза, еще окончательно не установилась. При изменении условий электрофореза, а также при электрофорезе в различных средах (например, в крахмальном или полиак-риламидном геле) скорость миграции и, следовательно, порядок белковых зон могут меняться.
Еще большее число белковых фракций (свыше 30) можно получить методом иммуноэлектрофореза (рис. 17.1). Этот метод представляет собой своеобразную комбинацию электрофоретического и иммунологического методов анализа белков. Иными словами, термин «иммуноэлектрофорез» подразумевает проведение электрофореза и реакции преципитации в одной среде, т.е. непосредственно на гелевом блоке. При данном методе с помощью серологической реакции преципитации достигается значительное повышение аналитической чувстительности электрофоретического метода.
Список используемой литературы
1. Березов Т.Т., Коровкин Б.Ф. «Биологическая химия». М., 2003
2. Комов Б.В. «Биохимия. Учебник для ВУЗов». М., 2004
3. Филиппович Ю.Б. «Биохимия». М., 2003
СОДЕРЖАНИЕ
Вопрос 10. Приведите примеры биологически активных пептидов. Какие функции они выполняют?
Вопрос 20. Как связана простетическая группа фосфопротеинов с белковым компонентом. Показать ее на примере аминокислот серина и треонина
Вопрос 30. Энзинопатологии (фенилкетонурия, альбинизм и алкаптонурия)
Вопрос 40. Назвать коферментные формы витаминов биотина и В12, указать в каких обменных процессах они участвуют
Вопрос 46. Напишите формулу сиаловой кислоты. Охарактеризуйте расположением гликопротеинов в биомембране. Какую функцию они выполняют?
Вопрос 50. Написать реакцию НАД-зависимого дгидрирования малата в цикле КРЕБСА
Вопрос 52. Что такое окислительное фосфорелирование? Указать участки сопряжения окисления и фосфорелирования в цепях переноса электронов
Вопрос 64. Напишите фрагменты молекул клетчатки, крахмала. Укажите какой углевод не переваривается в ЖКТ человека и почему?
Вопрос 75. Написать в виде схемы реакции синтеза гликогена
Вопрос 84. Какие вещества необходимы для синтеза жирных кислот на синтаве жирных кислот. Как связан процесс синтеза жирных кислот с обменом углеводов?
Вопрос 88. Какими липопротеинами крови доставляются жиры из печени и кишечника к жировым депо? Каков состав этих липопротеинов?
Вопрос 96. В состав пищи входили пептиды следующего состава: ала-сер-гли-дис -сен-лиз-три-вал-лей. Назовите ферменты и соответствующие связи, которые они расщепляют: а) в желудке, б) в просвете тонкой кишки,
в) в слизистой оболочке тонкой кишки
Вопрос 106. Декарбоксилирование аминокислот. Строение кофермента
декарбоксилаз. Биологическая роль образовавшихся соединений
Вопрос 108. Напишите орнитиновый цикл мочевинообразования. Укажите локализацию процесса
Вопрос 121. Через какие активные соединения клетки гормоны реализуют свое действие?.
Вопрос 126. Охарактеризуйте механизм действия адреналина и глюкагона на липидный обмен
Вопрос 130. Клинико-диагностическое значение определения активности амилазы сыворотки крови и мочи
Вопрос 133. Нарушение прямого и соотношения непрямого билирубина при желтухах. Охарактеризуйте гемолитическую, паренсиматозную и обтурационную желтухи
Вопрос 134. С какими свойствами белков плазмы крови связана их
способность регулировать объем крови и ее онкотическое давление? Какая белковая фракция играет наиболее существенную роль в обеспечении этой функции?
Вопрос 143. Приведите схему строения антител. Обозначьте на схеме участки взаимодействия с антигеном
Список используемой литературы
Вопрос 10. Приведите примеры биологически активных пептидов. Какие функции они выполняют?
Ответ. В последние годы значительно повысился интерес к структуре и функциям встречающихся в свободном состоянии в организме низкомолекулярных пептидов, выполняющих ряд специфических биологических функций. Короткие пептиды, содержащие до 10 аминокислот, принято называть олигопептидами; в то же время полипептиды и белки считаются взаимозаменяемыми, хотя термином «полипептиды» чаще обозначают продукты с мол. м. менее 10000. В некоторых биоактивных пептидах имеются необычные аминокислоты, не встречающиеся в природных белках, или производные обычных аминокислот (гормоны, антибиотики). Мнение о том, что пептиды могут играть роль промежуточных продуктов на пути синтеза белка, не подтвердилось, поскольку этот процесс во всех клетках у всех живых организмов осуществляется de novo матричным путем.
Природные пептиды, наделенные биологической активностью, в зависимости от характера действия и происхождения принято делить на 4 группы: 1) пептиды, обладающие гормональной активностью (вазопрессин, окси-тоцин, кортикотропин, глюкагон, кальцитонин, меланоцитстимулирующий гормон, рилизинг-факторы гипоталамуса и др.; 2) пептиды, принимающие участие в процессе пищеварения (в частности, гастрин и секретин); 3) пептиды, источник которых – α2-глобулиновая фракция сыворотки крови (такие, как ангиотензин, брадикинин и каллидин); 4) нейропептиды.
В последнее время выяснены некоторые закономерности синтеза физиологически активных пептидов из биологически инертных предшественников – белков в результате процесса, называемого посттрансляционной модификацией (постсинтетические превращения белковой молекулы). Известно, например, что ангиотензины (представленные октапептидами), оказывающие выраженное сосудосуживающее действие, образуются из присутствующего в сыворотке крови неактивного белка ангиотензиногена в результате последовательного действия ряда протеолитических ферментов (ренина и особого фермента, участвующего в превращении неактивного ангиотензина I в активный ангиотензин II).

К группе вазоактивных (оказывающих влияние на тонус сосудов) пептидов относятся, кроме того, широко применяемые в медицинской практике брадикинин и каллидин.
Брадикинин представляет собой нонапептид:
H–Apг–Про–Про–Гли–Фен–Сер–Про–Фен–Apг–ОН.
Каллидин представлен декапептидом, образующимся из неактивного плазменного белка кининогена, и отличается от брадикинина присутствием на N-конце еще одного аминокислотного остатка (Лиз):
Н–Лиз–Арг–Про–Про–Гли–Фен–Сер–Про–Фен–Apг–ОН.
Совсем недавно из экстрактов ткани предсердия (но не из желудочков сердца) человека и животных были выделены биологически активные пептиды, регулирующие тонус сосудистой системы и электролитный обмен. Физиологический эффект их оказался противоположным влиянию системы ренин–ангиотензин–альдостерон. Он выражается в сосудорасширяющем действии, усилении клубочковой фильтрации и стимуляции выведения натрия и хлоридов за счет угнетения их реабсорбции в канальцах. Эти пептиды получили название а триопептидов (от лат. atrio – предсердие). Они построены из разного числа аминокислот (от 23 до 100), но обязательным условием для проявления биологического эффекта является наличие в молекуле 17-членной кольцевой структуры, образующейся за счет дисуль-фидной связи между остатками цистеина.
Внутриклеточным посредником действия атриопептидов оказался циклический гуанозинмонофосфат (цГМФ), синтез которого осуществляется в результате активирования мембранного фермента гуанилатциклазы; действие аденилатциклазы, напротив, тормозится под влиянием атриопеп-тидов.
Во всех животных тканях и в некоторых растениях широко распространен низкомолекулярный трипептид глутатион, функции которого пока не выяснены достаточно полно, хотя он открыт сравнительно давно. Глута-тион представляет собой атипичный трипептид (в котором в образовании одной из пептидных связей участвует не α-карбоксильная, а γ-карбок-сильная группа глутамата) следующего строения: γ-глутамил-цистеинил-глицин:

Цистеин является составной частью глутатиона, поэтому последний может находиться в восстановленной (SH) и в окисленной (S-S) формах (сокращенно обозначаются Г-SH и Г-S-S-Г), что, по-видимому, имеет отношение к биологической роли глутатиона в организме.
Интерес к природным пептидам в значительной степени обусловлен необычно высокой их биологической активностью. Они оказывают мощное фармакологическое действие на множество физиологических функций организма. В то же время были замечены низкая стабильность и быстрый распад их в организме при физиологических значениях рН среды. Все это способствовало развитию исследований как в области препаративного выделения природных пептидов из органов и тканей (включая получение биологически активных пептидов из предшественников методами ограниченного протеолиза ряда хорошо известных гормонов), так и в области химического синтеза. Получение ряда биологически активных нейропепти-дов из гормонов гипофиза, в частности эндорфинов и энкефалинов, наделенных мощным обезболивающим действием (путем связывания рецепторов определенных клеток мозга), в сотни и тысячи раз превосходящим аналгезирующий эффект морфина.
Из ткани мозга выделен также δ-пептид сна; ряд других нейропептидов принимает участие в биохимических механизмах памяти, страха, обучения и т.д. Для повышения стабильности пептидов при введении в организм предприняты попытки химического синтеза пептидов, в которых один или несколько аминокислотных остатков L-ряда замещают остатками D-аминокислот. Подобная замена, не вызывая снижения биоактивности, защищает пептид от воздействия протеиназ тканей, способствуя пролонгированию эффекта препарата.
Среди естественно встречающихся небольших пептидов следует указать на антибиотик грамицидин S, выделенный из Bacillus brevis и представляющий собой циклический декапептид:

Как видно, в структуре грамицидина S имеются 2 остатка орнитина (Орн), производные аминокислоты аргинина и 2 остатка неприродных D-изомеров фенилаланина. Стрелки указывают направление синтеза от NН2-групп к СООН-группам каждого остатка, и вследствие цикличности грамицидин S не имеет конца.
Широкое применение, особенно в пищевой промышленности, в качестве заменителя сахара получил искусственный (генноинженерный синтез) ди-пептид, состоящий из L-изомеров аспарагиновой кислоты и метилового эфира фенилаланина, названный аспартамом:

Аспартам в сотни раз слаще сахара и легко распадается в организме на две свободные аминокислоты, абсолютно безвредные для организма; поэтому он рекомендован в качестве заменителя сахара больным диабетом. Это пример пептида, наделенного огромным биологическим эффектом.
Вопрос 20. Как связана простетическая группа фосфопротеинов с белковым компонентом. Показать ее на примере аминокислот серина и треонина
Ответ. К белкам этого класса относятся казеиноген молока, в котором содержание фосфорной кислоты достигает 1%; вителлин, вителлинин и фосвитин, выделенные из желтка куриного яйца; овальбумин, открытый в белке куриного яйца; ихтулин, содержащийся в икре рыб, и др. Большое количество фосфопротеинов содержится в клетках ЦНС. Фосфопротеины занимают особое положение в биохимии фосфорсодержащих соединений не только в результате своеобразия структурной организации, но и вследствие широкого диапазона функций в метаболизме. Характерной особенностью структуры фосфопротеинов является то, что фосфорная кислота оказывается связанной сложноэфирной связью с белковой молекулой через гидроксильные группы β-оксиаминокислот, главным образом серина и в меньшей степени треонина. На одну молекулу белка обычно приходится 2–4 остатка фосфата.

Рис. 1. Ионный тип связи между белками и фосфолипидами.

Новые данные свидетельствуют о том, что в клетках фосфопротеины синтезируются в результате посттрансляционной модификации, подвергаясь фосфорилированию при участии протеинкиназ. Таким образом, уровень фосфопротеинов в клетке зависит в значительной степени от регулирующего действия ферментов, катализирующих фосфорилирование (протеин-киназы) и дефосфорилирование (протеинфосфатазы). Следует отметить, что фосфопротеины содержат органически связанный, лабильный фосфат, абсолютно необходимый для выполнения клеткой ряда биологических функций. Кроме того, они являются ценным источником энергетического и пластического материала в процессе эмбриогенеза и дальнейшего постна-тального роста и развития организма.
Особо следует отметить, что некоторые ключевые ферменты, регулирующие процессы внутриклеточного обмена веществ, также существуют как в фосфорилированной, так и в дефосфорилированной форме. Этим подчеркивается значение фосфорилирования–дефосфорилирования в процессах химической модификации макромолекул, участвующих в интегральных процессах метаболизма.
Вопрос 30. Энзинопатологии (фенилкетонурия, альбинизм и алкаптонурия)
Ответ. Фенилкетонурия, фенилпировиноградная олигофрения, наследственное заболевание из группы ферментопатий, в основе которого лежит аномалия аминокислотного обмена вследствие отсутствия или резкого снижения активности фермента фенилаланингидроксилазы. Описана в 1934 норв. учёным А. Фёллингом (A. Foiling) (болезнь Фёллинга). Частота фенилкетонурии – 1 случай на 10–15 тыс. новорождённых; наследуется по аутосомно-рецессивному типу. При фенилкетонурии фенилаланингидроксилаза сохраняет только около 5% активности, в связи с чем нарушается обмен фенилаланина и вследствие этого – тирозина, триптофана и др., накапливаются промежуточные продукты обмена – фенилэтиламин, фенилпировиноградная кислота и др. и возникает дефицит метаболитов, необходимых для нормального функционирования организма. В частности, вероятная причина умственных расстройств – дефицит медиаторов нервной системы (адреналина, норадреналина, серотонина и др.). Таким образом, при фенилкетонурии возникает комплекс взаимосвязанных метаболических расстройств, состоящий из первичного ферментного нарушения и обусловленных им др. нарушений обмена.
Фенилкетонурия проявляется главным образом выраженной олигофренией (идиотией или имбецильностью). Диагностируется в первые дни жизни ребёнка с помощью экспресс-методов – микробиологических или биохимических. Последние основаны на определении пировиноградной кислоты в моче посредством индикаторов (проба Фёллинга). Лечение сводится главным образом к специальной диете (резкое ограничение продуктов, содержащих фенилаланин).
Альбинизм (albinismus) представляет собой врожденное отсутствие кожного пигмента. Этиология и патогенез изучены недостаточно. Известно, что в результате нарушения синтеза ферментов тирозиназы, дофаоксидазы прекращается образование меланина из тирозина, диоксифенилаланина. О сложности механизмов происхождения альбинизма свидетельствуют нередко сопутствующие ему такие аномалии, как врожденная глухота, дефекты интеллекта, патология глаз и другие.
Выделяют тотальный, неполный и частичный альбинизм.
Тотальный альбинизм наследуется аутосомно-рецессивно со средней частотой 1: 10000-20000. Предполагают, что носители мутантного гена составляют 1,5% среди всех нормально пигментированных людей.
Депигментация кожи и придатков наблюдается с рождения, сопровождается сухостью кожи, нарушением потоотделения, иногда гипо- или гипертрихозом, особенно на открытых участках. У больных легко возникают солнечные ожоги, актинический хейлит. Они предрасположены к развитию кератом, эпителиом, телеангиэктазий. Из-за отсутствия пигмента в тканях глаза зрачки кажутся красными. Характерными являются горизонтальный нистагм и выраженная светобоязнь. Часто наблюдаются сходящееся косоглазие, снижение остроты зрения в результате нарушений рефракции, катаракты, возможна микрофтальмия. Нередко наблюдаются бесплодие, иммунодефицит (отсюда частые инфекции), пороки развития, сокращение продолжительности жизни, олигофрения.
Неполный альбинизм (син.: альбиноидизм), в отличие от предыдущей формы, наследуется аутосомно-доминантно, в некоторых случаях — рецессивно. Имеет место снижение активности тирозиназы, но не блокада ее синтеза. Наблюдается гипопигментация кожи, волос, радужки, иногда фотофобия. Других дефектов и аномалий не регистрируется.
Частичный альбинизм (син.: пиебалдизм) наследуется аутосомно-доминантно. Проявления выявляются при рождении. Характеризуется появлением участков ахромии на коже живота, лица, нижних конечностей, прядей седых волос. Депигментированные пятна неправильной формы с резкими границами, на их поверхности имеются мелкие темно-коричневые пятнышки. Вокруг ахромичных пятен кожа может быть пигментированной. Поражений других органов обычно не бывает. Частичный альбинизм является одним из проявлений синдромов Чедиака-Хигаси, Клейна-Ваарденбурга, Титце, Менде, Хермански-Пудлака, Кросса-МакКьюзика-Брина.
Дифференциальный диагноз альбинизма проводят с витилиго, синдромами Клейна-Ваарденбурга, Алеззандрини, Фогта-Коянаги-Харады.
Алкаптонурия (alcaptomiria; алкаптон (гомогентизиновая кислота) + греч. uron моч ) - наследственная болезнь, обусловленная нарушением обмена тирозина вследствие пониженной активности фермента гомогентизиназы и накоплением в тканях организма гомотентизиновой кислоты; проявляется у взрослых пигментацией различных тканей, развитием артрозов, а у детей - лишь темным окрашиванием мочи и иногда ушной серы; наследуется по аутосомно-рецессивному типу.
Дата: 2019-05-28, просмотров: 423.