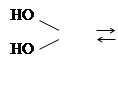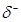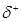Гидроксильная группа спиртов может быть замещена на галоген действием на них галогенводородных кислот, галогенных соединений фосфора или тионилхлорида, например,
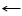
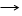
R – OH + HCl RCl + HOH
Наиболее удобно для замещения гидроксильной группы использовать тионилхлорид; применение галогенных соединений фосфора осложняется образованием побочных продуктов. Образующаяся при такой реакции вода разлагает галогеналкил на спирт и галогенводород, поэтому реакция обратима. Для ее успешного проведения необходимо, чтобы исходные продукты содержали минимальное количество воды. В качестве водоотнимающих средств применяют хлорид цинка, хлорид кальция, серную кислоту.
Данная реакция протекает с расщеплением ковалентной связи, что можно представить равенством
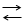
R : OH
+ H : Cl R - Cl + H
2O
Скорость этой реакции возрастает от первичных к третичным спиртам, причем она также зависит от галогена: наибольшей она является для иода, наименьшей – для хлора.
Дегидратация спиртов (отщепление воды).
В зависимости от условий дегидратации образуются олефины или простые эфиры.
Олефины (этиленовые углеводороды) образуются при нагревании спирта (кроме метилового) с избытком концентрированной серной кислоты, а также при пропускании паров спирта над окисью алюминия при 350° - 450°. При этом происходит внутримолекулярное отщепление воды, то есть Н+ и ОН – отнимаются от одной и той же молекулы спирта, например:


СН
2 – СН
2 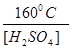
СН
2 = СН
2 + Н
2О или
 СН3-СН2-СН2ОН СН3-СН=СН2+Н2О
СН3-СН2-СН2ОН СН3-СН=СН2+Н2О
Простые эфиры образуются при осторожном нагревании избытка спирта с концентрированной серной кислотой. В этом случае происходит межмолекулярное отщепление воды, то есть Н+ и ОН – отнимаются от гидроксильных групп разных молекул спирта, как это показано на схеме:
R – OH + HO – R
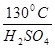
R – O – R + H
2O
 2С2Н5ОН С2Н5-О-С2Н5+Н2О
2С2Н5ОН С2Н5-О-С2Н5+Н2О
Первичные спирты дегидратируются труднее вторичных, легче отнимается молекула воды от третичных спиртов [5].
Образование сложных эфиров спиртов .
При действии кислородных минеральных и органических кислот на спирты образуются сложные эфиры, например,
С
2Н
5ОН+СН
3СООН С
2Н
5СООСН
3+Н
2О
ROH + SO2 SO2+H2O
Такого рода взаимодействие спирта с кислотами называется реакцией этерификации. Скорость этерификации зависит от силы кислоты и природы спирта: с увеличением силы кислоты она возрастает, первичные спирты реагируют быстрее вторичных, вторичные спирты – быстрее третичных. Этерификация спиртов карбоновыми кислотами ускоряется при добавлении сильных минеральных кислот. реакция обратима, обратная реакция называется гидролизом. Сложные эфиры получаются также при действии на спирты галогенангидридов и ангидридов кислот.
 R – OH + HCl RCl + HOH
R – OH + HCl RCl + HOH

 СН2 – СН2
СН2 – СН2 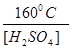 СН2 = СН2 + Н2О или
СН2 = СН2 + Н2О или
 СН3-СН2-СН2ОН СН3-СН=СН2+Н2О
СН3-СН2-СН2ОН СН3-СН=СН2+Н2О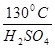 R – O – R + H2O
R – O – R + H2O
 2С2Н5ОН С2Н5-О-С2Н5+Н2О
2С2Н5ОН С2Н5-О-С2Н5+Н2О  С2Н5ОН+СН3СООН С2Н5СООСН3+Н2О
С2Н5ОН+СН3СООН С2Н5СООСН3+Н2О