Глава I. Свойства спиртов.
Физические свойства спиртов.
Физические свойства спиртов существенно зависят от строения углеводородного радикала и положения гидроксильной группы. Первые представители гомологического ряда спиртов – жидкости, высшие спирты – твердые вещества.
Метанол, этанол и пропанол смешиваются с водой во всех соотношениях. С ростом молекулярной массы растворимость спиртов в воде резко падает, так, начиная с гексилового, одноатомные спирты практически нерастворимы. Высшие спирты не растворимы в воде. Растворимость спиртов с разветвленной структурой выше, чем у спиртов с имеющих неразветвленное, нормальное строение. Низшие спирты обладают характерным алкогольным запахом, запах средних гомологов сильный и часто неприятный. Высшие спирты практически не имеют запаха. Третичные спирты обладают особым характерным запахом плесени.
Низшие гликоли – вязкие бесцветные жидкости, не имеющие запаха; хорошо растворимы в воде и этаноле, обладают сладким вкусом.
С введением в молекулу второй гидроксильной группы происходит повышение относительной плотности и температуры кипения спиртов. Например, плотность этиленгликоля при 0°С – 1,13, а этилового спирта – 0,81.
Спирты обладают аномально высокими температурами кипения по сравнению со многими классами органических соединений и чем можно ожидать на основании их молекулярных весов (Табл.1).
Таблица 1.
Физические свойства спиртов.
| Отдельные представители | Физические свойства | ||
| название | структурная формула | т. пл., °С | т. кип., °С |
| Одноатомные | |||
| Метанол (метиловый) | СН3ОН | -97 | 64,5 |
| Этанол (этиловый) | СН3СН2ОН | -115 | 78 |
| Пропанол-1 | СН3СН2СН2ОН | -127 | 97 |
| Пропанол-2 | СН3СН(ОН)СН3 | -86 | 82,5 |
| Бутанол-1 | СН3(СН2)2СН2ОН | -80 | 118 |
| 2-Метилпропанол-1 | (СН3)2СНСН2ОН | -108 | 108 |
| Бутанол-2 | СН3СН(ОН)СН2СН3 | -114 | 99,5 |
| Двухатомные | |||
| Этандиол-1,2 (этиленгликоль) | НОСН2СН2ОН | -17 | 199 |
| Трехатомные | |||
| Пропантриол-1,2,3 (глицерин) | НОСН2СН(ОН)СН2ОН | 20 | 290 |
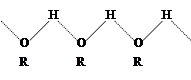 Это объясняется особенностями строения спиртов – с образованием межмолекулярных водородных связей по схеме:
Это объясняется особенностями строения спиртов – с образованием межмолекулярных водородных связей по схеме:
Спирты разветвленной структуры кипят ниже, чем нормальные спирты того же молекулярного веса; первичные спирты кипят выше вторичных и третичных их изомеров [3].
Химические свойства спиртов.
Как у всех кислородосодержащих соединений, химические свойства
спиртов определяются, в первую очередь, функциональными группами и, в
известной степени, строением радикала.
Характерной особенностью гидроксильной группы спиртов является подвижность атома водорода, что объясняется электронным строением гидроксильной группы. Отсюда способность спиртов к некоторым реакциям замещения, например, щелочными металлами. С другой стороны, имеет значение и характер связи углерода с кислородом. Вследствие большой электроотрицательности кислорода по сравнению с углеродом, связь углерод-кислород также в некоторой степени поляризована с частичным положительным зарядом у атома углерода и отрицательным – у кислорода. Однако, эта поляризация не приводит к диссоциации на ионы, спирты не являются электролитами, а представляют собой нейтральные соединения, не изменяющие окраску индикаторов, но они имеют определенный электрический момент диполя [3,4].
Спирты являются амфотерными соединениями, то есть могут проявлять как свойства кислот, так и свойства оснований.
Образование сложных эфиров спиртов .
При действии кислородных минеральных и органических кислот на спирты образуются сложные эфиры, например,
|
 С2Н5ОН+СН3СООН С2Н5СООСН3+Н2О
С2Н5ОН+СН3СООН С2Н5СООСН3+Н2О
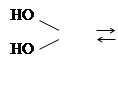 | |||
 | |||
ROH + SO2 SO2+H2O
Такого рода взаимодействие спирта с кислотами называется реакцией этерификации. Скорость этерификации зависит от силы кислоты и природы спирта: с увеличением силы кислоты она возрастает, первичные спирты реагируют быстрее вторичных, вторичные спирты – быстрее третичных. Этерификация спиртов карбоновыми кислотами ускоряется при добавлении сильных минеральных кислот. реакция обратима, обратная реакция называется гидролизом. Сложные эфиры получаются также при действии на спирты галогенангидридов и ангидридов кислот.
Заключение.
Спирты могут оказывать негативное воздействие на организм. Особенно ядовит метиловый спирт: 5 –10 мл спирта вызывают слепоту и сильное отравление организма, а 30 мл могут привести к смертельному исходу.
Этиловый спирт – наркотик. При приеме внутрь он вследствие высокой растворимости быстро всасывается в кровь и возбуждающе действует на организм. Под влиянием спиртного у человека ослабевает внимание, затормаживается реакция, нарушается координация, появляется развязность, грубость в поведении и т. д. Все это делает его неприятным и неприемлемым для общества. Но следствия употребления алкоголя могут быть и более глубокими. При частом потреблении появляется привыкание, пагубное пристрастие к нему и в конце концов тяжелое заболевание – алкоголизм. Спиртом поражаются слизистые оболочки желудочно-кишечного тракта, что может вести к возникновению гастрита, язвенной болезни желудка, двенадцатиперстной кишки. Печень, где должно происходить разрушение спирта, не справляясь с нагрузкой, начинает перерождаться, в результате возникает цирроз. Проникая в головной мозг, спирт отравляюще действует на нервные клетки, что проявляется в нарушении сознания, речи, умственных способностей, в появлении психических расстройств и ведет к деградации личности.
Особенно опасен алкоголь для молодых людей, так как в растущем организме интенсивно протекают процессы обмена веществ, а они особенно чувствительны к токсическому воздействию. Поэтому у молодежи быстрее, чем у взрослых, может появиться алкоголизм.
Список литературы
1. Глинка Н.Л. Общая химия. – Л.: Химия, 1978. – 720 с.
2.Джатдоева М.Р. Теоретические основы прогрессивных технологий. Химический раздел. – Ессентуки: ЕГИЭиМ, 1998. – 78 с.
3. Зурабян С.Э., Колесник Ю.А., Кост А.А. Органическая химия: Учебник. – М.: Медицина, 1989. - 432 с.
4. Метлин Ю.Г., Третьяков Ю.Д. Основы общей химии. – М.: Просвещение, 1980. – 157 с.
5. Несмеянов А.Н., Несмеянов Н.А. Начала органической химии. - М.: Химия, 1974. - 624 с.
Глава I. Свойства спиртов.
Физические свойства спиртов.
Физические свойства спиртов существенно зависят от строения углеводородного радикала и положения гидроксильной группы. Первые представители гомологического ряда спиртов – жидкости, высшие спирты – твердые вещества.
Метанол, этанол и пропанол смешиваются с водой во всех соотношениях. С ростом молекулярной массы растворимость спиртов в воде резко падает, так, начиная с гексилового, одноатомные спирты практически нерастворимы. Высшие спирты не растворимы в воде. Растворимость спиртов с разветвленной структурой выше, чем у спиртов с имеющих неразветвленное, нормальное строение. Низшие спирты обладают характерным алкогольным запахом, запах средних гомологов сильный и часто неприятный. Высшие спирты практически не имеют запаха. Третичные спирты обладают особым характерным запахом плесени.
Низшие гликоли – вязкие бесцветные жидкости, не имеющие запаха; хорошо растворимы в воде и этаноле, обладают сладким вкусом.
С введением в молекулу второй гидроксильной группы происходит повышение относительной плотности и температуры кипения спиртов. Например, плотность этиленгликоля при 0°С – 1,13, а этилового спирта – 0,81.
Спирты обладают аномально высокими температурами кипения по сравнению со многими классами органических соединений и чем можно ожидать на основании их молекулярных весов (Табл.1).
Таблица 1.
Физические свойства спиртов.
| Отдельные представители | Физические свойства | ||
| название | структурная формула | т. пл., °С | т. кип., °С |
| Одноатомные | |||
| Метанол (метиловый) | СН3ОН | -97 | 64,5 |
| Этанол (этиловый) | СН3СН2ОН | -115 | 78 |
| Пропанол-1 | СН3СН2СН2ОН | -127 | 97 |
| Пропанол-2 | СН3СН(ОН)СН3 | -86 | 82,5 |
| Бутанол-1 | СН3(СН2)2СН2ОН | -80 | 118 |
| 2-Метилпропанол-1 | (СН3)2СНСН2ОН | -108 | 108 |
| Бутанол-2 | СН3СН(ОН)СН2СН3 | -114 | 99,5 |
| Двухатомные | |||
| Этандиол-1,2 (этиленгликоль) | НОСН2СН2ОН | -17 | 199 |
| Трехатомные | |||
| Пропантриол-1,2,3 (глицерин) | НОСН2СН(ОН)СН2ОН | 20 | 290 |
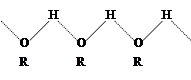 Это объясняется особенностями строения спиртов – с образованием межмолекулярных водородных связей по схеме:
Это объясняется особенностями строения спиртов – с образованием межмолекулярных водородных связей по схеме:
Спирты разветвленной структуры кипят ниже, чем нормальные спирты того же молекулярного веса; первичные спирты кипят выше вторичных и третичных их изомеров [3].
Дата: 2019-04-23, просмотров: 276.