РЕФЕРАТ
«ХИМИЯ МЕТАЛЛООРГАНИЧЕСКИХ
СОЕДИНЕНИЙ»
Содержание ______________________________________________________2
Введение_________________________________________________________3
1. Элементы 1 группы______________________________________________5
1.1 Органические соединения лития__________________________________5
1.2 Органические соединения натрия _________________________________7
1.3. Органические соединения калия__________________________________8
2. Элементы второй группы_________________________________________8
2.1 Органические соединения магния_________________________________9
2.2 Органические соединения цинка________________________________11
2.3 Органические соединения ртути _________________________________12
3. Элементы третьей группы________________________________________14
3.1 Органические соединения бора___________________________________14
3.2 Органические соединения алюминия______________________________15
4. Элементы четвертой группы______________________________________16
4.1 Органические соединения олова__________________________________16
4.2 Органические соединения свинца ------------------------------------------------16
5. Использованная литература______________________________________18
ВВЕДЕНИЕ
В создании химии металлоорганических соединений, переживающих период быстрого и всестороннего развития, принимали участие выдающиеся русские и зарубежные исследователи: А. М. Бутлеров, А. М. Зайцев, П. П. Шорыгин, В. Гриньяр, В. Шленк и др.
В Советском Союзе исследования в области металлоорганических соединений возглавляются А. Н. Несмеяновым и его школой, а за рубежом - К. Циглером, X. Гильманом, X. Норманом и др.
Введение в состав органических соединений металлов расширило синтетические возможности органической химии. Металлоорганические соединения находят практическое применение в качестве катализаторов реакции полимеризации, при получении инсектицидов и фунгицидов, антидетонаторов моторного топлива и т. д. Они привлекают внимание как возможные компоненты ракетных топлив.
А. Н. Несмеянов установил общие закономерности, касающиеся способности элементов периодической системы Д. И. Менделеева к образованию элементоорганических соединений.
Непереходные элементы - неметаллы (галогены, кислород, азот и т. д.) и металлы (литий, натрий, магний и т. д.) - образуют алкильные (и подобные им) производные со связью углерод-элемент. Переходные элементы (железо, кобальт, никель, марганец, хром, ванадий и т.д.) резко отличаются от непереходных элементов характером связи углерод - металл.
К металлоорганическим соединениям этого типа относятся комплексы переходных элементов с непредельными углеводородами (этилен, галогеноаллилы, ацетилен), циклическими углеводородами (циклопентадиен, бензол) дициклопентадиенильные и бисароматические (ареновые) производные - и другие комплексы, например карбонилы переходных металлов: 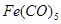 ,
, 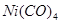 ,
, 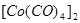 ; цианиды переходных металлов; ферро- и феррицианидные анионы:
; цианиды переходных металлов; ферро- и феррицианидные анионы: 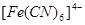 ,
, 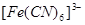 и т. д.
и т. д.
Органические соединения этой группы элементов, в частности сендвичевые соединения, будут описаны позднее (стр. 533).
Редкоземельные элементы и актиниды не склонны к образованию металлоорганических соединений.
Органическим соединениям неметаллических элементов посвящены все предыдущие разделы курса. Для этих элементов характерно образование алкильных (или арильных) производных, особенно для элементов двух малых периодов - второго и третьего: С, N, О, F, Si, P, S, C1. Алкильные (или арильные) производные элементов V, VI, VII групп способны превращаться в ониевые катионы, например:
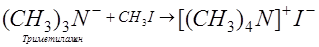 .
.
Естественно теперь сосредоточить внимание на органических соединениях непереходных металлов - собственно металлоорганических соединениях.
Непереходные металлы
Период
Группы
I
II
III
IV
II
Li
Be
B
III
Na
Mg
Al
IV
K
Ca
Cu
Zn
Ga
Ge
V
Rb
Sr
Ag
Cd
In
Sn
VI
Cs
Ba
Au
Hg
Tl
Pb
VII
Fr
Ra
Металлы также образуют алкильные (или арильные) производные, но в отличие от неметаллов алкильные (или арильные) производные элементов III, II и I (для лития) групп превращаются в обратноониевые комплексы:
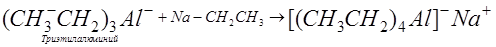 .
.
Природа связи углерод-металл изменяется в металлоорганических соединениях в широких пределах – от ионной до ковалентной. Увеличение электроположительных свойств металла и размеров его ковалентного радиуса усиливает ионный характер связи металл – углерод (например, в органических соединениях натрия); уменьшение электроположительности и уменьшение ковалентного радиуса делают связь с металлом более ковалентной (например, в органических соединениях германия).
Для соединения с более полярной связью (Li, Na, Mg) предпочтительнее гетеролитические реакции:
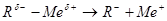 .
.
Соединения с менее полярной связью (Hg, Pb, Sn) реагируют как по гетеролитическому механизму (например, действие кислот), так и по гомолитическому (например, термическое разложение):
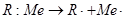
Образование металл - углеродной связи, например при взаимодействии галогеноалканов с металлами, может протекать через стадию ион - радикалов. Реакция начинается с переноса электрона с решетки металла на молекулу галогеноалкана с образованием анион-радикала (легко идентифицируется методом электронного парамагнитного резонанса), распадающегося на радикал и анион галогена, которые адсорбируются на поверхности металла. Далее радикал принимает второй электрон, превращаясь в карбанион, одновременно катион металла переходит в раствор, образуя металлоорганическое соединение.
ЭЛЕМЕНТЫ ПЕРВОЙ ГРУППЫ.
Щелочные металлы первой подгруппы имеют на внешней электронной оболочке по одному электрону и, следовательно, одновалентны.
Металлоорганические соединения построены так, что металл обычно связан поляризованной связью с атомом углерода органического остатка R—Me (где R — алкил или арил):
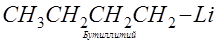
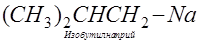
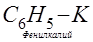
Названия металлоорганических соединений слагаются из названий радикалов и металла.
ЭЛЕМЕНТЫ ВТОРОЙ ГРУППЫ
Элементы второй группы имеют на внешней электронной оболочке два неспаренных электрона, поэтому они двухвалентны.
Преобладающее практическое значение имеют органические соединения двух металлов второй группы: магния и ртути.
Металл может быть связан с одним органическим остатком (алкилом или арилом), например R - Me - Hal: 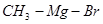 , бромид метилмагния, или с двумя органическими остатками (алкилами или арилами), например R - Me - R ’:
, бромид метилмагния, или с двумя органическими остатками (алкилами или арилами), например R - Me - R ’: 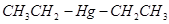 , диэтилртуть.
, диэтилртуть.
Соединения бора
Бортриалкилы обычно получаются реакцией бортрифторида с реактивами Гриньяра:
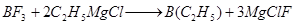 ,
,
или присоединением бороводородов по кратным связям:
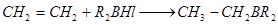
Бортриалкилы — бесцветные жидкости с запахом лука и редьки. Их синтез ведут в атмосфере азота, так как на воздухе они легко окисляются. При энергичном окислении бортриалкилы воспламеняются и горят зеленым пламенем. При регулируемом окислении кислородом воздуха они образуют алкилборные эфиры R 2 B — OR и RB ( OR )2.
С водой бортриалкилы реагируют очень медленно. При гидролизе алкилборных эфиров холодной водой или разбавленными кислотами получаются алкилборные кислоты.
Эфиры алкилборных кислот получаются также при реакции цинкалкилов или реагентов Гриньяра с триэтилборным эфиром.
При взаимодействии диборана с аммиаком образуется бензоподобное вещество — боразол — бесцветная жидкость с т. кип. 55 0С.
При взаимодействии бороводорода с ацетиленом образуется твердый карборан, молекула которого состоит из 10 атомов бора и двух атомов углерода (правильный двадцатигранник). Карборан отличается термической (до 600 0С) и химической (не реагирует с кислотами и окислителями) стойкостью.
Соединения алюминия
Алюминийалкилы более активно реагируют с водой, кислородом и т. д., чем органические соединения других элементов третьей группы. Химические свойства алюминийалкилов сходны с химическими свойствами соединений II группы. Алкилзамещенные гидроксида алюминия не существуют.
Триалкильные производные алюминия могут быть получены различными способами:
1) обработкой алюминий-магниевого сплава алкилгалогенидами:
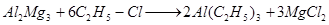
2) непосредственным взаимодействием алюминия с водородом и
олефином (К. Циглер):
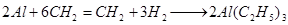 .
.
Алюминийалкилы – вязкие бесцветные жидкости; низшие члены гомологического ряда ассоциированы (димеры).
Алюминийалкилы быстро окисляются на воздухе, бурно реагируют с водой, часто с воспламенением, многие из них самопроизвольно загораются.
Наиболее новое и важное применение алюминийтриалкилов – использование их в качестве катализаторов при полимеризации олефинов.
Триэтилалюминий реагирует с этиленом при 100-1200С с образованием смеси различных соединений алюминия, дающих при гидролизе смесь н-углеводородов с четным числом атомов углерода в молекуле:
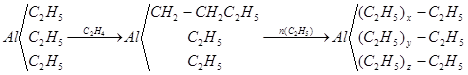
Трипропилалюминий с этиленом дает углеводороды с нечетным числом углеродных атомов.
Этим способом получают полиэтилен с молекулярной массой 5000-3000000. Свойства полиэтилена, полученного при низком давлении, отличаются от свойств полиэтилена, полученного при высоком давлении.
Соединения олова
Органические соединения олова отличаются от органических соединений кремния и германия. Связь С— Sn более слабая и более полярная, органические группы в таких соединениях легче обмениваются или перегруппировываются. Имеются соединения, в которых металл двухвалентен.
Оловоорганические соединения обычно называют по номенклатуре, применяемой в неорганической химии, например дихлордибутилолово, хлористое трибутилолово.
Низшие члены гомологического ряда тетраалкилзамещенных олова — бесцветные жидкости высокой плотности, сильно преломляющие свет; для ( CH 3 )4 Sn т. кип. 78 °С, для ( C 2 H 5 )4 Sn 1810 С.
Алкильные производные олова не разрушаются водой при температуре до 100 °С. Галогениды и гидроксиды алкилолова растворимы в воде: галогениды дают проводящие ток растворы, в которых они частично и обратимо гидролизованы.
Сильные основания сначала осаждают оксиды алкилолова, затем растворяют их с образованием натриевых солей. Галогениды растворяются в спиртах без заметного сольволиза, алкоксипроизводные могут быть получены при действии алкоголятов натрия.
Галогены и галогеноводороды легко расщепляют связь С— Sn. Соединения олова, особенно содержащие галоген, ядовиты.
В последние годы оловоорганические соединения приобрели важное промышленное значение. Дилаурат дибутилолова используют в качестве стабилизатора поливинилхлорида, предупреждая окрашивание и обугливание во время формования и при освещении солнечным светом. Соли трибутилолова и органических кислот обладают очень сильными фунгицидными свойствами, такими же, как у ртутьорганических соединений, и используются для защиты бумаги, дерева и других материалов. Небольшие добавки тетрафенилолова к диэлектрнкам предохраняют их от разрушения при возникновении пробоя, искры или короны.
Способы получения оловоорганических соединений аналогичны способам получения соединений кремния.
Соединения свинца.
Свинецорганические соединения по сравнению с соединениями кремния, германия и олова нестойки и легко разрушаются при нагревании и на свету. Связь углерод — свинец значительно более легко разрушается кислотами. Даже угольная кислота оказывается достаточно сильной кислотой, чтобы медленно отщеплять органические группы от свинца.
Наиболее важное применение имеет тетраэтилсвинец, который получают в промышленных масштабах взаимодействием сплава натрия со свинцом и хлористым этилом:
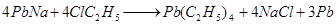
По-видимому, реакция протекает с образованием в качестве промежуточного продукта этилнатрия.
Тетраэтилсвинец (ТЭС) используется в огромных количествах как антидетонатор для моторного топлива (этилированный бензин содержит ТЭС). Исключительно ядовит.
В последние годы свинецорганические соединения стали использовать в качестве инсектицидов и фунгицидов.
6. Использованная литература:
1. «Органическая химия», В. В. Перекалин, С. А. Зонис; Москва, «Просвещение», 1973 г.
РЕФЕРАТ
«ХИМИЯ МЕТАЛЛООРГАНИЧЕСКИХ
СОЕДИНЕНИЙ»
Содержание ______________________________________________________2
Введение_________________________________________________________3
1. Элементы 1 группы______________________________________________5
1.1 Органические соединения лития__________________________________5
1.2 Органические соединения натрия _________________________________7
1.3. Органические соединения калия__________________________________8
2. Элементы второй группы_________________________________________8
2.1 Органические соединения магния_________________________________9
2.2 Органические соединения цинка________________________________11
2.3 Органические соединения ртути _________________________________12
3. Элементы третьей группы________________________________________14
3.1 Органические соединения бора___________________________________14
3.2 Органические соединения алюминия______________________________15
4. Элементы четвертой группы______________________________________16
4.1 Органические соединения олова__________________________________16
4.2 Органические соединения свинца ------------------------------------------------16
5. Использованная литература______________________________________18
ВВЕДЕНИЕ
В создании химии металлоорганических соединений, переживающих период быстрого и всестороннего развития, принимали участие выдающиеся русские и зарубежные исследователи: А. М. Бутлеров, А. М. Зайцев, П. П. Шорыгин, В. Гриньяр, В. Шленк и др.
В Советском Союзе исследования в области металлоорганических соединений возглавляются А. Н. Несмеяновым и его школой, а за рубежом - К. Циглером, X. Гильманом, X. Норманом и др.
Введение в состав органических соединений металлов расширило синтетические возможности органической химии. Металлоорганические соединения находят практическое применение в качестве катализаторов реакции полимеризации, при получении инсектицидов и фунгицидов, антидетонаторов моторного топлива и т. д. Они привлекают внимание как возможные компоненты ракетных топлив.
А. Н. Несмеянов установил общие закономерности, касающиеся способности элементов периодической системы Д. И. Менделеева к образованию элементоорганических соединений.
Непереходные элементы - неметаллы (галогены, кислород, азот и т. д.) и металлы (литий, натрий, магний и т. д.) - образуют алкильные (и подобные им) производные со связью углерод-элемент. Переходные элементы (железо, кобальт, никель, марганец, хром, ванадий и т.д.) резко отличаются от непереходных элементов характером связи углерод - металл.
К металлоорганическим соединениям этого типа относятся комплексы переходных элементов с непредельными углеводородами (этилен, галогеноаллилы, ацетилен), циклическими углеводородами (циклопентадиен, бензол) дициклопентадиенильные и бисароматические (ареновые) производные - и другие комплексы, например карбонилы переходных металлов: 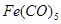 ,
, 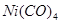 ,
, 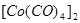 ; цианиды переходных металлов; ферро- и феррицианидные анионы:
; цианиды переходных металлов; ферро- и феррицианидные анионы: 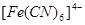 ,
, 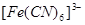 и т. д.
и т. д.
Органические соединения этой группы элементов, в частности сендвичевые соединения, будут описаны позднее (стр. 533).
Редкоземельные элементы и актиниды не склонны к образованию металлоорганических соединений.
Органическим соединениям неметаллических элементов посвящены все предыдущие разделы курса. Для этих элементов характерно образование алкильных (или арильных) производных, особенно для элементов двух малых периодов - второго и третьего: С, N, О, F, Si, P, S, C1. Алкильные (или арильные) производные элементов V, VI, VII групп способны превращаться в ониевые катионы, например:
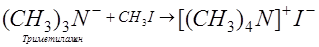 .
.
Естественно теперь сосредоточить внимание на органических соединениях непереходных металлов - собственно металлоорганических соединениях.
Непереходные металлы
Период
Группы
I
II
III
IV
II
Li
Be
B
III
Na
Mg
Al
IV
K
Ca
Cu
Zn
Ga
Ge
V
Rb
Sr
Ag
Cd
In
Sn
VI
Cs
Ba
Au
Hg
Tl
Pb
VII
Fr
Ra
Металлы также образуют алкильные (или арильные) производные, но в отличие от неметаллов алкильные (или арильные) производные элементов III, II и I (для лития) групп превращаются в обратноониевые комплексы:
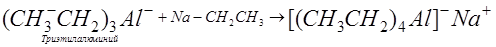 .
.
Природа связи углерод-металл изменяется в металлоорганических соединениях в широких пределах – от ионной до ковалентной. Увеличение электроположительных свойств металла и размеров его ковалентного радиуса усиливает ионный характер связи металл – углерод (например, в органических соединениях натрия); уменьшение электроположительности и уменьшение ковалентного радиуса делают связь с металлом более ковалентной (например, в органических соединениях германия).
Для соединения с более полярной связью (Li, Na, Mg) предпочтительнее гетеролитические реакции:
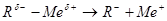 .
.
Соединения с менее полярной связью (Hg, Pb, Sn) реагируют как по гетеролитическому механизму (например, действие кислот), так и по гомолитическому (например, термическое разложение):
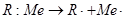
Образование металл - углеродной связи, например при взаимодействии галогеноалканов с металлами, может протекать через стадию ион - радикалов. Реакция начинается с переноса электрона с решетки металла на молекулу галогеноалкана с образованием анион-радикала (легко идентифицируется методом электронного парамагнитного резонанса), распадающегося на радикал и анион галогена, которые адсорбируются на поверхности металла. Далее радикал принимает второй электрон, превращаясь в карбанион, одновременно катион металла переходит в раствор, образуя металлоорганическое соединение.
ЭЛЕМЕНТЫ ПЕРВОЙ ГРУППЫ.
Щелочные металлы первой подгруппы имеют на внешней электронной оболочке по одному электрону и, следовательно, одновалентны.
Металлоорганические соединения построены так, что металл обычно связан поляризованной связью с атомом углерода органического остатка R—Me (где R — алкил или арил):
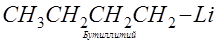
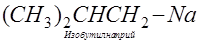
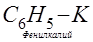
Названия металлоорганических соединений слагаются из названий радикалов и металла.
Органические соединения лития.
Способы получения. 1. Из галогеноалкилов (или арилов) и металлического лития (К. Циглер, 1928 г.). Способ заключается во взаимодействии лития с галогеноалкилами или арилами (обычно применяют хлористые алкилы и бромистые арилы). Успех реакции, 

 помимо строения галогенопронзводного, зависит от растворителя и температуры. Растворителями при получении литийорганических соединений — алкильных — служат петролейный эфир, гексан, бензол; арильных — этиловый эфир:
помимо строения галогенопронзводного, зависит от растворителя и температуры. Растворителями при получении литийорганических соединений — алкильных — служат петролейный эфир, гексан, бензол; арильных — этиловый эфир:
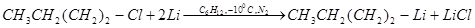
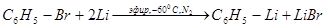
Галогенвинилы (в которых галоген обладает малой подвижностью) легко реагируют с литием, образуя литийорганические соединения винильного типа:
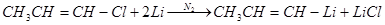
Неустойчивость литийорганических соединений к влаге и к кислороду заставляет проводить синтез с сухими веществами в атмосфере инертных газов (азота). Литийорганические соединения обычно не выделяются в свободном виде, а применяются в растворах так же как натрий- и магнийорганические соединения.
Основному процессу могут сопутствовать побочные реакции, например взаимодействие исходного галогеноалкила с образовавшимся литийорганическим производным:
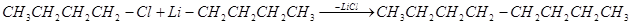 2. Действие лития и литийалкилов на органические соединения ртути имеет значение в случае необходимости выделения литийоранических соединений в свободном виде:
2. Действие лития и литийалкилов на органические соединения ртути имеет значение в случае необходимости выделения литийоранических соединений в свободном виде:
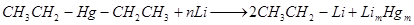
Химические свойства. Вода, спирты, кислоты легко реагируют с литийорганическими соединениями, например:
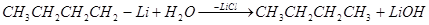
Окисление литийорганических соединений. При регулируемом окислении литийорганические соединения превращаются в спирты:
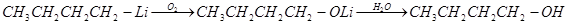
Синтез кислот. Введение литийорганических соединений в избыток двуокиси углерода (их выливают на твердую углекислоту) приводит к литиевым солям карбоновых кислот, которые при действии соляной кислоты превращаются в карбоновые кислоты. Эта реакция широко применяется при исследовании строения литийорганических соединений и для синтеза карбоновых кислот:
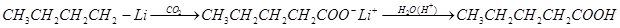 Взаимодействие с непредельными углеводородами — общее свойство для щелочных металлов первой группы. Первоначально считалось, что для успеха реакции двойная связь должна быть сопряжена с непредельной системой или ароматическим кольцом. Однако в 1960 г. К. Циглер показал возможность присоединения литийалкилов к изолированной двойной связи, причем третичные и вторичные литийалкилы реагируют легче первичных.
Взаимодействие с непредельными углеводородами — общее свойство для щелочных металлов первой группы. Первоначально считалось, что для успеха реакции двойная связь должна быть сопряжена с непредельной системой или ароматическим кольцом. Однако в 1960 г. К. Циглер показал возможность присоединения литийалкилов к изолированной двойной связи, причем третичные и вторичные литийалкилы реагируют легче первичных.
Бутиллитий при нагревании и повышенном давлении присоединяется к этилену с образованием литийалкилов (в которых литий сохраняет высокую реакционную способность):
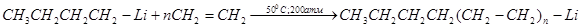
Изопропиллитий реагирует с этиленом уже при -60°С, образуя 1-литий-З-метилбутан:
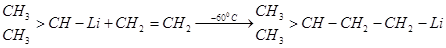
К 1,3-бутадиену литийалкилы присоединяются в положения 1,4 и 1,2. Повышение температуры и давления благоприятствует 1,4- присоединению:
 .
.
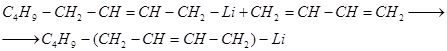
Практическое значение этой реакции заключается в том, что она привела к промышленному методу стереорегулярной полимеризации 1,3-бутадиена в синтетический каучук.
Взаимодействие алкиллития с карбонильными соединениями (альдегидами, кетонами), как и в случае натрий-, магний-, цинк-, алюминийорганических соединений, приводит к спиртам. Использование в этой реакции литийорганических соединений оправдано в тех случаях, когда взаимодействие с альдегидами и кетонами более доступных магнийорганических соединений не приводит к цели.
Так, диизопропилкетон и изопропиллитий образуют триизопропилкарбинол. Реакция протекает через стадию нестойкого комплекса, который перегруппировывается в литиевый алкоголят, гидролизуемый водой в триизопропил карбинол:
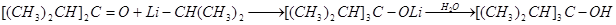 Магнийорганическим синтезом подобный спирт разветвленного строения получить нельзя вследствие восстановления исходного кетона магнийорганическим соединением.
Магнийорганическим синтезом подобный спирт разветвленного строения получить нельзя вследствие восстановления исходного кетона магнийорганическим соединением.
Дата: 2019-05-28, просмотров: 345.