Если графически изобразить зависимость давления пара каждого вещества двухкомпонентной смеси от его мольной доли, поучиться прямая линия. Пусть даны вещества А и В. Обозначим их мольные доли NA и NB. По закону Рауля имеем:
 pA=
pA= 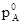 * NA, pB=
* NA, pB= 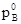 * NВ
* NВ
 где p0 есть давление пара чистого вещества. Это суть уравнения прямых, если на осях отложены давления пара и мольные доли.
где p0 есть давление пара чистого вещества. Это суть уравнения прямых, если на осях отложены давления пара и мольные доли.
Для общего давления пара раствора отсюда следует равенство: p= 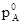 * NA +
* NA + 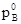 * NВ
* NВ
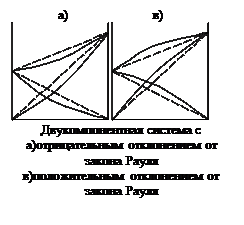
Эта линейная зависимость осложняется если между компонентами смеси действуют силы притяжения, и она изображается не прямой, а кривой линией
Если оба компонента раствора в чистом состоянии летучи, то пар будет содержать оба компонента. Однако относительное содержание компонентов в парах в общем случае будет отличаться от относительного содержания их в жидкостях. Для простейших систем легко установить соотношение между составами раствора и пара, равновесного с ним. Только b системе, компоненты которой обладают одинаковым давлением пара в чистом состоянии, состав пара над раствором равен составу раствора. В остальных же случаях состав пара отличен от состава раствора и тем в большей степени, чем больше различаются давления пара над чистыми компонентами. В простейших системах в парах всегда преобладает по сравнению с жидкостью тот из компонентов, который обладает большим давлением пара в чистом состоянии.
В количественной форме соотношения между составом пара и жидкости могут быть выведены следующим путем. Обозначим через NA’ и NB’ мольные доли компонентов в парах, причем NA’= 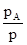 и NB’=
и NB’= 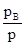
Пользуясь законом Рауля легко получить, что p= 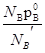 , а пользуясь выражением p=
, а пользуясь выражением p= 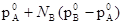 получаем, что
получаем, что 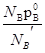 =
= 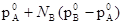
Для систем, в которых зависимость давления пара от состава нелинейная, нет общего выражения, в такой простей форме связывающего составы пара и раствора. Зависимость состава пара от состава раствора и общего давления характеризуется законом, открытым Д.И.Коноваловым и носящими его имя. Закон Коновалова характеризует соотношения между составами равновесных жидкостей и пара и влияние добавления того или иного компонента на общее давление пара. Он формулируется следующим образом:
а) Повышение относительного содержания компонента в жидкой фазе всегда вызывает увеличение относительного содержания его и в парах.
b) В двойной системе пар, по сравнению с находящейся с ним в равновесии жидкостью, относительно более богаче тем из компонентов, прибавление которого к системе повышает общее давление пара, т.е. понижает температуру кипения смеси при данном давлении.
Введем в раствор из двух веществ какое-либо новое вещество. В общем случае это вещество распределится между обоими веществами в растворе, пропорционально своей растворимости в каждом из них. Отсюда втекает закон распределения, согласно которому вещество, способное растворяться в двух несмешивающихся растворителях, распределяется между ними так, что отношение его концентраций в этих растворителях при постоянной температуре остается постоянным, независимо от общего количества растворенного вещества.
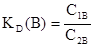
где С1B и С2B - концентрации растворенного вещества в первом и втором растворителях;
KD(B) – константа распределения вещества B между двумя жидкими несмешивающимися фазами.
VIII. Неидеальные растворы.
Реальные растворы в подавляющем большинстве не подчиняются законам идеальных растворов. Очень многие из них не подчиняются, например, закону Рауля, причем известны как положительные, так и отрицательные отклонения. Если давление пара над реальным раствором больше, чем над идеальным такого же состава, то отклонения от закона Рауля называют положительными, а если меньше, то отрицательными. Знак и величина отклонения зависит от природы растворителя и растворенного вещества. . Если молекулы одного компонента сильнее притягиваются друг к другу, чем к молекулам другого компонента, то парциальные давления пара над смесью будут больше вычисленных. Если же частицы разных компонентов притягиваются друг к другу сильнее, чем частицы одного и того же компонента, то парциальные давления будут меньше вычисленных.
В реальных растворах взаимодействия между однородными и разнородными молекулами различны. Если раствор образуется из частных компонентов А и В, то изменение потенциальной энергии при образовании раствора равно:
 DU=
DU= 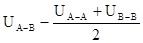 , где
, где
UA-A, UB-B и UA-B - средние потенциальные энергии взаимодействия между однородными и разнородными молекулами соответственно, если DU=0, то раствор идеальный. Идеальные растворы при всех концентрациях и температурах подчиняются закону Рауля.
IX. Активность и коэффициент активности.
При рассмотрении термодинамических свойств растворов принято пользоваться отношением
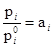
Эта величина называется активностью i в растворе. Согласно уравнению 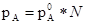 отношение
отношение 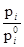 равно мольной концентрации данного компонента в растворе. Активность представляет собой вспомогательную расчетную термодинамическую функцию, которая характеризует степень связанности молекул компонента. При образовании данным компонентом в растворе каких-нибудь соединений его активность становится меньше и, наоборот, активность возрастает при уменьшении степени ассоциации компонента. Активность дает возможность судить об отклонении свойств данного компонента в том или ином растворе от свойств в простейшем растворе при той же мольной концентрации компонента. Активность зависит от вида и концентрации каждого из других компонентов .раствора. Она зависит также от температуры и от давления, но не зависит от способа выражения концентрации. Химический потенциал данного компонента в растворе связывается с активностью соотношением:
равно мольной концентрации данного компонента в растворе. Активность представляет собой вспомогательную расчетную термодинамическую функцию, которая характеризует степень связанности молекул компонента. При образовании данным компонентом в растворе каких-нибудь соединений его активность становится меньше и, наоборот, активность возрастает при уменьшении степени ассоциации компонента. Активность дает возможность судить об отклонении свойств данного компонента в том или ином растворе от свойств в простейшем растворе при той же мольной концентрации компонента. Активность зависит от вида и концентрации каждого из других компонентов .раствора. Она зависит также от температуры и от давления, но не зависит от способа выражения концентрации. Химический потенциал данного компонента в растворе связывается с активностью соотношением:
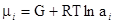
Вместо активности нередко пользуются величиной коэффициента активности, g. Он равен отношению активности к концентрации g= 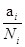 . Коэффициент активности характеризует степень отклонения свойств рассматриваемого компонента в данном растворе от его свойств в соответствующем простейшем растворе. В сильно разбавленном растворе коэффициент активности равен единице. Чем более концентрирован раствор, тем больше отличается активность от концентрации.
. Коэффициент активности характеризует степень отклонения свойств рассматриваемого компонента в данном растворе от его свойств в соответствующем простейшем растворе. В сильно разбавленном растворе коэффициент активности равен единице. Чем более концентрирован раствор, тем больше отличается активность от концентрации.
Дата: 2019-05-28, просмотров: 247.