Любой раствор состоит из растворителя и растворенного вещества. В случае растворов газов или твердых веществ в жидкостях растворителем обычно считается жидкость, а растворенным веществом – растворенный газ или твердое вещество, независимо от их относительного количественного содержания. Когда компоненты обладают ограниченной смешиваемостью, то растворителем является тот, прибавление которого к раствору возможно в неограниченном количестве без нарушения гомогенности. Если компоненты обладают неограниченной растворимостью, то можно выделить два случая. При значительном различии содержания компонентов растворителем считается вещество, присутствующее в относительно большем количестве. Понятия растворитель и растворенное вещество теряют смысл, когда речь идет о смесях с примерно равными или близкими концентрациями компонентов. В этом случае состав раствора может выражаться различными способами – как с помощью безразмерных единиц – долей или процентов, так и через размерные величины – концентрации. На практике используют более десятка способов выражения концентрации. Вот некоторые из них:
1. Массовая доля растворенного вещества.
Отношение массы растворенного вещества B к массе растворителя.
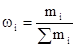 или
или 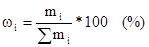
2. Мольная доля растворенного вещества.
Отношение количества растворенного вещества к суммарному количеству всех веществ, составляющих раствор, включая растворитель
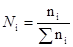 или
или 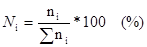
Мольная доля указывает на число молей данного вещества в одном моле раствора. Сумма мольных долей всех составных веществ равна единице: 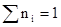
3. Объемная доля растворенного вещества:
Отношение объема растворенного вещества к сумме объемов вещества и растворителя.
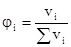 или
или 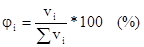
4. Молярная концентрация (или молярность).
Определяется отношением числа молей растворенного вещества к объему раствора, выраженному в литрах. Физический смысл молярной концентрации заключается в том, что она указывает на число молей вещества содержащегося в 1 литре его раствора.
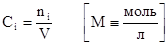
5. Нормальная концентрация (или нормальность).
Определяется отношением числа эквивалентов растворенного вещества B к объему раствора, выраженному в литрах. Физический смысл нормальной концентрации заключается в том, что она указывает на число эквивалентов растворенного вещества, содержащегося в 1 литре раствора.
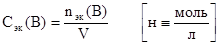
6. Моляльная концентрация (или моляльность).
Определяется отношением числа молей растворенного вещества к массе растворителя. Физический смысл заключается в том, что она показывает, сколько молей вещества растворено в 1 кг (1000г) растворителя.
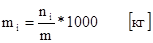
Применение того или иного способа выражения концентрации зависит от решения конкретных практических задач.
Дата: 2019-05-28, просмотров: 268.