1. Подсчитать количество атомов каждого элемента в правой и левой части.
2. Определить, у какого элемента количество атомов меняется, найти Н.О.К (наименьшее общее кратное).
3. Разделить Н.О.К. на индексы – получить коэффициенты. Поставить коэффициенты перед формулами.
4. Пересчитать количество атомов, при необходимости действия повторить.
5. Начинать лучше с атомов О или любого другого неметалла (если только О не находится в составе нескольких веществ).
Примеры: а) N2 + 3H2 → 2NH3 б) СaO + 2HNO3→ Ca(NO3)2 + H2O
Задание 8. Смотри учебник параграф 39
Задание 9. Смотри учебник параграфы 37, 38
Задание 10. Смотри параграф 40 учебника
Задание 11.
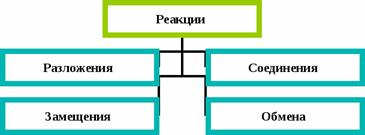
Реакции разложения – это реакции, в результате которых из одного сложного вещества получается несколько простых или новых сложных веществ.
2HgO → 2Hg + O2
2H2O → 2H2 + O2
2H2O2 → 2H2O + O2
Реакции соединения – это такие реакции, в результате которых из одного или нескольких исходных веществ образуется одно сложное вещество.
4P + 5O2 = 2P2O5
P2O5 + 3H2O = 2H3PO4
Реакции замещения — это реакции, в результате которых атомы простого вещества замещают атомы одного из химических элементов в сложном веществе.
Если металл стоит в ряду активности металлов до водорода, он способен вытеснять его из растворов кислот, если после водорода, то нет.
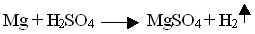

Cu+HCl = не идет
Если металл стоит в ряду АКТИВНОСТИ до металла соли, то он способен вытеснить этот металл из раствора его соли

FeSO4 + Cu = не идет
Реакции обмена - это такие реакции, в результате которых два сложных вещества обмениваются своими составными частями.
AB+CD = AC+BD
Например, 2NaI+Pb(NO3)2 = PbI2↓ + 2NaNO3
Fe(NO3)3 + 3NaOH= Fe(OH)3 + 3NaNO3
Задание 12.
Относительная молекулярная масса вещества Mr – это сумма относительных атомных масс элементов, составляющих вещество с учетом индексов.
Пример : Mr(H2O) = 2Ar(H) + Ar(O) = 2*1 + 16 = 18
Mr(CO2) = Ar(C) + 2Ar(O) = 12 + 2*16 = 44
Массовая доля элемента в веществе
Определяется по формуле:  ω(Э)=
ω(Э)= 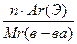 , где
, где
ω(Э) – массовая доля элемента Э в веществе
N – число атомов элемента Э в веществе
Ar - относительная атомная масса элемента Э
Mr(в-ва) - относительная молекулярная масса вещества.
Пример: Определим массовые доли элементов в оксиде натрия Na2O
Ar(Na) =23, Ar(O) = 16,
Mr(Na2O) = 2* 23 + 16 = 62
ω(Na) = 2*Ar(Na) : Mr(Na2O) = 2 *23 : 62 = 0,74 или 74%
ω(Na) = Ar(O) : Mr(Na2O) = 16 : 62 = 0,26 или 26%
Проверка: 74% + 26% = 100
Задание 13.
| ЧТО НЕОБХОДИМО ЗНАТЬ |
Массовая доля – это отношение массы растворенного вещества к общей массе раствора.
-Массовую долю обозначают латинской буквой ω
-Исходя из определения выведите формулу массовой доли в долях и процентах 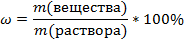 Так как раствор состоить из растворителя (в качестве растворителя чаще всего выступает вода) и растворенного вещества, приобразуем формулу:
Так как раствор состоить из растворителя (в качестве растворителя чаще всего выступает вода) и растворенного вещества, приобразуем формулу:
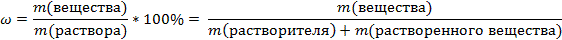 Выведите из этой фрмулы формулу массы вещества
Выведите из этой фрмулы формулу массы вещества
 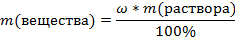
|
Пример 2: Сахар массой 20,5г растворили в 325,5г воды.
Определите массовую долю сахара в полученном растворе.
| Дано m сахара = 20,5 г m (H2O) = 325,5 г |
Решение
1. Запишем формулу для расчёта массовой доли:
w раств-го вещества = m раств-го в-а /mр-ра* 100%
2. Вычислим массу раствора
m р-ра= m раств-го в-ва + m( H 2 O )
mр-ра= 20,5 + 325,5 = 346
3. Вычислим массовую долю сахара
w=20,5/346*100 = 5,9% (или 0,059)
Ответ: w% = 5,9 %
Пример 3. 250 г 10%-го раствора сульфата натрия упарили до 200 г. Какой стала массовая доля сульфата натрия в растворе?
| Дано m1 раствора = 250 г w(в-ва) = 10% m2 раствора = 200 г |
Решение 1. Запишем формулу для расчёта массовой доли: w раств-го вещества = m раств-го в-а /mр-ра* 100% 2. Вычислим массу вещества m в-ва= m р-ра* w в-ва = 250*0,1 = 25г 3. Вычислим массовую долю в-ва во втором растворе w2=25/200*100 = 12,5% (или 0,125) Ответ: w% = 12,5 % |
| Найти w% = ? |
Пример 4. К 150г 40%-го раствора азотной кислоты добавили еще 900г воды. Определите, какой стала массовая доля кислоты
| Дано m1 раствора = 150 г w(в-ва) = 40% mН2О = 900 г |
Решение 1. Запишем формулу для расчёта массовой доли: w раств-го вещества = m раств-го в-а /mр-ра* 100% 2. Вычислим массу вещества m в-ва= m р-ра* w в-ва = 150*0,4 = 60г 3. Вычислим массу нового раствора m р-ра= m раств-го в-ва + m( H 2 O ) mр-ра= 150 + 900 = 1050г 4. Вычислим массовую долю в-ва во втором растворе w2=60/1050*100 = 5,7% Ответ: w% = 5,7 % |
| Найти w% = ? |
Задание 14. 1) n = N / NA , N = NA ∙ n ,
где n – число молей, N – число атомов или молекул, NA – постоянная Авогадро. NA = 6,02∙1023 – постоянная Авогадро
кМоль = 103Моль, мМоль = 10-3Моль.
2)│Mr│=│M│, единицы измерения: г/Моль, кг/Моль, мг/Моль.
n = m / M , m = M ∙ n
Задача 1. Какова масса 0,5 моль оксида углерода (IV) СО2?
| Дано: n (СО2) = 1,5 моль М (СО2) = 44 г/моль | Решение: m = nM Mr(СО2) = 1*Ar(C)+2* Ar (O) =12 + 16* 2 = 44 М (СО2) = 44 г/моль m (СО2) = 44 (г/моль)* 0,5 (моль) = 22 г
Ответ: m (СО2) = 22г. |
| Найти: m (СО2) - ? |
Задача 2. Какое количество серной кислоты содержится в 294 г её?
| Дано: M (Н2SO4) = 294 г | Решение: n = m/M Mr (Н2SO4) = 1 *2 + 32 + 16* 4 = 98 M (Н2SO4) = 98 г/моль n (Н2SO4) = 294 * 98 = 3 (моль)
Ответ: n (Н2SO4) = 3 моль. |
| Найти: n (Н2SO4) - ? |
3) V = n * VM
n = V / VM
где n-химическое количество, V – объем, VM – молярный объем, VM = 22,4л/моль
Задание 16.
Задача 1: Какой объем водорода (н.у.) можно получить при взаимодействии 36,5г 10% ‒ ного раствора соляной кислоты с цинком? Сколько ионов соли образуется в данной реакции?
I. Прочитать условие задачи
II. Сделать краткую запись условия задачи по схеме:
 Дано (н.у.): Решение:
Дано (н.у.): Решение:
mр-ра(HCl) = 36,5г
W(HCl) = 10% = 0,1
 Найти:
Найти: 
V(H2) − ? (л)
N(ZnCl2) − ?
III. Решить задачу по памятке:
1. Если вещество дано в виде смеси (раствора), найти массу (объем) чистого вещества по формулам:
а) mв-ва = 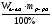 б) mв-ва =
б) mв-ва = 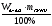 в)
в) 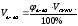
m(HCl) = 36,5∙0,1 = 3,65г
2. Для вещества в чистом виде данные по условию задачи, не выраженные в молях, перевести в количество вещества по формулам:
а) если это масса вещества: n = 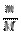 , где {M}={Mr} или {M}={Аr}
, где {M}={Mr} или {M}={Аr}
б) если это объем вещества: n = 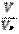 , в) если это число частиц: n =
, в) если это число частиц: n = 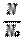 ,
,
Mr(HCl)=1+35,5=36,5 => M(HCl)=36,5 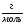 => n (HCl)=
=> n (HCl)= 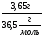 = 0,1
= 0,1 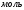
3. Составить уравнение химической реакции. Обязательно проверить правильность расстановки коэффициентов:
Zn + 2HCl = ZnCl2 + H2↑
4. Записать данные выраженные в молях в уравнение реакции:
а) данные по условию задачи (известные и неизвестные) записать над формулами соответствующих веществ с единицами измерения.
Моль x моль у моль
Zn + 2HCl = ZnCl2 + H2↑
б) данные по уравнению реакции записать под формулами веществ (количество вещества определить по коэффициентам перед формулами соответствующих веществ).
Zn + 2 HCl = 1 ZnCl2 + 1 H2↑
Моль 1 моль 1 моль
5. Составить и решить пропорцию:
а) левую часть пропорции записать по одному веществу;
б) правую часть пропорции записать по другому веществу;
в) одна из частей пропорции (левая или правая) должна содержать известные величины.
Моль x моль у моль
Zn + 2HCl = ZnCl2 + H2↑
Моль 1 моль 1 моль
1 пропорция: 2 пропорция:
(HCl) 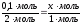 (ZnCl2) (HCl)
(ZnCl2) (HCl) 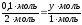 (H2)
(H2)
х = 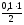 = 0,05 моль у =
= 0,05 моль у = 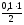 = 0,05 моль
= 0,05 моль
6. Соотнести полученные данные с условием задачи. Использовать формулы перевода для нахождения величины:
а) масса вещества: m = n∙M;
б) объём вещества: V = n∙Vm
в) число частиц (молекул, атомов, ионов) N = n∙Na
x = 0,05моль = n (ZnCl2), а надо и N(ZnCl2) => по формуле (в)
у = 0,05моль = n (H2), а надо V(H2) => по формуле (б)
N(ZnCl2) = 0,05 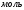 ∙
∙  6,02 ∙ 1023
6,02 ∙ 1023 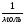 = 0,301 ∙ 1023=3,01 ∙ 1022 (молекул);
= 0,301 ∙ 1023=3,01 ∙ 1022 (молекул);
V(H2) = 0,05 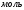 ∙ 22,4
∙ 22,4 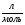 = 1,12
= 1,12 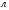
IV Записать ответ задачи.
Ответ: V(H2) = 1,12 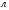 ; N(ZnCl2) = 3,01 ∙ 1022 (ионов)
; N(ZnCl2) = 3,01 ∙ 1022 (ионов)
Дата: 2019-04-23, просмотров: 315.