Выделение воды
Условия, необходимы для того чтобы прошла химическая реакция:
- Соприкосновение (измельчение, перемешивание)
- Нагревание
- Действие электрического тока, света.
- Наличие катализатора
- Концентрация веществ
Задание 2. Атом- это химически неделимые частицы, из-за которых образованы молекулы. ( для благородных газов молекула и атом одно и тоже, Не, Ar)
Атом- электронейтральная частица, состоящая из положительно заряженного ядра, вокруг которого по своим строго определенным законам распределены отрицательно заряженные электроны. Причём суммарный заряд электронов равен заряду ядра.
Ядро атомов состоит из положительно заряженных протонов (р) и нейтронов (n) не несущих никакого заряда. Общее название нейтронов и протонов – нуклоны. Масса протонов и нейтронов практически одинакова.
Электроны (е-) несут отрицательный, заряд равный заряду протона. Масса е- составляет приблизительно 0,05% от массы протона и нейтрона. Таким образом, вся масса атома сосредоточена в его ядре.
Число р в атоме, равные заряду ядра , называется порядковым номером (Z), так как атом электронейтрален число е- равно числу р.
Массовым числом (А) атома называется сумма протонов и нейтронов в ядре. Соответственно число нейтронов в атоме равно разности между А и Z. (массовым числом атома и порядковым номером).(N=А-Z).
1735Cl р=17, N=18, Z=17. 17р+, 18n0, 17е-.
Молекула - мельчайшие частицы вещества, обладающие всеми его химическими свойствами; молекула состоит из атомов.
Химический элемент – это атомы одного и того же вида. Так, например, все атомы водорода – это элемент водород; все атомы кислорода и ртути – соответственно элементы кислород и ртуть.
В настоящее время известно более 107 видов атомов, то есть более 107 химических элементов. Нужно различать понятия “химический элемент”, “атом” и “простое вещество”
Простые и сложные вещества
По элементному составу различают простые вещества, состоящие из атомов одного элемента (H2, O2,Cl2, P4, Na, Cu, Au), и сложные вещества, состоящие из атомов разных элементов (H2O,NH3, OF2, H2SO4, MgCl2,K2SO4).
Способность одного элемента существовать в виде различных простых веществ, отличающихся по свойствам, называется аллотропией.Например, элемент кислород O имеет две аллотропные формы - дикислород O2 и озон O3с различным числом атомов в молекулах.
Аллотропные формы элемента углерод C - алмаз и графит - отличаются строение их кристаллов.Существуют и другие причины аллотропии.
Различие понятий “химический элемент” и “простое вещество”
Отличить понятия “химический элемент” и “простое вещество” можно при сравнении свойств простых и сложных веществ. Например, простое вещество – кислород – бесцветный газ, необходимый для дыхания, поддерживающий горение. Мельчайшая частица простого вещества кислорода – молекула, которая состоит из двух атомов. Кислород входит также всостав оксида углерода (угарный газ) и воды. Однако, в состав воды и оксида углерода входит химически связанный кислород, который не обладает свойствами простого вещества, в частности он не может быть использован для дыхания. Рыбы, например, дышат не химически связанным кислородом, входящим в состав молекулы воды, а свободным, растворенным в ней. Поэтому, когда речь идет о составе каких – либо химических соединений, следует понимать, что в эти соединения входят не простые вещества, а атомы определенного вида, то есть соответствующие элементы.
При разложении сложных веществ, атомы могут выделяться в свободном состоянии и соединяясь, образовывать простые вещества. Простые вещества состоят из атомов одного элемента. Различие понятий «химический элемент» и «простое вещество» подтверждается и тем, что один и тот же элемент может образовывать несколько простых веществ. Например, атомы элемента кислорода могут образовать двухатомные молекулы кислорода и трехатомные – озона. Кислород и озон – совершенно различные простые вещества. Этим объясняется тот факт, что простых веществ известно гораздо больше, чем химических элементов.
Пользуясь понятием «химический элемент», можно дать такое определение простым и сложным веществам:
Задание 3. Физический смысл атомного номера:
Порядковый номер элемента = Заряд ядра атома = Число электронов = Число протонов
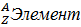
А = N+Z
А – массовое число, N – число нейтронов, Z – заряд ядра
Чтобы найти число нейтронов, необходимо N =А- Z
Запомни!!!! Если массовое число не указано в левом верху, берешь относительную атомную массу и от нее отнимаешь порядковый номер элемента
Пример: Чему равен заряд ядра атома железа, сколько электронов, протонов, нейтронов в этом атоме?
!!!!Порядковый номер элемента = Заряд ядра атома = Число электронов = Число протонов
Следовательно:
Порядковый номер элемента железа – 26. Следовательно, заряд ядра атома - +26, 26 электронов, 26 протонов. Чтобы найти число нейтронов делаем следующее: так как по условию не задано массовое число, берем относительную атомную массу железа. А это 56. От нее отнимаем порядковый номер, а это 26. N = 56-26 = 30
+26 ( Fe ) 26 p . 26 e - , 26 n
Задание 4. Оксиды - это сложные вещества, состоящие из двух химических элементов, один из которых кислород, с валентность равной 2. Лишь один химический элемент - фтор, соединяясь с кислородом, образует не оксид, а фторид кислорода OF2. Называются они просто:
!!!! "оксид + название элемента".
Если валентность химического элемента переменная, то «оксид + название элемента + (валентность римской цифрой)»
Пример:
Кислоты - сложные вещества, состоящие из атомов водорода и кислотного остатка.
!!!!!!Выучить таблицу наизусть
| Название кислоты | Формула | Кислотный остаток | Название кислотного остатка | Заряд кислотного остатка | Валентность кислотного остатка |
| Хлороводородная | HCl | Cl | Хлорид | Cl- | I |
| Азотная | HNO3 | NO3 | Нитрат | NO3- | I |
| Сероводородная | H2S | S | Сульфид | S2- | II |
| Сернистая | H2SO3 | SO3 | Сульфит | SO32- | II |
| Серная | H2SO4 | SO4 | Сульфат | SO42- | II |
| Кремниевая | H2SiO4 | SiO4 | Силикат | SiO42- | II |
| Угольная | H2CO3 | CO3 | Карбонат | CO32- | II |
| Фосфорная | H3PO4 | PO4 | фосфат | PO43- | III |
Основания – это сложные вещества, состоящие из ионов металлов и связанных с ними одного или нескольких гидроксид-ионов.
Чтобы назвать вещество, мы воспользуемся правилом
| слово "гидроксид" | + | название металла в родительном падеже | + | для металлов с переменной степенью окисления (римская цифра, обозначающая числовое значение степени окисления металла) |
Пример: KOH – гидроксид лития, NaOH – гидроксид алюминия, Ca(OH)2 – гидроксид кальция, Cu(OH)2 – гидроксид меди (II)
Соли - сложные вещества, состоящие из атомов металлов (иногда входит водород или гидроксильная группа) и кислотных остатков.
Названия солей:
название кислотного остатка + название металла + указываем валентность для металла с переменной валентностью
Na2SO4- сульфат натрия,
CuSO4- сульфат меди (II)
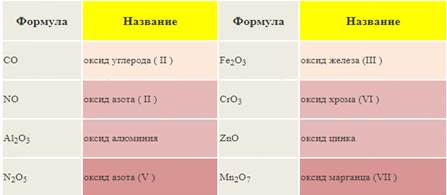
Задание 5. Классификация оксидов
Все оксиды можно разделить на две группы: солеобразующие (основные, кислотные, амфотерные) и несолеобразующие или безразличные.
 |

| Оксиды металлов МехОу | Оксиды неметаллов неМехОу | |||
| Основные | Кислотные | Амфотерные | Кислотные | Безразличные |
| I, II Ме | V-VII Me | ZnO,BeO,Al2O3, Fe2O3, Cr2O3 | > II неМе | I, II неМе CO, NO, N2O |
1). Основные оксиды – это оксиды, которым соответствуют основания. К основным оксидам относятся оксиды металлов 1 и 2 групп, а также металлов побочных подгрупп с валентностью I и II (кроме ZnO - оксид цинка и BeO – оксид бериллия. Они являются амфотерными):
2). Кислотные оксиды – это оксиды, которым соответствуют кислоты. К кислотным оксидам относятся оксиды неметаллов (кроме несолеобразующих – безразличных), а также оксиды металлов побочных подгрупп с валентностью от V до VII (Например, CrO3-оксид хрома (VI), Mn 2O7 - оксид марганца (VII)):
3). Амфотерные оксиды – это оксиды, которым соответствуют основания и кислоты. К ним относятся оксиды металлов главных и побочных подгрупп с валентностью III, иногда IV, а также цинк и бериллий (Например, BeO, ZnO, Al2O3, Cr2O3).
4). Несолеобразующие оксиды – это оксиды безразличные к кислотам и основаниям. К ним относятся оксиды неметаллов с валентностью I и II (Например, N2O, NO, CO).
Классификация кислот:
1)По наличию кислорода:
А)бескслородные (HCl, H2S) Б)кислородсодержащие (H2SO4, HNO3)
2) по числу атомов водорода:
А)одноосновные (HCl) Б)двухосновные (H2S) В)трехосновные (H3PO4)
Задание 6.
Задание 7.
Исходные вещества, принимающие участие в химических реакциях называются реагентами.
Новые вещества, образующиеся в результате химической реакции называются продуктами.
Химическое уравнение – это условная запись химической реакции посредством химических формул.
Задание 11.
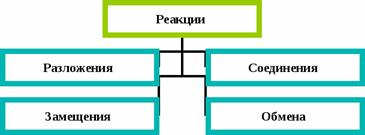
Реакции разложения – это реакции, в результате которых из одного сложного вещества получается несколько простых или новых сложных веществ.
2HgO → 2Hg + O2
2H2O → 2H2 + O2
2H2O2 → 2H2O + O2
Реакции соединения – это такие реакции, в результате которых из одного или нескольких исходных веществ образуется одно сложное вещество.
4P + 5O2 = 2P2O5
P2O5 + 3H2O = 2H3PO4
Задание 12.
Относительная молекулярная масса вещества Mr – это сумма относительных атомных масс элементов, составляющих вещество с учетом индексов.
Пример : Mr(H2O) = 2Ar(H) + Ar(O) = 2*1 + 16 = 18
Mr(CO2) = Ar(C) + 2Ar(O) = 12 + 2*16 = 44
Задание 13.
| ЧТО НЕОБХОДИМО ЗНАТЬ |
Массовая доля – это отношение массы растворенного вещества к общей массе раствора.
-Массовую долю обозначают латинской буквой ω
-Исходя из определения выведите формулу массовой доли в долях и процентах 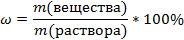 Так как раствор состоить из растворителя (в качестве растворителя чаще всего выступает вода) и растворенного вещества, приобразуем формулу:
Так как раствор состоить из растворителя (в качестве растворителя чаще всего выступает вода) и растворенного вещества, приобразуем формулу:
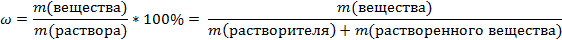 Выведите из этой фрмулы формулу массы вещества
Выведите из этой фрмулы формулу массы вещества
 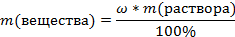
|
Пример 2: Сахар массой 20,5г растворили в 325,5г воды.
Определите массовую долю сахара в полученном растворе.
| Дано m сахара = 20,5 г m (H2O) = 325,5 г |
Решение
1. Запишем формулу для расчёта массовой доли:
w раств-го вещества = m раств-го в-а /mр-ра* 100%
2. Вычислим массу раствора
m р-ра= m раств-го в-ва + m( H 2 O )
mр-ра= 20,5 + 325,5 = 346
3. Вычислим массовую долю сахара
w=20,5/346*100 = 5,9% (или 0,059)
Ответ: w% = 5,9 %
Пример 3. 250 г 10%-го раствора сульфата натрия упарили до 200 г. Какой стала массовая доля сульфата натрия в растворе?
| Дано m1 раствора = 250 г w(в-ва) = 10% m2 раствора = 200 г |
Решение 1. Запишем формулу для расчёта массовой доли: w раств-го вещества = m раств-го в-а /mр-ра* 100% 2. Вычислим массу вещества m в-ва= m р-ра* w в-ва = 250*0,1 = 25г 3. Вычислим массовую долю в-ва во втором растворе w2=25/200*100 = 12,5% (или 0,125) Ответ: w% = 12,5 % |
| Найти w% = ? |
Пример 4. К 150г 40%-го раствора азотной кислоты добавили еще 900г воды. Определите, какой стала массовая доля кислоты
| Дано m1 раствора = 150 г w(в-ва) = 40% mН2О = 900 г |
Решение 1. Запишем формулу для расчёта массовой доли: w раств-го вещества = m раств-го в-а /mр-ра* 100% 2. Вычислим массу вещества m в-ва= m р-ра* w в-ва = 150*0,4 = 60г 3. Вычислим массу нового раствора m р-ра= m раств-го в-ва + m( H 2 O ) mр-ра= 150 + 900 = 1050г 4. Вычислим массовую долю в-ва во втором растворе w2=60/1050*100 = 5,7% Ответ: w% = 5,7 % |
| Найти w% = ? |
Задание 14. 1) n = N / NA , N = NA ∙ n ,
где n – число молей, N – число атомов или молекул, NA – постоянная Авогадро. NA = 6,02∙1023 – постоянная Авогадро
кМоль = 103Моль, мМоль = 10-3Моль.
2)│Mr│=│M│, единицы измерения: г/Моль, кг/Моль, мг/Моль.
n = m / M , m = M ∙ n
Задача 1. Какова масса 0,5 моль оксида углерода (IV) СО2?
| Дано: n (СО2) = 1,5 моль М (СО2) = 44 г/моль | Решение: m = nM Mr(СО2) = 1*Ar(C)+2* Ar (O) =12 + 16* 2 = 44 М (СО2) = 44 г/моль m (СО2) = 44 (г/моль)* 0,5 (моль) = 22 г
Ответ: m (СО2) = 22г. |
| Найти: m (СО2) - ? |
Задача 2. Какое количество серной кислоты содержится в 294 г её?
| Дано: M (Н2SO4) = 294 г | Решение: n = m/M Mr (Н2SO4) = 1 *2 + 32 + 16* 4 = 98 M (Н2SO4) = 98 г/моль n (Н2SO4) = 294 * 98 = 3 (моль)
Ответ: n (Н2SO4) = 3 моль. |
| Найти: n (Н2SO4) - ? |
3) V = n * VM
n = V / VM
где n-химическое количество, V – объем, VM – молярный объем, VM = 22,4л/моль
Задание 16.
Задача 1: Какой объем водорода (н.у.) можно получить при взаимодействии 36,5г 10% ‒ ного раствора соляной кислоты с цинком? Сколько ионов соли образуется в данной реакции?
I. Прочитать условие задачи
II. Сделать краткую запись условия задачи по схеме:
 Дано (н.у.): Решение:
Дано (н.у.): Решение:
mр-ра(HCl) = 36,5г
W(HCl) = 10% = 0,1
 Найти:
Найти: 
V(H2) − ? (л)
N(ZnCl2) − ?
III. Решить задачу по памятке:
1. Если вещество дано в виде смеси (раствора), найти массу (объем) чистого вещества по формулам:
а) mв-ва = 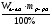 б) mв-ва =
б) mв-ва = 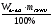 в)
в) 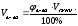
m(HCl) = 36,5∙0,1 = 3,65г
2. Для вещества в чистом виде данные по условию задачи, не выраженные в молях, перевести в количество вещества по формулам:
а) если это масса вещества: n = 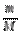 , где {M}={Mr} или {M}={Аr}
, где {M}={Mr} или {M}={Аr}
б) если это объем вещества: n = 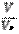 , в) если это число частиц: n =
, в) если это число частиц: n = 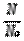 ,
,
Mr(HCl)=1+35,5=36,5 => M(HCl)=36,5 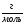 => n (HCl)=
=> n (HCl)= 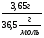 = 0,1
= 0,1 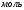
3. Составить уравнение химической реакции. Обязательно проверить правильность расстановки коэффициентов:
Zn + 2HCl = ZnCl2 + H2↑
4. Записать данные выраженные в молях в уравнение реакции:
а) данные по условию задачи (известные и неизвестные) записать над формулами соответствующих веществ с единицами измерения.
Моль x моль у моль
Zn + 2HCl = ZnCl2 + H2↑
б) данные по уравнению реакции записать под формулами веществ (количество вещества определить по коэффициентам перед формулами соответствующих веществ).
Zn + 2 HCl = 1 ZnCl2 + 1 H2↑
Моль 1 моль 1 моль
5. Составить и решить пропорцию:
а) левую часть пропорции записать по одному веществу;
б) правую часть пропорции записать по другому веществу;
в) одна из частей пропорции (левая или правая) должна содержать известные величины.
Моль x моль у моль
Zn + 2HCl = ZnCl2 + H2↑
Моль 1 моль 1 моль
1 пропорция: 2 пропорция:
(HCl) 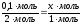 (ZnCl2) (HCl)
(ZnCl2) (HCl) 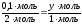 (H2)
(H2)
х = 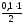 = 0,05 моль у =
= 0,05 моль у = 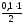 = 0,05 моль
= 0,05 моль
6. Соотнести полученные данные с условием задачи. Использовать формулы перевода для нахождения величины:
а) масса вещества: m = n∙M;
б) объём вещества: V = n∙Vm
в) число частиц (молекул, атомов, ионов) N = n∙Na
x = 0,05моль = n (ZnCl2), а надо и N(ZnCl2) => по формуле (в)
у = 0,05моль = n (H2), а надо V(H2) => по формуле (б)
N(ZnCl2) = 0,05 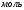 ∙
∙  6,02 ∙ 1023
6,02 ∙ 1023 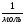 = 0,301 ∙ 1023=3,01 ∙ 1022 (молекул);
= 0,301 ∙ 1023=3,01 ∙ 1022 (молекул);
V(H2) = 0,05 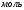 ∙ 22,4
∙ 22,4 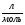 = 1,12
= 1,12 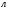
IV Записать ответ задачи.
Ответ: V(H2) = 1,12  ; N(ZnCl2) = 3,01 ∙ 1022 (ионов)
; N(ZnCl2) = 3,01 ∙ 1022 (ионов)
Выделение воды
Условия, необходимы для того чтобы прошла химическая реакция:
- Соприкосновение (измельчение, перемешивание)
- Нагревание
- Действие электрического тока, света.
- Наличие катализатора
- Концентрация веществ
Задание 2. Атом- это химически неделимые частицы, из-за которых образованы молекулы. ( для благородных газов молекула и атом одно и тоже, Не, Ar)
Атом- электронейтральная частица, состоящая из положительно заряженного ядра, вокруг которого по своим строго определенным законам распределены отрицательно заряженные электроны. Причём суммарный заряд электронов равен заряду ядра.
Ядро атомов состоит из положительно заряженных протонов (р) и нейтронов (n) не несущих никакого заряда. Общее название нейтронов и протонов – нуклоны. Масса протонов и нейтронов практически одинакова.
Электроны (е-) несут отрицательный, заряд равный заряду протона. Масса е- составляет приблизительно 0,05% от массы протона и нейтрона. Таким образом, вся масса атома сосредоточена в его ядре.
Число р в атоме, равные заряду ядра , называется порядковым номером (Z), так как атом электронейтрален число е- равно числу р.
Массовым числом (А) атома называется сумма протонов и нейтронов в ядре. Соответственно число нейтронов в атоме равно разности между А и Z. (массовым числом атома и порядковым номером).(N=А-Z).
1735Cl р=17, N=18, Z=17. 17р+, 18n0, 17е-.
Молекула - мельчайшие частицы вещества, обладающие всеми его химическими свойствами; молекула состоит из атомов.
Химический элемент – это атомы одного и того же вида. Так, например, все атомы водорода – это элемент водород; все атомы кислорода и ртути – соответственно элементы кислород и ртуть.
В настоящее время известно более 107 видов атомов, то есть более 107 химических элементов. Нужно различать понятия “химический элемент”, “атом” и “простое вещество”
Простые и сложные вещества
По элементному составу различают простые вещества, состоящие из атомов одного элемента (H2, O2,Cl2, P4, Na, Cu, Au), и сложные вещества, состоящие из атомов разных элементов (H2O,NH3, OF2, H2SO4, MgCl2,K2SO4).
Способность одного элемента существовать в виде различных простых веществ, отличающихся по свойствам, называется аллотропией.Например, элемент кислород O имеет две аллотропные формы - дикислород O2 и озон O3с различным числом атомов в молекулах.
Аллотропные формы элемента углерод C - алмаз и графит - отличаются строение их кристаллов.Существуют и другие причины аллотропии.
Различие понятий “химический элемент” и “простое вещество”
Отличить понятия “химический элемент” и “простое вещество” можно при сравнении свойств простых и сложных веществ. Например, простое вещество – кислород – бесцветный газ, необходимый для дыхания, поддерживающий горение. Мельчайшая частица простого вещества кислорода – молекула, которая состоит из двух атомов. Кислород входит также всостав оксида углерода (угарный газ) и воды. Однако, в состав воды и оксида углерода входит химически связанный кислород, который не обладает свойствами простого вещества, в частности он не может быть использован для дыхания. Рыбы, например, дышат не химически связанным кислородом, входящим в состав молекулы воды, а свободным, растворенным в ней. Поэтому, когда речь идет о составе каких – либо химических соединений, следует понимать, что в эти соединения входят не простые вещества, а атомы определенного вида, то есть соответствующие элементы.
При разложении сложных веществ, атомы могут выделяться в свободном состоянии и соединяясь, образовывать простые вещества. Простые вещества состоят из атомов одного элемента. Различие понятий «химический элемент» и «простое вещество» подтверждается и тем, что один и тот же элемент может образовывать несколько простых веществ. Например, атомы элемента кислорода могут образовать двухатомные молекулы кислорода и трехатомные – озона. Кислород и озон – совершенно различные простые вещества. Этим объясняется тот факт, что простых веществ известно гораздо больше, чем химических элементов.
Пользуясь понятием «химический элемент», можно дать такое определение простым и сложным веществам:
Задание 3. Физический смысл атомного номера:
Порядковый номер элемента = Заряд ядра атома = Число электронов = Число протонов
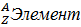
А = N+Z
А – массовое число, N – число нейтронов, Z – заряд ядра
Чтобы найти число нейтронов, необходимо N =А- Z
Запомни!!!! Если массовое число не указано в левом верху, берешь относительную атомную массу и от нее отнимаешь порядковый номер элемента
Пример: Чему равен заряд ядра атома железа, сколько электронов, протонов, нейтронов в этом атоме?
!!!!Порядковый номер элемента = Заряд ядра атома = Число электронов = Число протонов
Следовательно:
Порядковый номер элемента железа – 26. Следовательно, заряд ядра атома - +26, 26 электронов, 26 протонов. Чтобы найти число нейтронов делаем следующее: так как по условию не задано массовое число, берем относительную атомную массу железа. А это 56. От нее отнимаем порядковый номер, а это 26. N = 56-26 = 30
+26 ( Fe ) 26 p . 26 e - , 26 n
Задание 4. Оксиды - это сложные вещества, состоящие из двух химических элементов, один из которых кислород, с валентность равной 2. Лишь один химический элемент - фтор, соединяясь с кислородом, образует не оксид, а фторид кислорода OF2. Называются они просто:
!!!! "оксид + название элемента".
Если валентность химического элемента переменная, то «оксид + название элемента + (валентность римской цифрой)»
Пример:

Кислоты - сложные вещества, состоящие из атомов водорода и кислотного остатка.
!!!!!!Выучить таблицу наизусть
| Название кислоты | Формула | Кислотный остаток | Название кислотного остатка | Заряд кислотного остатка | Валентность кислотного остатка |
| Хлороводородная | HCl | Cl | Хлорид | Cl- | I |
| Азотная | HNO3 | NO3 | Нитрат | NO3- | I |
| Сероводородная | H2S | S | Сульфид | S2- | II |
| Сернистая | H2SO3 | SO3 | Сульфит | SO32- | II |
| Серная | H2SO4 | SO4 | Сульфат | SO42- | II |
| Кремниевая | H2SiO4 | SiO4 | Силикат | SiO42- | II |
| Угольная | H2CO3 | CO3 | Карбонат | CO32- | II |
| Фосфорная | H3PO4 | PO4 | фосфат | PO43- | III |
Основания – это сложные вещества, состоящие из ионов металлов и связанных с ними одного или нескольких гидроксид-ионов.
Чтобы назвать вещество, мы воспользуемся правилом
| слово "гидроксид" | + | название металла в родительном падеже | + | для металлов с переменной степенью окисления (римская цифра, обозначающая числовое значение степени окисления металла) |
Пример: KOH – гидроксид лития, NaOH – гидроксид алюминия, Ca(OH)2 – гидроксид кальция, Cu(OH)2 – гидроксид меди (II)
Соли - сложные вещества, состоящие из атомов металлов (иногда входит водород или гидроксильная группа) и кислотных остатков.
Названия солей:
название кислотного остатка + название металла + указываем валентность для металла с переменной валентностью
Na2SO4- сульфат натрия,
CuSO4- сульфат меди (II)
Задание 5. Классификация оксидов
Все оксиды можно разделить на две группы: солеобразующие (основные, кислотные, амфотерные) и несолеобразующие или безразличные.
 |

| Оксиды металлов МехОу | Оксиды неметаллов неМехОу | |||
| Основные | Кислотные | Амфотерные | Кислотные | Безразличные |
| I, II Ме | V-VII Me | ZnO,BeO,Al2O3, Fe2O3, Cr2O3 | > II неМе | I, II неМе CO, NO, N2O |
1). Основные оксиды – это оксиды, которым соответствуют основания. К основным оксидам относятся оксиды металлов 1 и 2 групп, а также металлов побочных подгрупп с валентностью I и II (кроме ZnO - оксид цинка и BeO – оксид бериллия. Они являются амфотерными):
2). Кислотные оксиды – это оксиды, которым соответствуют кислоты. К кислотным оксидам относятся оксиды неметаллов (кроме несолеобразующих – безразличных), а также оксиды металлов побочных подгрупп с валентностью от V до VII (Например, CrO3-оксид хрома (VI), Mn 2O7 - оксид марганца (VII)):
3). Амфотерные оксиды – это оксиды, которым соответствуют основания и кислоты. К ним относятся оксиды металлов главных и побочных подгрупп с валентностью III, иногда IV, а также цинк и бериллий (Например, BeO, ZnO, Al2O3, Cr2O3).
4). Несолеобразующие оксиды – это оксиды безразличные к кислотам и основаниям. К ним относятся оксиды неметаллов с валентностью I и II (Например, N2O, NO, CO).
Классификация кислот:
1)По наличию кислорода:
А)бескслородные (HCl, H2S) Б)кислородсодержащие (H2SO4, HNO3)
2) по числу атомов водорода:
А)одноосновные (HCl) Б)двухосновные (H2S) В)трехосновные (H3PO4)
Задание 6.
Задание 7.
Исходные вещества, принимающие участие в химических реакциях называются реагентами.
Новые вещества, образующиеся в результате химической реакции называются продуктами.
Химическое уравнение – это условная запись химической реакции посредством химических формул.
Правила составления химических уравнений
(презентация на экране).
1. В левой части уравнения записать формулы веществ, вступающих в реакцию (реагентов). Затем поставить стрелку.
а) N2 + H2 →
2. В правой части (после стрелки) записать формулы веществ, образующихся в результате реакции (продуктов). Все формулы составляются в соответствии со степенью окисления.
а) N2 + H2 → NH3
3. Уравнение реакции составляется на основе закона сохранения массы веществ, т. е. слева и справа должно быть одинаковое число атомов. Это достигается расстановкой коэффициентов перед формулами веществ.
Дата: 2019-04-23, просмотров: 277.