ГЛАВА 6
ПЕРЕЛИВАНИЕ КРОВИ И КРОВЕЗАМЕНИТЕЛЕЙ
Появление способов восполнения кровопотери значительно расширило возможности хирургии. Это позволило не только спасать пациентов от массивных кровотечений, но и выполнять большие травматичные хирургические вмешательства. В настоящее время сформировалась отдельная отрасль науки, специальная дисциплина, рассматривающая самые разнообразные аспекты переливания крови, её компонентов и заменителей, - трансфузиология.
Общие вопросы трансфузиологии
Успехи современной клинической медицины неразрывно связаны с широким внедрением методов трансфузиологии на различных этапах лечения больных.
Трансфузиология (transfusio - переливание, смешивание; logos - учение) - раздел медицинской науки об управлении функциями организма путём целенаправленного воздействия на морфологический состав крови с помощью переливания цельной крови, её компонентов, а также кровезаменителей и других средств.
Основные трансфузионные средства:
• кровь и её компоненты (эритроцитарная, лейкоцитарная и тромбоцитарная массы, плазма крови); переливание крови и её компонентов называют гемотрансфузией;
• кровезаменители - лечебные растворы, предназначенные для замещения утраченных или нормализации нарушенных функций крови.
Трансфузиология изучает также миелотрансплантацию (пересадку костного мозга) - эффективный метод лечения гемобластозов (злокачественных поражений органов кроветворения) и средство коррекции различных видов угнетения кроветворения.
Организация трансфузиологической службы
Трансфузиологическая служба - сеть специальных организаций, предназначенных для обеспечения лечебных учреждений кровью, её компонентами и кровезаменителями.
В состав трансфузиологической службы Российской Федерации входят Гематологический научный центр Российской Академии медицинских наук, научно-исследовательские институты Министерства здравоохранения и социального развития, станции и отделения переливания крови, а также кабинеты трансфузионной терапии.
Гематологический научный центр РАМН и научно-исследовательские институты - консультативные, организационные и методические центры, где разрабатывают методические инструкции и рекомендации, проводят семинары и конференции для информации медицинских работников об основных достижениях трансфузиологии, ведут научно-исследовательскую работу по созданию и внедрению в практику новых трансфузионных средств.
Станции и отделения переливания крови комплектуют донорские кадры, обследуют доноров и ведут их учёт, заготавливают и хранят кровь и её компоненты. Здесь определяют группу крови и резус-принадлежность крови доноров и больных, проводят профилактику посттрансфузионных осложнений. На станциях и в отделениях переливания крови создают необходимый запас крови на случай стихийных бедствий, аварий и катастроф, эпидемий и других чрезвычайных обстоятельств. Здесь проводят обучение врачей основам трансфузиологии, осуществляют контроль за состоянием трансфузиологической помощи в лечебных учреждениях.
В небольших стационарах, не имеющих в своей структуре отделения переливания крови, в настоящее время организуют кабинеты трансфузионной терапии.
Донорство в России
Людей, добровольно дающих свою кровь (или орган) для введения (пересадки) больным, называют донорами. Больных, получающих донорские органы и ткани, называют реципиентами.
Донорство (donore - дарить) - добровольная дача части крови, её компонентов, костного мозга, тканей или органов для их применения с лечебной целью.
Донорство - основной источник крови, её препаратов и компонентов. Развитие донорства, обеспечение комплекса социальных, экономических, правовых, медицинских мер, защита прав донора регламентированы Законом Российской Федерации.
Группы доноров
Существуют безвозмездные и кадровые доноры, активные доноры и доноры резерва, иммунные доноры.
Безвозмездное донорство как явление возникло в 60-х годах, когда люди сдавали свою кровь без денежной компенсации. Кровью безвозмездных доноров обеспечена работа многих лечебных учреждений, особенно центральных районных больниц.
Кадровые доноры (платное донорство) систематически участвуют в донорстве на протяжении многих лет. Они находятся под постоянным врачебным наблюдением и подвергаются регулярному медицинскому обследованию.
Доноров, сдающих кровь регулярно, называют активными. Они имеют донорские книжки и дают расписку в том, что не болели гепатитом, сифилисом и другими инфекциями, а также обязуются информировать донорский пункт в случае заболевания ими.
Донорами резерва называют лиц, хотя бы однократно сдавших кровь и согласных на сдачу крови в случае потребности в этом учреждения, где они состоят на учёте.
Особую группу доноров составляют иммунные доноры, в крови которых содержатся антитела к антигенам различной специфичности в достаточном титре. Основную массу иммунных доноров подвергают намеренной иммунизации введением специфических антигенов - стафилококкового анатоксина, столбнячного анатоксина и др. Гипериммунную плазму у доноров забирают в несколько приёмов. В настоящее время получены и с успехом применяются в клинике иммунные препараты для лечения гриппа, столбняка, холеры, клещевого энцефалита, дифтерии, неклостридиальной и клостридиальной анаэробных инфекций и др.
Охрана здоровья доноров
В России принят Закон «О донорстве крови и её компонентов» (№5142-1 от 9 июня 1993 г.), регламентирующий все вопросы, связанные с донорством, а также определяющий права и обязанности доноров.
В соответствии с Законом донорство - добровольный акт. Донором может быть каждый дееспособный гражданин от 18 до 60 лет, прошедший медицинское обследование. Государство гарантирует ему защиту прав и охрану здоровья. Взятие крови и её компонентов допустимо только при условии, что здоровью донора не будет причинён ущерб. Разовая доза забора крови не должна превышать 500 мл. У доноров, дающих кровь впервые, а также у доноров до 20 лет и старше 50 лет рекомендуется забор не более 300 мл крови. Повторную сдачу крови разрешают не ранее чем через 60 дней при условии полного восстановления параметров гомеостаза. Общее количество заборов не должно быть более пяти в год. Существенной разницы в сроках восстановления крови после сдачи крови между мужчинами и женщинами нет. Вместе с тем многолетний опыт показывает, что женщины, как правило, лучше переносят процедуру взятия крови.
Донорам, регулярно сдающим кровь, предоставляют дополнительные льготы. Лиц, сдавших кровь 40 раз и более, награждают нагрудным знаком «Почётный донор России» с получением дополнительных льгот по оказанию медицинской помощи, приобретению лекарств, оплате коммунальных услуг, получению путевок на санаторно-курортное лечение и т.д.
Обследование доноров
Подбор доноров проводят по единым медицинским критериям, что обеспечивает безвредность, высокую активность и эффективность крови и её компонентов.
Каждый донор перед сдачей крови проходит обследование: у него собирают анамнез, проводят тщательный медицинский осмотр и специальное обследование для выявления противопоказаний к сдаче крови и исключения возможности передачи с кровью возбудителей инфекционных заболеваний. Проводят серологическое, вирусологическое и бактериологическое обследования донорской крови.
Успехи клинической трансфузиологии снижают опасность передачи с кровью и её компонентами возбудителей инфекционных заболеваний (ВИЧ-инфекции, гепатитов В и С, сифилиса, цитомегаловирусной инфекции и др.).
Клеточные антигены
Клеточные антигены - сложные углеводно-белковые комплексы (гликопептиды), структурные компоненты мембраны клеток крови. От других компонентов клеточной мембраны они отличаются иммуногенностью и серологической активностью.
Иммуногенность - способность антигенов индуцировать синтез антител, если они попадают в организм, у которого эти антигены отсутствуют.
Серологическая активность - способность антигенов соединяться с одноимёнными антителами.
Молекула клеточных антигенов состоит из двух компонентов:
- шлеппер (белковая часть антигена, расположенная во внутренних слоях мембраны), определяющий иммуногенность;
- гаптен (полисахаридная часть антигена, расположенная в поверхностных слоях клеточной мембраны), определяющий серологическую активность.
На поверхности гаптена расположены антигенные детерминанты (эпитопы) - молекулы углеводов, к которым присоединяются антитела. Известные антигены крови отличаются друг от друга эпитопами.
Например, гаптены антигенов системы АВ0 имеют следующий набор углеводов: эпитоп антигена 0 - фукоза, антигена А - N-ацетилгалактозамин, антигена В - галактоза. С ними и соединяются групповые антитела.
Различают три вида клеточных антигенов:
- эритроцитарные;
- лейкоцитарные;
- тромбоцитарные.
Эритроцитарные антигены
Известно более 250 антигенов эритроцитов, образующих свыше 20 антигенных систем. Клиническое значение имеет 11 систем: АВ0, Резус (Rh-Hr), MNSs, Келл (Kell), Лютеран (Lutheran), Кидд (Kidd), Диего (Diego), Даффи (Duffy), Домброк (Dombrock), ферментные группы эритроцитов.
У человека в эритроцитах присутствуют одновременно антигены нескольких антигенных систем.
Основными в трансфузиологии признаны антигенные системы АВ0 и Резус. Другие антигенные системы эритроцитов в настоящее время существенного значения в клинической трансфузиологии не имеют.
Антигенная система АВ0
Система АВ0 - основная серологическая система, определяющая совместимость или несовместимость переливаемой крови. Её составляют два генетически детерминированных агглютиногена (антигены А и В) и два агглютинина (антитела α и β).
Агглютиногены А и В содержатся в строме эритроцитов, а агглютинины α и β - в сыворотке крови. Агглютинин α - антитело по отношению к агглютиногену А, а агглютинин β - по отношению к агглютиногену В. В эритроцитах и сыворотке крови одного человека не может быть одноимённых агглютиногенов и агглютининов. При встрече одноимённых антигенов и антител возникает реакция изогемагглютинации. Именно эта реакция - причина несовместимости крови при гемотрансфузии.
В зависимости от сочетания в эритроцитах антигенов А и В (и соответственно в сыворотке антител α и β) всех людей разделяют на четыре группы.
Антигенная система Резус
Резус-фактор (Rh-фактор), названный так вследствие того, что впервые был обнаружен у макак резус, присутствует у 85% людей, а у 15% отсутствует.
В настоящее время известно, что система Резус достаточна сложна и представлена пятью антигенами. Роль резус-фактора при гемотрансфузии, а также при беременности крайне велика. Ошибки, приводящие к развитию резус-конфликта, вызывают тяжёлые осложнения, а иногда и смерть больного.
Второстепенные антигенные системы
Второстепенные эритроцитарные групповые системы представлены большим количеством антигенов. Знание этого множества систем имеет значение для решения некоторых вопросов в антропологии, судебно-медицинских исследований, а также для предотвращения развития посттрансфузионных осложнений и некоторых заболеваний у новорождённых.
Система MNSs включает факторы М, N, S, s. Доказано наличие двух тесно сцепленных между собой генных локусов MN и Ss. В дальнейшем были выявлены другие многообразные варианты антигенов системы MNSs. По химической структуре MNSs - гликопротеиды.
Система Р. Система антигена Р имеет определённое клиническое значение. Отмечены случаи ранних и поздних выкидышей, причиной которых стали изоантитела анти-Р . Описано несколько случаев посттрансфузионных осложнений, связанных с несовместимостью донора и реципиента по системе антигенов Р.
Система Келл представлена тремя парами антигенов. Наибольшей иммуногенной активностью обладают антигены Келл (К) и Челлано (к). Антигены системы Келл могут вызывать сенсибилизацию организма во время беременности и при переливании крови, становиться причиной гемотрансфузионных осложнений и развития гемолитической болезни новорождённых.
Система Лютеран. Один из доноров по фамилии Лютеран имел в эритроцитах крови какой-то ранее неизвестный антиген, приведший к иммунизации реципиента. Антиген был обозначен буквами Lu а. Через несколько лет был открыт второй антиген этой системы Lu b. Их частота: Lu а - 0,1%, Lu b - 99,9%. Антитела анти-Lu b изоиммунные, что подтверждено и сообщениями о значении этих антител в происхождении гемолитической болезни новорождённых. Клиническое значение антигенов системы Лютеран невелико.
Система Кидд. Антигены и антитела системы Кидд имеют определённое практическое значение. Они могут быть причиной развития гемолитической болезни новорождённых и посттрансфузионных осложнений при многократном переливании крови, не совместимой по антигенам этой системы. Частота антигенов составляет около 75%.
Система Диего. В 1953 г. в Венесуэле в семье Диего родился ребёнок с признаками гемолитической болезни. При выяснении причины этого заболевания у ребёнка был обнаружен ранее неизвестный антиген, обозначенный фактором Диего (Di). В 1955 г. проведённые исследования выявили, что антиген Диего - расовый признак, характерный для народов монголоидной расы.
Система Даффи состоит из двух основных антигенов - Fy а и Fy b. Антитела анти-Fy а - неполные антитела, они проявляют своё действие только в непрямом антиглобулиновом тесте Кумбса. Позднее были обнаружены антигены Fy x, Fy3, Fy4, Fy5. Частота зависит от расовой принадлежности человека, что имеет большое значение для антропологов. В негроидных популяциях частота фактора Fy a - 25%, среди китайского населения, эскимосов и аборигенов Австралии - почти 100%, у людей европеоидной расы - 60-82%.
Система Домброк. В 1973 г. были выявлены антигены Do а и Do b. Фактор Do а встречают в 55-60% случаев, а фактор Do b - в 85-90%. Такая частота выдвигает эту серологическую систему крови на пятое место по информативности в аспекте судебно-медицинского определения отцовства (система Резус, MNSs, AB0 и Даффи).
Ферментные группы эритроцитов. Начиная с 1963 г. стало известно значительное количество генетически полиморфных ферментных систем эритроцитов крови человека. Эти открытия сыграли значительную роль в развитии общей серологии групп крови человека, а также в аспекте судебно-медицинской экспертизы спорного отцовства. К ферментным системам эритроцитов относят фосфатглюкомутазу, аденозиндезаминазу, глутамат-пируват-трансаминазу, эстеразу-Д и др.
Лейкоцитарные антигены
В мембране лейкоцитов существуют антигены, аналогичные эритроцитарным, а также специфичные для этих клеток антигенные комплексы, называемые лейкоцитарными антигенами. Впервые сведения о лейкоцитарных группах получил французский исследователь Ж. Доссе в 1954 г. Первым был выявлен антиген лейкоцитов, встречающийся у 50% европейского населения. Этот антиген был назван «Мак». В настоящее время насчитывают около 70 антигенов лейкоцитов, их разделяют на три группы:
• общие антигены лейкоцитов (HLA - Human Leucocyte Antigen);
• антигены полиморфно-ядерных лейкоцитов;
• антигены лимфоцитов.
Система HLA
Система HLA имеет наибольшее клиническое значение. Она включает более 120 антигенов. Только по этой антигенной системе насчитывают 50 млн лейкоцитарных групп крови. HLA-антигены универсальны. Они содержатся в лимфоцитах, полиморфно-ядерных лейкоцитах (гранулоцитах), моноцитах, тромбоцитах, а также в клетках почек, лёгких, печени, костного мозга и других тканях и органах. Поэтому их ещё называют антигенами гистосовместимости.
По рекомендации ВОЗ используют следующую номенклатуру системы HLA:
• HLA - Human Leucocyte Antigen - обозначение системы;
• А, В, С, D - генные локусы, или регионы, системы;
• 1, 2, 3 - номера аллелей внутри генного локуса системы HLA;
• W - символ для обозначения недостаточно изученных антигенов.
Система HLA - наиболее сложная из всех известных систем антигенов. Генетически HLA-антигены принадлежат к четырём локусам (А, В, С, D), каждый из которых объединяет аллельные антигены. Иммунологическое исследование, позволяющее определить антигены гистосовместимости, называют тканевым типированием.
HLA-система имеет большое значение при трансплантации органов и тканей. Аллоантигены системы HLA-локусов А, В, С, D, а также агглютиногены классических групп крови системы АВ0 представляют собой единственно достоверно известные антигены гистосовместимости. Для предупреждения быстрого отторжения пересаженных органов и тканей необходимо, чтобы реципиент имел ту же, что и донор, группу крови системы АВ0 и не имел антител к аллоантигенам HLA-генных локусов А, В, С, D донорского организма.
HLA-антигены имеют значение также при переливании крови, лейкоцитов и тромбоцитов. Различие беременной и плода по антигенам HLA-системы при повторных беременностях может привести к выкидышу или гибели плода.
Антигены полиморфно-ядерных лейкоцитов
Другая система антигенов лейкоцитов - антигены гранулоцитов (NA-NB). Это органоспецифическая система. Антигены гранулоцитов обнаружены в полиморфно-ядерных лейкоцитах и клетках костного мозга. Антитела против антигенов гранулоцитов имеют значение при беременности. Они вызывают кратковременную нейтропению новорождённых, играют важную роль в развитии негемолитических трансфузионных реакций, способных вызывать гипертермические посттрансфузионные реакции и укорочение жизни гранулоцитов донорской крови.
Антигены лимфоцитов
Третью группу антигенов лейкоцитов составляют тканеспецифические лимфоцитарные антигены. К ним относят антиген Ly и др. Выделено 7 антигенов популяции В-лимфоцитов: от HLA-DRw1 до HLA-DRw7Значение этих антигенов остаётся малоизученным.
Тромбоцитарные антигены
В мембране тромбоцитов существуют антигены, аналогичные эритроцитарным и лейкоцитарным, а также свойственные только этим клеткам крови - тромбоцитарные антигены. Известны антигенные системы Zw, PL, Ко. Особого клинического значения они не имеют.
Плазменные антигены
Плазменные (сывороточные) антигены - определённые комплексы аминокислот или углеводов, расположенные на поверхности молекул белков плазмы (сыворотки) крови.
Антигенные различия, свойственные белкам плазмы крови, объединяют в 10 антигенных систем (Нр, Gc, Tf, Inv, Gm и др.). Наиболее сложной из них и клинически значимой считают антигенную систему Gm, присущую иммуноглобулинам (включает 25 антигенов). Различия людей по антигенам плазменных белков создают плазменные (сывороточные) группы крови.
Понятие о группе крови
Согласно современным данным иммуногематологии, можно следующим образом сформулировать понятие «группа крови».
Группа крови - сочетание нормальных иммунологических и генетических признаков крови, наследственно детерминированное биологическое свойство каждого индивидуума.
Группы крови передаются по наследству, формируются на 3-м или 4-м месяце внутриутробного развития и остаются неизменными в течение всей жизни. Считают, что у человека группа крови включает несколько десятков антигенов в различных сочетаниях. Этих сочетаний - групп крови - реально может быть несколько миллиардов. Практически они одинаковы лишь у однояйцовых близнецов, имеющих один и тот же генотип.
В практической медицине термин «группа крови», как правило, отражает сочетание эритроцитарных антигенов системы АВ0, резус-фактора и соответствующих антител в сыворотке крови.
Групповые антитела
Для каждого известного антигена обнаружены одноимённые антитела (анти-А, анти-В, анти-резус, анти-Келл и т.д.). Групповые антитела крови - не такое постоянное свойство организма человека, как антигены. Лишь в групповой системе АВ0 антитела - нормальное врождённое свойство плазмы крови. Эти антитела (агглютинины α и β) постоянно присутствуют в плазме крови человека, определённым образом сочетаясь с агглютиногенами (антигенами) эритроцитов.
Групповые антитела бывают врождёнными (например, агглютинины α и β) и изоиммунными, образующимися в ответ на поступление чужеродных групповых антигенов (например, антитела системы Резус).
Врождённые антитела - так называемые полные антитела, это агглютинины, вызывающие агглютинацию (склеивание) эритроцитов, содержащих соответствующий антиген. Их относят к холодовым антителам, так как они лучше проявляют своё действие in vitro при низких температурах и слабее реагируют при высокой температуре.
Полные антитела относят к иммуноглобулинам класса М. Молекулярная масса этих антител 900 000-1000 000 Да, наибольший размер 100 нм. Молекула содержит четыре цепочки аминокислот, участки между концами их цепей - активные центры (паратопы, антидетерминанты), которыми антитела соединяются с антигенными детерминантами, расположенными на клетках крови. Антитела класса М имеют 10 активных центров, поэтому они могут соединяться одновременно с антигенными детерминантами нескольких клеток крови.
Изоиммунные антитела неполные. Они с трудом поддаются абсорбции и не разрушаются при нагревании. Эти антитела тепловые (наиболее активны при температуре 37°С и выше) и агглютинируют клетки крови только в коллоидной среде.
Неполные антитела относят к классу IgG. Молекулярная масса составляет около 150 000-160 000 Да, наибольший размер 25 нм. Строение молекулы схоже со строением молекулы полных антител, но отличается последовательностью аминокислот и количеством активных центров: у неполных антител их два (каждое антитело связывает две антигенных детерминанты).
Группы крови по системе АВ0
Антигенная система АВ0 имеет основное значение в совместимости крови при переливании.
Под термином «совместимость» понимают сочетание крови донора и реципиента по антигенам и антителам, не вызывающее иммунологических взаимодействий.
Классические группы крови АВ0
В зависимости от наличия в эритроцитах агглютиногенов А и В, а в сыворотке соответствующих им агглютининов α и β, всех людей делят на четыре группы:
• группа 0(I): в эритроцитах агглютиногенов нет, в сыворотке присутствуют агглютинины α и β;
• группа А(II): в эритроцитах - агглютиноген А, в сыворотке - агглютинин β;
• группа В(Ш): в эритроцитах присутствует агглютиноген В, в сыворотке выявляют агглютинин α;
• группа АВ(IV): в эритроцитах - агглютиногены А и В, агглютининов в сыворотке нет.
В последнее время в системе АВ0 обнаружены разновидности классических антигенов А и В, а также другие антигены.
Подтипы антигена А
Антиген А нельзя считать однородным, существует два основных его подтипа: А1 и А2. Эритроциты с подтипом агглютиногена А1 встречают намного чаще, чем с подтипом А2 (88% и 12% соответственно). Поэтому при наличии агглютиногена А1его обозначают просто как А, а обозначение с индексом применяют только для относительно редко го агглютиногена А2. В соответствии с этим группа А(II) имеет две подгруппы: А(II) и А2(II), а группа АВ(IV) - АВ(IV) и А2B(IV) (табл. 6-1). Агглютиногены А 1и А2 отличаются друг от друга по свойствам.
Таблица 6-1. Группы крови по системе АВ0
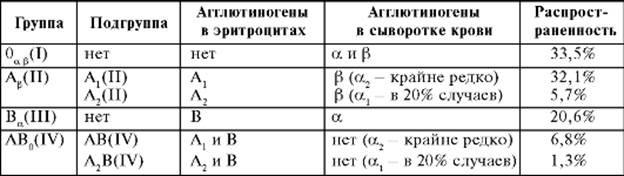
• Подтип А1 обладает большей адсорбционной возможностью по сравнению с агглютиногеном А2, он сильнее адсорбирует агглютинин a из сыворотки, поэтому его называют сильным, а подтип А2 - слабым.
• Эритроциты с агглютиногеном А2 имеют более низкую агглютинабельность.
• Подгруппы с агглютиногенами А1 и А2 обладают различными свойствами сывороток. Сыворотка подгрупп А2 (II) и А2В (IV) довольно часто содержит агглютинин, названный Ландштейнером и Левином экстраагглютинином a1, дающим агглютинацию только с эритроцитами А1 и не дающим агглютинации с эритроцитами А2. В то же время в сыворотке подгрупп А(II) и АВ(IV) довольно редко, но встречается экстраагглютинин a2, не агглютинирующий эритроциты А1, а дающий агглютинацию с эритроцитами А2.
Существуют варианты эритроцитов с ещё более слабовыраженными агглютинабельными свойствами, что связано с наличием в них подтипов А3, А4, Az и др. Несмотря на то, что эти слабые антигены встречают довольно редко, они имеют определённое клиническое значение.
Подтипы антигена В
Групповой антиген В отличается большей однородностью. Описанные редкие его варианты (В2, В3, Bw и др.) существенного клинического значения не имеют.
Антиген 0 и субстанция Н
Позже в первой группе крови 0(I) была найдена специфическая субстанция, также обозначенная символом «0». Фактор 0 - агглютиноген, присущий эритроцитам групп 0(I), А2(II), А2B(IV).
Для эритроцитов всех групп характерно наличие субстанции Н, её считают общим веществом-предшественником. Субстанцию Н чаще встречают у лиц с первой группой крови, в других же она содержится в незначительном количестве. У некоторых жителей индийского города Бомбей обнаружена группа, не содержащая агглютиногенов 0, А, В, Н, но содержащая антитела α, β, анти-0 и анти-Н. Впоследствии этот редкий тип крови, обнаруженный и у жителей других стран, получил название «тип Бомбей».
«Кровяные химеры»
В настоящее время известны так называемые кровяные химеры, обусловленные одновременным пребыванием в организме человека эритроцитов, принадлежащих двум фенотипам АВ0. В естественных условиях явление кровяной химеры встречают у близнецов. Оно может также появиться при пересадке аллогенного костного мозга или переливании массивных объёмов крови. При определении группы крови и резус-принадлежности в условиях наличия кровяной химеры, как правило, получают искажённый результат.
Способы определения группы крови
Групповую принадлежность крови по системе АВ0 определяют с помощью реакции агглютинации. В настоящее время используют три способа определения групп крови по системе АВ0:
• с помощью стандартных изогемагглютинирующих сывороток;
• с помощью стандартных изогемагглютинирующих сывороток и стандартных эритроцитов (перекрёстный способ);
• с помощью моноклональных антител (цоликлонов анти-А и анти-В).
Существует следующая общепринятая тактика при определении группы крови.
При плановом исследовании врач стационара определяет группу крови с помощью стандартных изогемагглютинирующих сывороток, или цоликлонов, после чего посылает кровь в серологическую лабораторию для проверки группы перекрёстным методом.
Группу крови считают определённой только в том случае, если лаборатория подтвердила данные, полученные врачом стационара. Если результаты исследований расходятся, оба исследования нужно повторить.
При необходимости определения группы крови в экстренном порядке (при кровотечении необходимо срочное переливание крови) врач стационара определяет группу крови сам (в лаборатории перепроверку выполняют, но постфактум). В таких случаях также используют реакции с изогемагглютинирующими сыворотками (или поликлонами), но при возможности целесообразно применение перекрёстного метода.
Определение групп крови с помощью стандартных изогемагглютинирующих сывороток
Этот способ в настоящее время наиболее распространён в клинической и лабораторной практике.
Суть метода сводится к обнаружению в исследуемой крови групповых антигенов А и В с помощью стандартных изогемагглютинирующих сывороток. Для этого используют реакцию агглютинации. Постановку реакции проводят в помещении с хорошим освещением при температуре 15-25°С.
Необходимое оснащение
1. Стандартные изогемагглютинирующие сыворотки групп 0(I), A(II), В(III) и АВ(IV) двух различных серий. Сыворотки для определения групп крови изготавливают в специальных серологических лабораториях из донорской крови. Сыворотки хранят при температуре 4-8 °С (в холодильнике). Срок годности сыворотки указан на этикете. Титр сыворотки (также указан на этикетке) должен быть не ниже 1:32 (для сыворотки В(Ш) - не ниже 1:16/32). Под титром сыворотки понимают то максимальное её разведение, при котором может наступать реакция агглютинации. Сыворотка должна быть прозрачной. Для удобства стандартные гемагглютинирующие сыворотки различных групп подкрашивают так, чтобы они имели определённый цвет: 0(I) - бесцветная, А(II) - синяя, В(III) - красная, АВ(IV) - ярко-жёлтая. Следует отметить, что указанные цвета сопутствуют всем этикеткам на препаратах крови, имеющих групповую принадлежность (кровь, эритроцитарная масса, плазма и др.).
2. Белые фарфоровые или эмалированные тарелки, или любые другие; пластинки со смачиваемой поверхностью, маркированные 0(I), А(П), В(Ш), AB(IV).
3. Изотонический раствор хлорида натрия.
4. Иглы, пипетки, стеклянные палочки (предметные стёкла).
Методика проведения реакции
1. Перед началом реакции подписывают тарелку (наносят фамилию и инициалы исследуемого), после чего на неё под соответствующие обозначения наносят стандартные изогемагглютинирующие сыворотки I, II и III групп в объёме 0,1 мл (капля около 1 см в диаметре). Во избежание ошибок наносят две серии сывороток каждой из групп, так как одна из серий может иметь низкую активность и не дать чёткой агглютинации. Всего получается шесть капель, образующих два ряда по три капли в следующем порядке слева направо: 0(I), А(П), В(Ш).
2. Кровь для исследования берут из пальца или из вены. Шесть капель исследуемой крови величиной приблизительно с булавочную головку (0,01 мл, маленькая капля) последовательно переносят сухой стеклянной палочкой на пластину в шесть точек, каждую - рядом с каплей стандартной сыворотки (количество исследуемой крови должно быть приблизительно в 10 раз меньше количества стандартной сыворотки, с которой её смешивают), потом их осторожно с помощью стеклянных палочек с закруглёнными краями перемешивают.
Возможна более простая методика: на тарелку наносят одну большую каплю крови, из которой её забирают уголком предметного стекла и переносят в каждую каплю сыворотки, аккуратно перемешивая с последней. При этом всякий раз кровь берут новым уголком стекла, следя за тем, чтобы капли не сливались.
3. После смешивания тарелку периодически покачивают.
Агглютинация начинается в течение первых 10-30 с, однако наблюдение следует обязательно вести до 5 мин ввиду возможности более поздней агглютинации, например с эритроцитами группы A2(II).
4. В те капли, где произошла агглютинация, добавляют по одной капле изотонического раствора хлорида натрия, после чего оценивают результат реакции.
Трактовка результатов
Реакция агглютинации может быть положительной или отрицательной. При положительной реакции обычно в течение первых 10- 30 с в смеси появляются видимые невооружённым взглядом мелкие красные зёрнышки (агглютинаты), состоящие из склеенных эритроцитов. Мелкие зёрнышки постепенно сливаются в более крупные зёрна, а иногда в хлопья неправильной формы. При этом сыворотка частично или полностью обесцвечивается. Положительная реакция может быть пескообразной или лепестковой (рис. 6-1).
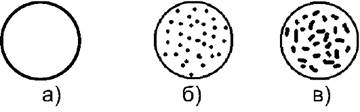
Рис. 6-1. Виды агглютинации: а - агглютинации нет; б - пескообразная агглютинация; в - лепестковая агглютинация
При отрицательной реакции капля остаётся равномерно окрашенной в красный цвет, в ней не обнаруживают никаких зёрнышек (агглютинатов).
Результаты реакций в каплях с сыворотками одной и той же группы (двух серий) должны совпадать.
Принадлежность исследуемой крови к соответствующей группе определяют по наличию или отсутствию агглютинации при реакции с соответствующими сыворотками после наблюдения в течение 5 мин (табл. 6-2).
При этом следует отметить, что если сыворотки всех трёх групп дали положительную реакцию, это указывает на то, что испытуемая кровь содержит оба агглютиногена (А и В) и принадлежит к группе AB(IV). Однако в таких случаях для исключения неспецифической реакции агглютинации необходимо провести дополнительное контрольное исследование испытуемой крови со стандартной изогемагглютинирующей сывороткой группы AB(IV), не содержащей агглютининов. Лишь отсутствие агглютинации в этой капле при наличии агглютинации в каплях, содержащих стандартные сыворотки групп 0(I), А(II) и В(III), позволяет считать реакцию специфической и отнести исследуемую кровь к группе АВ0(IV).
Таблица 6-2. Оценка результатов реакции со стандартными изогемагглютинирующими сыворотками
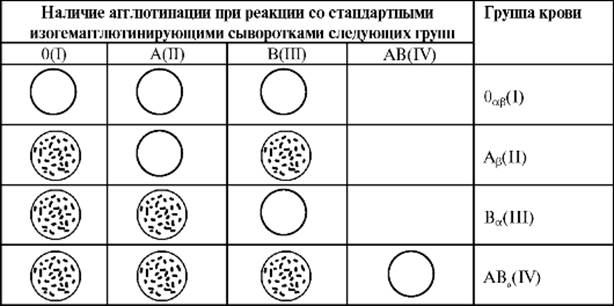
Следует отметить, что при наличии в исследуемой крови слабого антигена А2 реакция агглютинации с гемагглютинирующими сыворотками групп 0(I) и B(III) начинается позже (на 3-4-й мин).
Идентификацию подгрупп антигена А проводят в серологической лаборатории с помощью специальных экстрактов из семян Dolichos biflorus и Ulex Europeus. Первый из них агглютинирует эритроциты с антигеном А1, но не реагирует с антигеном А2, а второй - наоборот.
Определение групп крови перекрёстным способом
Способ наиболее часто используют в серологических лабораториях. Суть метода состоит в определении наличия или отсутствия в исследуемой крови групповых антигенов А и В с помощью стандартных изогемагглютинирующих сывороток, а также групповых антител α и β с помощью стандартных эритроцитов. Реакцию со стандартными сыворотками проводят описанным выше способом.
Реакцию со стандартными эритроцитами проводят следующим образом.
Необходимое оснащение
Оснащение для реакции со стандартными эритроцитами отличается тем, что для её проведения необходимы стандартные эритроциты трёх групп крови: 0(I), А(II), B(III). Стандартные эритроциты приготавливают из крови доноров с заранее известной группой крови, хранят при 4-8 °С. Срок годности 2-3 дня.
Методика проведения реакции
1. Кровь для исследования берут из вены в сухую пробирку, центрифугируют или оставляют в покое на 20-30 мин для получения сыворотки.
2. На маркированную тарелку пипеткой наносят три больших капли (0,1 мл) сыворотки исследуемой крови из пробирки, а рядом с ними - по одной маленькой капле (0,01 мл) стандартных эритроцитов групп.
3. Дальнейшие мероприятия проводят аналогично методу с использованием стандартных изогемагглютинирующих сывороток: соответствующие капли смешивают стеклянными палочками, планшет покачивают, наблюдают в течение 5 мин, в капли с агглютинацией добавляют изотонический раствор хлорида натрия, после чего оценивают результат.
Таблица 6-3. Оценка результатов определения группы крови перекрёстным способом
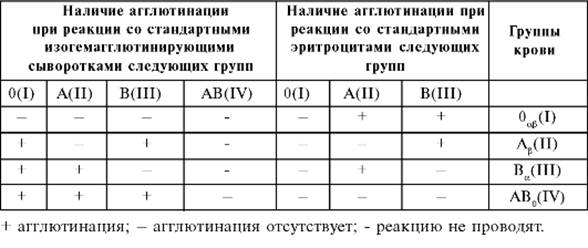
Трактовка результатов
Оценивают данные, полученные при обеих реакциях (со стандартными изогемагглютинирующими сыворотками и стандартными эритроцитами - табл. 6-3).
Особенность трактовки результатов реакции со стандартными эритроцитами - эритроциты группы 0(I) считают контрольными (в них нет антигенов, что делает принципиально невозможной специфическую реакцию агглютинации с любой сывороткой).
Результат перекрёстного способа считают достоверным, только если при оценке результатов реакции со стандартными изогемагглютинирующими сыворотками и со стандартными эритроцитами ответы о группе исследуемой крови совпадают. Если этого не происходит, обе реакции следует переделать.
Возможные ошибки
Определение групповой принадлежности с помощью реакции агглютинации может сопровождаться ошибками, ведущими к неверной трактовке результатов.
Все ошибки можно разделить на три группы:
• низкое качество реагентов;
• технические ошибки;
• особенности исследуемой крови.
Низкое качество реагентов
Стандартные изогемагглютинирующие сыворотки и стандартные эритроциты могут иметь низкие агглютинабельные свойства, что приводит к неверному толкованию результатов реакции. Во избежание подобных ошибок нужно следить за сроком годности, условиями хранения и внешним видом реагента (прозрачность сыворотки, отсутствие плёнок, хлопьев, запаха гниения и пр.).
Технические ошибки
Ошибки технического характера связаны с несоблюдением или недостаточно точным выполнением всех правил проведения реакции.
Несоблюдение внешних условий
Плохая освещённость мешает обнаружить агглютинацию или её отсутствие.
Повышение температуры выше 25 °С резко замедляет реакцию.
При низкой температуре (ниже 15 °С) может произойти неспецифическая агглютинация, независимо от состава агглютининов и агглютиногенов - так называемая холодовая панагглютинация (агглютинация возникает при реакциях с сыворотками всех групп крови). Это происходит из-за наличия в сыворотке особого холодового агглютинина, способного давать реакцию агглютинации только при низких температурах.
Неправильное проведение самой реакции
Нарушение расположения сывороток, соотношения сыворотки и крови, слияние соседних капель создают возможность неправильной интерпретации полученных результатов.
Ранняя оценка результатов также может привести к ошибке, особенно при наличии слабого антигена А2, дающего позднюю агглютинацию.
Недобавление физиологического раствора. Несоблюдение этого простого правила (в капли, где произошла агглютинация, следует добавить изотонический раствор хлорида натрия) может привести к тому, что за специфическую агглютинацию принимают ложную (псевдоагглютинацию). Под термином «псевдоагглютинация» подразумевают способность эритроцитов склеиваться в «монетные столбики», или «кучки», с сохранением мембран, независимо от их агглютинабельных свойств. Границы между форменными элементами хорошо видны под микроскопом, в отличие от истинной агглютинации, при которой происходит разрушение мембран эритроцитов. Добавление 1-2 капель изотонического раствора хлорида натрия позволяет дифференцировать истинную агглютинацию от ложной. Псевдоагглютинация расходится довольно быстро, в то время как истинная агглютинация сохраняется прежней или становится более выраженной.
Особенности исследуемой крови
Развитие неспецифической панагглютинации может быть связано не только с низкой температурой, но и с качествами самой крови.
Панагглютинацию при бактериальном заражении исследуемой крови в 1927 г. описал Томсен. Этот феномен (феномен Томсена) характеризуется агглютинацией крови с сыворотками всех групп и сывороткой собственной крови.
Сущность явления заключается в том, что сыворотка при комнатной температуре даёт агглютинацию со всеми эритроцитами, даже со своими собственными (аутоагглютинация), а эритроциты в то же время дают агглютинацию со всеми сыворотками, даже с сыворотками группы AB(IV).
Подобное явление описано при различных заболеваниях: болезнях крови, спленомегалии, циррозе печени, инфекционных заболеваниях и т.д. Панагглютинацию крайне редко наблюдают и у здоровых людей. Панагглютинацию и аутоагглютинацию выявляют только при комнатной температуре; при температуре, близкой к температуре человеческого тела, этих явлений не происходит.
Во избежание ошибок необходимо не допускать определения группы крови при температуре ниже 15 ?С. Если при определении групповой принадлежности агглютинация происходит с сыворотками групп 0(I), A(II) и B(III) всегда следует проводить реакцию с сывороткой группы AB(IV). Только в том случае, если в этой капле не будет агглютинации, можно исключить панагглютинацию и отнести кровь к группе AB0(IV). При наличии агглютинации с сывороткой AB(IV) необходимо подогреть кровь до 37 ?С и провести реакцию при этой температуре, при этом панагглютинация и аутоагглютинация исчезают.
При некоторых заболеваниях отмечают снижение агглютинабельности агглютиногенов эритроцитов (хронические инфекционные заболевания, онкологические заболевания, болезни крови и др.). При этом так же, как и при наличии слабого антигена A2, следует чётко соблюдать условия и время реакции.
Определение резус-фактора
Возможные ошибки
Чаще всего ошибки бывают следствием методических погрешностей при проведении исследования, в особенности при использовании конглютинационных методов. К ложным результатам могут привести неправильное соотношение между сывороткой и эритроцитами, преждевременная оценка результатов, оценка результатов по высыхающей капле, определение резус-фактора в гемолизированном и длительно хранящемся образце крови, а также использование неактивных, инфицированных и загнивших сывороток или сывороток с истекшим сроком годности.
Причиной ошибок могут быть биологические особенности испытуемой крови: снижение агглютинабельности резус-антигена при некоторых заболеваниях печени, почек, системы крови, а также неспецифическая агглютинация испытуемых эритроцитов. B случае сомнительных результатов исследование повторяют, применяя более активные антирезусные сыворотки.
Показания к гемотрансфузии
Для определения показаний к гемотрансфузии необходимо знать механизм влияния на организм пациента перелитой крови.
Механизм действия перелитой крови
Биологические эффекты гемотрансфузии обусловлены сложнейшими регуляторными механизмами. Перелитая кровь действует на элементы нервной рецепции, а также ферментные и гормональные системы обмена, изменяя его на всех уровнях: от молекулярного до органно-тканевого.
Перелитая кровь оказывает на организм реципиента следующие эффекты:
• заместительный;
• гемодинамический;
• иммунологический;
• гемостатический;
• стимулирующий.
Заместительный эффект
Заместительное действие заключается в возмещении утраченной организмом части крови. Введённые в организм эритроциты восстанавливают объём крови и её газотранспортную функцию. Лейкоциты повышают иммунные способности организма. Тромбоциты корригируют систему свёртывания крови.
Плазма и альбумин обладают гемодинамическим действием. Иммуноглобулины плазмы создают пассивный иммунитет. Факторы свёртывания крови и фибринолиза регулируют агрегатное состояние крови. Вводимые вместе с кровью питательные вещества (жиры, белки и углеводы) включаются в цепь биохимических реакций.
Эритроциты перелитой крови функционируют в сосудистом русле реципиента до 30 сут и более. Клетки белой крови покидают сосудистое русло вскоре после переливания, белки плазмы донорской крови циркулируют в сосудистом русле реципиента 18-36 дней.
Гемодинамический эффект
Переливание крови оказывает всестороннее воздействие на сердечно-сосудистую систему. У больных с острой кровопотерей и травматическим шоком оно приводит к стойкому увеличению ОЦК, увеличению венозного притока к правым отделам сердца, усилению работы сердца и повышению минутного объёма крови.
Улучшается микроциркуляция: расширяются артериолы и венулы, раскрывается сеть капилляров, в них ускоряется движение крови, сокращаются артериовенозные шунты, в результате чего редуцируется утечка крови из артериальной системы в венозную. Через 24- 48 ч после переливания крови у реципиента начинается усиленный приток тканевой лимфы в кровеносное русло, что также увеличивает ОЦК. Поэтому иногда после трансфузии прирост ОЦК превосходит объём перелитой крови.
Иммунологический эффект
Гемотрансфузия усиливает иммунологические свойства организма реципиента. За счёт введения гранулоцитов, макрофагов, лимфоцитов, компонентов комплемента, иммуноглобулинов, цитокинов, различные антибактериальных и антитоксических антител возрастает фагоцитарная активность лейкоцитов, активируется образование антител.
Особенно высоким иммунобиологическим действием обладают гипериммунные препараты плазмы, полученные от иммунизированных доноров, - антистафилококковая, антисинегнойная и противоожоговая плазма, иммуноглобулины направленного действия (антистафилококковый, противококлюшный, противостолбнячный иммуноглобулины и др.).
Гемостатический эффект
Переливание крови оказывает стимулирующее действие на систему гемостаза реципиента, вызывая умеренную гиперкоагуляцию, обусловленную увеличением тромбопластической и снижением антикоагулянтной активности крови. Переливание небольших доз (обычно 250 мл) тёплой крови или крови с малым сроком хранения (до 3 сут) оказывает гемостатическое действие благодаря активности вводимых с ней тромбоцитов и прокоагулянтов - факторов свёртывающей системы.
Особым гемостатическим действием обладают специальные виды плазмы (например, антигемофильная) и гемостатические препараты (фибриноген, криопреципитат, протромбиновый комплекс, тромбоцитарная масса и плазма, обогащённая тромбоцитами).
B то же время переливание массивных доз донорской крови в отдельных случаях может нарушить гемостатический баланс вплоть до развития синдрома диссеминированного внутрисосудистого свёртывания крови (ДBС-синдрома).
Стимулирующий эффект
После переливания крови в организме развиваются изменения, аналогичные стрессу. Происходит стимуляция гипоталамо-гипофизарно-адреналовой системы, что подтверждается увеличением содержания кортикостероидов в крови и моче реципиентов в посттрансфузионном периоде.
У реципиентов повышается основной обмен, увеличивается дыхательный коэффициент, усиливается газообмен.
Переливание крови оказывает стимулирующее действие на факторы естественного иммунитета: повышаются фагоцитарная активность гранулоцитов и образование антител в ответ на действие тех или иных антигенов.
Абсолютные и относительные показания к гемотрансфузии
Все показания к переливанию крови и её компонентов можно разделить на абсолютные и относительные.
Абсолютные показания
К абсолютным показаниям относят случаи, когда выполнение гемотрансфузии обязательно, а отказ от неё может привести к резкому ухудшению состояния больного или его смерти.
К абсолютным показаниям относят следующие:
• острая кровопотеря (более 21% ОЦК);
• травматический шок II-III степени.
• обширные операции с большой интраоперационной кровопотерей.
Относительные показания
Все остальные показания к гемотрансфузии, когда переливание крови играет лишь вспомогательную роль среди других лечебных мероприятий, считают относительными.
Основные относительные показания к гемотрансфузии:
• анемия;
• заболевания воспалительного характера с тяжёлой интоксикацией;
• продолжающееся кровотечение;
• нарушения свёртывающей системы крови;
• снижение иммунного статуса организма;
• длительные хронические воспалительные процессы со снижением регенерации и реактивности;
• некоторые отравления.
Учитывая распространённость кровезамещающих препаратов, выполняющих большую часть функций крови, в настоящее время основным относительным показанием к гемотрансфузии считают анемию. Считают, что переливание крови становится методом выбора при снижении содержания гемоглобина ниже 80 г/л, а гематокрита - ниже 30%.
Противопоказания к гемотрансфузии
Гемотрансфузия связана с введением в организм значительного количества продуктов распада белков, что приводит к увеличению функциональной нагрузки на органы дезинтоксикации и выделения. Bведение дополнительного объёма жидкости в сосудистое русло существенно увеличивает нагрузку на сердечно-сосудистую систему. Гемотрансфузия приводит к активизации всех видов обмена в организме, что может привести к обострению и стимуляции патологических процессов (хронических воспалительных заболеваний, опухолей и пр.).
Выделяют абсолютные и относительные противопоказания к переливанию крови.
Абсолютное противопоказание к гемотрансфузии - острая сердечно-лёгочная недостаточность, сопровождающаяся отёком лёгких.
Однако при массивной кровопотере и травматическом шоке IIIII степени абсолютных противопоказаний для переливания нет, и кровь следует переливать всегда.
Относительные противопоказания: свежие тромбозы и эмболии, тяжёлые расстройства мозгового кровообращения, ишемическая болезнь сердца, септический эндокардит, пороки сердца, миокардиты с недостаточностью кровообращения III степени, гипертоническая болезнь III стадии, тяжёлые функциональные нарушения печени и почек, серьёзные аллергические заболевания (бронхиальная астма, поливалентная аллергия), остротекущий и диссеминированный туберкулёз, ревматизм, особенно с ревматической пурпурой. При указанных заболеваниях прибегать к гемотрансфузии следует с особой осторожностью.
Способы переливания крови
По способу введения крови гемотрансфузии разделяют на внутривенные и внутриартериальные (внутрикостные в настоящее время не применяют). B подавляющем большинстве случаев кровь вводят в организм больного внутривенно капельно. Лишь при массивной кровопотере с резким ослаблением сердечной деятельности и крайне низким AД прибегают к внутриартериальному нагнетанию крови.
По виду используемой крови методы переливания можно разделить на две принципиально различные группы:
• переливание собственной крови (аутогемотрансфузия);
• переливание донорской крови.
Аутогемотрансфузия
Основная черта аутогемотрансфузии, определяющая её несомненное преимущество, - отсутствие иммунологических реакций на переливаемую кровь и передачи с кровью инфекционных заболеваний.
Поэтому аутогемотрансфузия показана прежде всего больным с редкими группами крови при невозможности подбора донора, пациентам с нарушенными функциями почек и печени, в случае наличия в анамнезе трансфузионных реакций на донорскую кровь и её компоненты.
Аутогемотрансфузию осуществляют двумя способами:
• трансфузия собственной заранее заготовленной крови;
• реинфузия крови.
Трансфузия заранее заготовленной крови
Такой метод аутогемотрансфузии применяют при плановых операциях, сопровождающихся массивной кровопотерей. Используют либо однократный метод забора крови, либо ступенчато-поэтапный метод. Противопоказания к заготовке крови с последующей гемотрансфузией включают исходную анемию и тяжёлые сопутствующие заболевания.
При однократном методе забора крови её рекомендуют забирать не менее чем за 72 ч до операции или же прямо перед операцией - метод аутогемотрансфузии в сочетании с изоволемической гемодилюцией. Проводят эксфузию в объёме 400-500 мл крови, возмещая её кровезамещающим раствором. Переливают кровь в конце операции после завершения основного по травматичности этапа или в раннем послеоперационном периоде. Однократный забор применяют при операциях с относительно небольшой кровопотерей.
Ступенчато-поэтапный метод позволяет накопить значительный (800 мл и более) объём крови путём чередования эксфузии и трансфузии ранее заготовленной аутокрови (метод «прыгающей лягушки»). Например, у больного забирают 400 мл крови, заместив кровезамещающим раствором или донорской плазмой. Через несколько дней забирают 600 мл крови, параллельно возмещая кровопотерю предварительно забранными 400 мл крови и кровезаменителями. Ещё через несколько дней аналогичным образом осуществляют забор уже 800 мл крови с возвращением 600 мл крови, забранной ранее, и введением плазмозамещающих средств. В результате в распоряжении врача к моменту операции будет достаточный запас свежей крови (800 мл).
Реинфузия крови
Реинфузия - разновидность аутогемотрансфузии, она заключается в переливании больному его собственной крови, излившейся в закрытые полости организма (грудную или брюшную), а также в операционную рану.
При реинфузии кровь собирают в асептических условиях специальными черпаками или с помощью стерильных трубок и добавляют стабилизатор (гепарин натрий и др.). После этого кровь фильтруют (наиболее просто - через 8 слоёв марли), собирают в стерильные флаконы (полиэтиленовые пакеты) и переливают через систему для гемотрансфузии (с фильтром) внутривенно.
В настоящее время созданы специальные аппараты для реинфузии крови пациента, теряемой в ходе операции («Cell Saver», «Haemolyte» и др.). В современной литературе эта процедура получила название «salvage» (salvage, англ. - спасение имущества). Эти устройства позволяют собирать кровь, стабилизировать, фракционировать, отмывать эритроциты, накапливать в специальных ёмкостях и реинфузировать через включённый в систему фильтр.
Противопоказания к реинфузии:
• нахождение крови в полости более 12 ч (возможность дефибринирования и инфицирования);
• сопутствующее повреждение полых органов (желудка, кишечника).
Во всех остальных случаях при массивном скоплении крови в полости или ране реинфузия становится методом выбора. Наиболее широко её применяют при нарушенной внематочной беременности, разрыве кисты яичника, разрыве селезёнки, внутриплевральном кровотечении, травматичных операциях на костях таза, бедренной кости, позвоночнике.
Переливание донорской крови
В качестве трансфузионной среды используют кровь донора. При этом переливание крови и её компонентов может быть непрямым (посредственным) и обменным.
Непрямое переливание
Непрямое переливание крови - основной метод гемотрансфузии. Он отличается простотой выполнения и несложным техническим оснащением, при нём исключены опасность инфицирования донора и отрицательный психологический эффект присутствия донора при переливании.
Важно, что такой метод даёт возможность заготовки большого количества донорской крови, используемой затем как в плановом, так и в экстренном порядке.
При непрямом переливании заготовку крови в специальные флаконы (пакеты) с консервантом осуществляют в плановом режиме на станциях и в отделениях переливания крови. Заготовленная кровь, хранящаяся в определённых условиях, составляет так называемый банк крови.
При необходимости проводят переливание тёплой донорской крови: вызывают донора резерва, забирают у него кровь во флакон (пакет) со стабилизатором (цитратом) и непосредственно после забора, не позже чем через 3 ч, в другом помещении эту кровь переливают реципиенту.
Таким образом, переливают тёплую свежую кровь (свежецитратную), сохранившую все свои функции, но момент забора крови у донора и гемотрансфузия реципиенту разделены во времени и пространстве, что исключает всякий риск заражения донора.
В настоящее время после заготовки кровь фракционируют и хранят обычно её компоненты (эритроцитарную массу, плазму и др.).
Метод имеет и недостатки: в процессе хранения кровь и её компоненты теряют некоторые ценные целебные свойства, а наличие консервантов может вызывать побочные реакции у реципиента.
Обменное переливание
Обменное переливание крови - частичное или полное удаление крови из кровеносного русла реципиента с одновременным замещением её адекватным или превышающим объёмом донорской крови. Основная цель этой операции - удаление вместе с кровью вредных для организма продуктов гемолиза, антител, ядов и т.д.
Обменное переливание крови применяют при гемолитической желтухе новорождённых (Rh-конфликт), массивном внутрисосудистом гемолизе, тяжёлых отравлениях и пр.
Методика гемотрансфузии
Переливание крови и её компонентов выполняет лечащий врач, дежурный врач, врач отделения или кабинета переливания крови, а во время операции - хирург или анестезиолог, непосредственно не участвующий в операции или проведении наркоза. В подавляющем большинстве случаев используют непрямое переливание консервированной донорской крови. При этом врач должен выполнить определённые требования.
Порядок действий врача при переливании крови
Порядок действий врача при переливании крови следующий:
1. Определить показания к гемотрансфузии, выявить противопоказания, собрать трансфузиологический анамнез.
2. Определить группу крови и резус-фактор реципиента.
3. Bыбрать соответствующую (одногруппную и однорезусную) кровь и макроскопически оценить её годность.
4. Перепроверить группу крови донора (из флакона) по системе AB0.
5. Провести пробу на индивидуальную совместимость по системе AB0.
6. Провести пробу на индивидуальную совместимость по Rh.
7. Провести биологическую пробу.
8. Bыполнить гемотрансфузию.
9. Заполнить документацию.
10. Осуществить наблюдение за пациентом после гемотрансфузии. Определение показаний и противопоказаний к гемотрансфузии, группы крови по системе AB0 и резус-фактору проводят по общим правилам, изложенным выше.
Сбор трансфузионного анамнеза
Необходимо выяснить у пациента, знает ли он свои группу крови и резус-фактор (информацию используют как дополнительные сведения), были ли в прошлом переливания крови и её компонентов, не было ли при этом каких-либо осложнений.
Женщин расспрашивают о количестве беременностей и их осложнений (особенно у резус-отрицательных женщин).
Макроскопическая оценка годности крови
Врач, проводящий гемотрансфузию, должен быть уверен в том, что трансфузионная среда пригодна для переливания. Для этого проводят визуальный контроль флакона или контейнера с кровью или её компонентами.
При визуальном контроле необходимо отметить следующие факты:
1. Правильность паспортизации (наличие этикетки с номером, даты заготовки, обозначения группы и резус-принадлежности, наименования консерванта, фамилии и инициалов донора, наименования учреждения-заготовителя, подписи врача).
2. Срок годности. Раньше при использовании в качестве консерванта глюгицира обозначали только дату заготовки крови, при этом переливать кровь можно было в течение 21 дня. В последнее время применение новых консервантов дало возможность увеличить этот срок (максимально до 35 сут). Поэтому срок годности в настоящее время обозначают на этикетке наряду с датой заготовки.
3. Герметичность упаковки. Недопустимо малейшее нарушение её целостности (в том числе следы прокалывания крышки флакона иглой).
4. Кровь должна быть разделена на три слоя (внизу - красные эритроциты, выше - узкая серая полоса лейкоцитов и тромбоцитов, над ними - жёлтая прозрачная плазма). Трёхслойность характерна только для цельной крови, хранящейся в стеклянных флаконах.
5. Плазма должна быть прозрачной, не содержать плёнок и хлопьев (инфицированная кровь), а также сгустков, не иметь красной окраски (гемолиз). Плазма может быть непрозрачной при так называемой хилёзной крови (высокое содержание нейтральных жиров). При нагревании хилёзной крови в термостате до 37 °С плазма становится прозрачной (в случае инфицированной крови - остаётся мутной).
Если при макроскопической оценке хотя бы одно из представленных требований не выполнено, такую кровь переливать нельзя.
Пробы на индивидуальную совместимость
Пробы на индивидуальную совместимость проводят в процессе подготовки к гемотрансфузии. Ставят две реакции: пробу на индивидуальную совместимость по системе АВ0 и по резус-фактору. Для постановки реакций необходимо получить сыворотку реципиента. Поэтому предварительно у него из вены берут кровь, которую разделяют на сгусток и сыворотку (отстаиванием или центрифугированием).
Проба на индивидуальную совместимость по системе АВ0
На белую поверхность (тарелку, пластинку) наносят крупную каплю (0,1 мл) сыворотки крови реципиента и маленькую каплю (0,01 мл) крови донора из флакона, смешивают их между собой, периодически покачивая тарелку (пластинку). Реакцию проводят при температуре 15-25 °С, результаты оценивают через 5 мин: отсутствие агглютинации эритроцитов донора свидетельствует о совместимости крови донора и реципиента по системе АВ0. Появление агглютинации указывает на их несовместимость - такую кровь данному больному переливать нельзя.
Проба на индивидуальную совместимость по резус-фактору
После того как установлена совместимость крови донора и реципиента по системе АВ0, необходимо установить совместимость в отношении резус-фактора. Пробу на совместимость по резус-фактору проводят с использованием 33% декстрана (ср. мол. масса 50 000- 70 000).
Реакцию проводят в центрифужной пробирке без подогрева в течение 5 мин. На дно пробирки вносят 2 капли сыворотки реципиента, 1 каплю донорской крови и 1 каплю 33% раствора декстрана (ср. мол. масса 50 000-70 000). После этого содержимое перемешивают, наклоняя пробирку и вращая её вокруг оси, распределяя содержимое по стенкам ровным слоем. Пробирку вращают в течение 5 мин, после чего добавляют 3-4 мл физиологического раствора и аккуратно перемешивают, 2-3 раза наклоняя пробирку до горизонтальной плоскости (не взбалтывая!). После этого оценивают результат: наличие агглютинации эритроцитов свидетельствует о несовместимости крови донора и реципиента по резус-фактору, такую кровь переливать нельзя. Равномерное окрашивание содержимого в пробирке, отсутствие реакции агглютинации указывает на совместимость крови донора и реципиента по резус-фактору.
При совместимости крови донора и реципиента по системе АВ0 и резус-фактору можно приступать к дальнейшим операциям. Однако у некоторых реципиентов (при наличии неполных скрытых или блокирующих антител, низкой активности иммунных антител) указанные пробы не выявляют несовместимости. Поэтому определённой категории лиц проводят индивидуальный подбор крови.
Индивидуальный подбор донорской крови
Индивидуальный подбор донорской крови необходим следующим группам реципиентов:
• Изоиммунизированные предшествующими гемотрансфузиями или беременностями.
• Перенёсшие гемотрансфузионное осложнение.
• Нуждающиеся в массивной гемотрансфузии.
• При невозможности подобрать кровь обычными пробами на совместимость.
Индивидуальный подбор выполняют в специальных лабораториях, для этого необходимо особое оснащение. Проводят более чувствительные пробы на совместимость (реакция агглютинации в солевой среде, непрямая проба Кумбса, проба на совместимость с желатином).
При переливании индивидуально подобранной крови врач, осуществляющий гемотрансфузию, обязан выполнить все описанные выше контрольные исследования, в том числе и пробы на индивидуальную совместимость.
Биологическая проба
Несмотря на определение совместимости крови донора и больного по системе АВ0 и резус-фактору, нельзя быть уверенным в полной их совместимости.
Существует большое количество второстепенных групповых систем, способных стать причиной развития осложнений. Для исключения этой возможности в начале гемотрансфузии проводят ещё одну пробу на совместимость - биологическую пробу.
Сначала струйно переливают 15 мл крови, затем трансфузию прекращают (перекрывают капельницу) и в течение 3 мин наблюдают за состоянием больного. При отсутствии клинических проявлений реакции или осложнения (боль в пояснице, за грудиной, учащение пульса, дыхания, снижение АД, появление одышки, затруднение дыхания, гиперемия лица и т.д.) вводят вновь 15 мл крови и в течение 3 мин снова наблюдают за больным. Процедуру проводят ещё раз (всего трижды).
Отсутствие реакций у больного после трёхкратной проверки - признак совместимости вливаемой крови, это служит основанием для осуществления всей гемотрансфузии.
При несовместимости крови донора и реципиента во время биологической пробы поведение пациента становится беспокойным: появляются тахикардия, одышка, гиперемия лица, ощущение озноба или жара, стеснение в груди, боли в животе и очень важный признак - боли в поясничной области. При появлении этих признаков кровь считают несовместимой, гемотрансфузию не проводят.
Классическую биологическую пробу не проводят при переливании крови пациенту, находящемуся под наркозом (иммунные реакции замедлены, отсутствуют жалобы, недостаточно стабильны гемодинамические показатели).
В таких случаях признаками несовместимости крови считают необоснованное снижение АД, учащение пульса, появление гиперемии кожи по ходу вены, в которую переливают кровь, или изменение цвета кожных покровов лица и туловища больного. Важнейший метод своевременного выявления несовместимости крови донора и реципиента во время наркоза - контроль диуреза (скорость диуреза, цвет мочи).
Снижение скорости или прекращение диуреза, изменение окраски мочи (моча цвета «мясных помоев») - грозные признаки несовместимости переливаемой донорской крови. Вопрос о дальнейшей трансфузионной терапии решает анестезиолог совместно с оперирующим хирургом.
Осуществление гемотрансфузии
При отсутствии признаков биологической несовместимости начинают капельное переливание крови. Перед трансфузией флакон с переливаемой кровью должен находиться при комнатной температуре в течение 30-40 мин, а в экстренных ситуациях его подогревают до 37 °С на водяной бане (под контролем термометра!). Переливание проводят с помощью одноразовой системы для переливания крови с фильтром, обычно со скоростью 40-60 капель в мин.
В течение гемотрансфузии продолжают наблюдение за состоянием больного: выясняют жалобы, определяют пульс, АД и температуру тела, следят за цветом кожных покровов.
После переливания контейнер или флакон с остатками трансфузионной среды (около 15 мл) и сыворотку реципиента хранят в течение 2 сут в холодильнике, чтобы можно было провести анализ гемотрансфузионных осложнений в случае их развития.
Заполнение документации
Перед гемотрансфузией врач пишет в истории болезни больного предтрансфузионный эпикриз, включающий трансфузионный и акушерский анамнез, показания к переливанию, наименование и дозу трансфузионной среды.
После окончания трансфузии врач записывает в истории болезни протокол переливания крови:
• показания к трансфузии;
• паспортные данные с каждого флакона: фамилия донора, группа крови, резус-принадлежность, номер флакона, дата заготовки крови;
• группа крови и Rh-фактор реципиента и донора;
• результаты проб на индивидуальную совместимость крови донора и реципиента по системе АВ0 и Rh-фактору;
• результат биологической пробы;
• наличие реакций и осложнений;
• дата, фамилия врача, переливавшего кровь, подпись.
Соответствующую запись с указанием основных данных истории болезни пациента (ФИО, возраст, диагноз, номер истории болезни) врач производит и в специальном «Журнале регистрации переливания крови, её компонентов и препаратов».
Наблюдение за больным после гемотрансфузии
Реципиент после переливания крови соблюдает в течение 3 ч постельный режим, за ним наблюдают врачи в течение суток.
Особенно тщательное наблюдение проводят в течение первых 3 ч после гемотрансфузии. Оценивают наличие жалоб, изменение общего состояния, каждый час измеряют температуру тела, пульс и АД. Эти данные фиксируют в истории болезни.
Необходимо макроскопически оценить первую порцию мочи после переливания крови, обратить внимание на объём диуреза и окраску мочи (при гемотрансфузионных осложнениях моча приобретает бурую окраску). После переливания крови под наркозом на операционном столе следует вывести мочу катетером и также оценить её макроскопически.
На следующий день обязательно выполнение клинического анализа крови и общего анализа мочи.
Виды цельной крови
Свежецитратная донорская кровь
Заготавливают на растворах среднего кислого цитрата натрия, используют в течение 1-3 ч после забора у донора. По эффективности переливание такой крови аналогично прямому переливанию крови, но метод проще и безопаснее для донора. Применяют при нарушениях свёртывающей системы крови реципиента.
Консервированная донорская кровь
Заготавливают на одном из консервирующих растворов. В состав консервирующего раствора входят стабилизатор крови, консервант (обычно раствор глюкозы), антисептические средства. Срок годности такой крови для переливания 21-35 дней - в зависимости от вида консерванта.
Таблица 6-6. Виды цельной крови, её компоненты и препараты

При использовании растворов «глюгицир» или «цитроглюкофосфат» - 21 день, «цитроглюфад» - 35 дней.
Следует отметить, что не все функции крови сохраняются весь период хранения. С гемостатической целью следует переливать кровь, имеющую срок хранения не более 2-3 сут, иммунные свойства сохраняются до 5-7 сут. В течение всего срока хранения в той или иной степени поддерживается способность эритроцитов осуществлять транспорт кислорода.
В настоящее время переливание цельной донорской крови используют реже в связи с переходом к принципиально новой тактике - компонентной гемотерапии.
Аутологичная кровь
Применяют для аутогемотрансфузии (вливания заранее заготовленной собственной крови реципиента) и реинфузии (возврата больному собственной, крови, излившейся в серозные полости или операционную рану). Для предотвращения свёртывания к крови добавляют гепарин натрий или один из стабилизаторов.
Понятие о компонентной гемотерапии
До недавнего времени цельную консервированную донорскую кровь считали единственным наиболее эффективным универсальным средством лечения. В настоящее время углублённое изучение влияния цельной крови на организм реципиента позволило сделать вывод о том, что гемотрансфузии представляют значительный риск. При переливании цельной крови реципиент получает, помимо необходимых ему компонентов (например, эритроцитов), функционально неполноценные тромбоциты и лейкоциты, иммуноагрессивные лимфоциты, антитела и антигены, способные стать причиной посттрансфузионных реакций и осложнений. Кроме того, консервирование и хранение значительно изменяют свойства крови (образуются микросгустки, происходят закисление среды, разрушение эритроцитов и накопление калия, аммиака, свободного гемоглобина и других продуктов метаболизма, обладающих токсическим действием). Всё это, а также достижения в области фракционирования крови и появление высокоактивных препаратов гемодинамического, реологического, дезинтоксикационного, антианемического и гемостатического действий заставило пересмотреть отношение к переливанию цельной донорской крови и выдвинуть новые подходы к трансфузионной терапии, основанные на принципе возмещения конкретных, недостающих организму при той или иной патологии компонентов крови. Такая тактика получила название «компонентная гемотерапия».
Благодаря компонентной терапии появилась возможность проводить целенаправленное трансфузионное воздействие на организм, получать значительно больший лечебный эффект при ряде патологических состояний и одновременно избегать негативных последствий, свойственных переливанию цельной крови.
При острой и хронической кровопотере целесообразно переливание эритроцитарной массы, при тромбоцитопенических состояниях - тромбоцитарной, при лейкопении - лейкоцитарной массы, при дефиците ОЦК, гипопротеинемии, нарушениях свёртывающей системы - плазмы крови, при диспротеинемии и гипопротеинемии - протеина, растворов альбумина.
При этом следует учитывать, что в полном замещении дефицита того или иного клеточного или белкового компонента нет необходимости, да это практически и недостижимо. Целенаправленность трансфузионной терапии состоит в купировании критического дефицита компонента крови, ставшего причиной нарушения стабильного состояния больного. Так происходит при дефиците эритроцитов в случае острого кровотечения или хронической анемии, результатом которой становятся симптомы анемической гипоксии; при выраженном дефиците тромбоцитов, приводящем к развитию тромбоцитопенического геморрагического синдрома, и т.д. Основные компоненты крови, используемые в трансфузиологии, - эритроцитсодержащие среды, концентраты лейкоцитов и тромбоцитов, плазма.
Основные компоненты крови
Эритроцитсодержащие среды
В настоящее время используют следующие эритроцитсодержащие среды: эритроцитарную массу, эритроконцентрат, эритроцитарную взвесь; эритроцитарную массу, обеднённую лейкоцитами и тромбоцитами; отмытые эритроциты, модифицированную кровь.
Эритроцитарную массу получают путём удаления плазмы крови при отстаивании или центрифугировании. Гематокрит составляет 65-80%. Таким образом, эритроцитарная масса содержит определённую примесь лейкоцитов, тромбоцитов плазменных белков и иммунных комплексов, способных стать причиной сенсибилизации больных и развития посттрансфузионных осложнений.
Эритроконцентрат получают при центрифугировании путём полного удаления плазмы и лейко-тромбоцитарного слоя. Гематокрит 90-95%.
Эритроцитарная взвесь - эритроконцентрат, ресуспензированный в каком-либо растворе. Наилучшими свойствами обладают эритроцитарная взвесь в растворах «Модежель» и «НАФ» (соотношение эритроконцентрата и раствора 1:1 и 2:1).
Срок хранения эритроцитарной массы, эритроконцентрата и эритроцитарной взвеси в зависимости от консерванта - 21 или 35 сут.
В процессе приготовления эритроцитарной массы, обеднённой лейкоцитами и тромбоцитами и отмытых эритроцитов удаляют белки плазмы, лейкоциты, тромбоциты, микроагрегаты и стромы разрушенных при хранении клеточных компонентов. Применение отмытых эритроцитов уменьшает вероятность заражения вирусными заболеваниями. Срок хранения при температуре 4 °С составляет 24 ч с момента заготовки.
Модифицированную кровь готовят путём центрифугирования: из крови удаляют плазму и лейкотромбоцитоцитарный слой, но затем плазму возвращают. Таким образом, модифицированная кровь - эритроциты вместе с плазмой.
В последнее время успех криотехнологий позволил замораживать эритроцитврную массу. В таком состоянии в бункерах с жидким азотом её можно хранить до 10 лет. Перед применением эритроцитарную массу размораживают и отмывают. Срок хранения после отмывания при температуре 4 °С составляет 24 ч.
Основное показание к применению эритроцитсодержащих сред - снижение содержания эритроцитов, произошедшее в результате острой или хронической кровопотери, неадекватного эритропоэза или при гемолизе.
Отмытые эритроциты показаны больным, у которых в анамнезе отмечены посттрансфузионные реакции негемолитического типа, а также пациентам, сенсибилизированным к антигенам белков плазмы, тканевым антигенам, антигенам лейкоцитов и тромбоцитов. В связи с отсутствием в отмытых эритроцитах стабилизаторов крови и продуктов метаболизма, оказывающих токсическое действие, их трансфузии показаны при лечении тяжёлых анемий у больных с печёночной и почечной недостаточностью, а также при синдроме массивных гемотрансфузий.
При переливании всех эритроцитсодержащих сред соблюдают те же правила, что и при переливании цельной крови.
Концентрат лейкоцитов
Концентрат лейкоцитов - трансфузионная среда с высоким содержанием лейкоцитов и примесью небольшого количества эритроцитов и тромбоцитов, получаемая с помощью рефрижераторной центрифуги или сепаратора клеток крови.
Основная функция концентрата лейкоцитов - фагоцитоз микробов и коррекция иммунодепрессии различного генеза.
Концентрат лейкоцитов применяют либо свежезаготовленный, либо со сроком хранения не более 1 сут. Это обусловлено истощением энергетического потенциала лейкоцитов и их гибелью в процессе хранения в течение нескольких суток.
Показания к применению концентрата лейкоцитов: лейкопения менее 1,5х109/л при различных заболеваниях, иммунодефицитные состояния при гнойно-септических осложнениях в хирургии, лейкопения при цитостатической и лучевой терапии, медикаментозные агранулоцитозы.
При переливании клнцентрата лейкоцитов необходимы совпадение группы крови и Rh-фактора донора и реципиента и проведение лимфоцитотоксического теста.
Концентрат тромбоцитов
Концентрат тромбоцитов готовят из обогащённой тромбоцитами плазмы или лейко-тромбоцитарного слоя. Тромбоциты - один из ведущих компонентов системы гемостаза, в связи с чем концентрат тромбоцитов применяют прежде всего при нарушении системы спонтанного гемостаза. Функциональные свойства тромбоцитов в концентрате тромбоцитов сохраняются до 120 ч.
Показания к применению концентрата тромбоцитов: тромбоцитопенический синдром, ДВС-синдром, депрессия костномозгового кроветворения после лучевой и цитостатической терапии. Трансфузия концентрата тромбоцитов показана при уменьшении количества тромбоцитов ниже 40х109/л.
При переливании концентрата тромбоцитов необходимо совпадение группы крови и Rh-фактора донора и реципиента.
Плазма
Плазма - жидкая часть крови; в её состав входят белки, липопротеиды, разнообразные ферменты, гормоны, витамины и биологически активные вещества. Наряду с эритроцитсодержащими средами плазма - наиболее часто используемый компонент крови.
В настоящее время применяют плазму свежезамороженную, жидкую (нативную) и сухую (лиофилизированную). Нативная и сухая плазма в процессе изготовления теряет некоторые лечебные свойства, в ней снижается содержание белка, фибриногена, компонентов свёртывающей и ферментативной систем.
Наиболее широко используют свежезамороженную плазму, так как в ней сохранены практически все биологические свойства плазмы.
Свежезамороженную плазму получают методом плазмафереза или центрифугирования цельной крови и немедленного её замораживания. Хранят при температуре -20 °С и ниже, срок хранения до 12 мес.
Непосредственно перед переливанием плазму оттаивают в воде при температуре 37-38 °С, размороженная плазма до переливания может сохраняться не более часа. Повторное замораживание и размораживание её недопустимо! Плазму используют с заместительной целью, для обеспечения дезинтоксикационного, стимулирующего эффектов и гемостатического действия. Показаниями к переливанию плазмы считают ДВС-синдром, массивную кровопотерю (для коррекции ОЦК), ожоговую болезнь (значительная плазмопотеря), гнойно-септические состояния, коагулопатии, гемофилии А и В, сопровождающиеся кровотечениями, гипопротеинемию и т.д.
Переливание плазмы противопоказано при выявлении у больных гиперкоагуляции или сенсибилизации к парентеральному введению белка.
В последние годы всё чаще применяют специальные виды плазмы: антигемофильную - при гемофилии, антистафилококковую, антиколи-, антисинегнойную и прочие - при септических состояниях.
При переливании плазмы необходимо совпадение группы крови донора и реципиента по системе АВ0. При переливании плазмы проводят биологическую пробу.
Препараты крови
Методом фракционирования плазмы получают различные белковые препараты. Их делят на три группы (по О.К. Гаврилову):
• Препараты комплексного действия (альбумин, протеин).
• Корректоры свёртывающей системы крови (криопреципитат, протромбиновый комплекс, фибриноген, тромбин, тампон биологический антисептический, гемостатическая губка, фибринолизин).
• Препараты иммунологического действия (γ-глобулин противокоревой; антирезусный, антистафилококковый, противостолбнячный и противогриппозный иммуноглобулины).
Препараты комплексного действия
Альбумин - белок плазмы крови с молекулярной массой 69000, синтезируемый в печени. Он выполняет транспортную и дезинтоксикационную функции, поддерживает коллоидно-осмотическое давление плазмы.
Растворы альбумина обладают высокой онкотической активностью и хорошими волемическими свойствами. Так, переливание 200 мл 20% альбумина за счёт привлечения в сосудистое русло жидкости из межклеточного пространства увеличивает ОЦК на 700 мл (гемодинамическое действие).
Растворы альбумина готовят из донорской плазмы и плацентарной сыворотки. Выпускают в виде 5%, 10%, 20% растворов. Срок хранения 5 лет. Препараты альбумина применяют без учёта групповой принадлежности. Технология изготовления растворов альбумина предусматривает инактивацию в них вируса гепатита и ВИЧ.
Альбумин применяют для возмещения дефицита ОЦК при кровотечении, плазмаферезе; заболеваниях, сопровождающихся гипоальбуминемией; ожоговой болезни, гнойно-септических процессах, инфекционных заболеваниях и отравлениях.
Показанием к введению альбумина считают снижение содержания альбумина в плазме до 25 г/л. Относительное противопоказание к применению - аллергические заболевания (бронхиальная астма, аллергический ринит, отёк Квинке и др.).
Для предупреждения аллергических реакций рекомендуют проведение биологической пробы.
Протеин - 4,3-4,8% изотонический раствор белков плазмы человека. Состоит из альбумина (80%) и глобулинов (20%), а также эритропоэтических активных веществ. Выпускают во флаконах по 250, 400 и 500 мл.
Хранят при комнатной температуре до 5 лет. Вируса гепатита и ВИЧ содержать не может.
Показания к применению те же, что и у альбумина; кроме того, протеин обладает антианемическим действием, так как содержит железо в виде альбумината.
Относительным противопоказанием считают неблагоприятный аллергологический анамнез. Для предупреждения аллергических реакций рекомендуют проведение биологической пробы.
Корректоры системы гемостаза
Криопреципитат содержит антигемофильный глобулин (VIII фактор), фибриноген и фибриностабилизирующий фактор (XIII фактор). Выпускают во флаконах по 15 мл. Показан к применению для профилактики и лечения кровотечений у больных гемофилией А, болезнью фон Виллебранда и при других заболеваниях, сопровождающихся снижением содержанием VIII фактора свёртывающей системы в крови больного.
Протромбиновый комплекс (PPSB) - белковая фракция плазмы крови с высоким содержанием II, VII, IX и X факторов свёртывания крови. Выпускают во флаконах, каждый из них содержит от 200 до 1000 ЕД IX фактора. Показан к применению с гемостатической целью больным, страдающим гипопротромбинемией, гипопроконвер- тинемией, гемофилией В.
Фибриноген содержит одноимённый белок, получаемый из плазмы крови. Его применение показано в случаях выраженной гипо- и афибриногенемии (при профузных кровотечениях, патологии беременности и родов, хирургических заболеваниях), при повышении фибринолитической активности, наследственной гипо- и афибриногенемии, для профилактики кровотечения в послеоперационном периоде.
Тромбин содержит тромбин, небольшое количество тромбопластина и хлорида кальция. Выпускают в лиофилизированном виде во флаконах. Показан для местного применения при остановке капиллярных и паренхиматозных кровотечений.
Гемостатическая губка - сухая пористая масса, хорошо поглощающая влагу, изготавливают из плазмы крови человека. Гемостатическое действие осуществляется за счёт значительного количества тромбина и фибриногена. Оставленная в тканях губка полностью рассасывается. Применяют при кровотечениях из паренхиматозных органов, повреждённых тканей, костей черепа при трепанации.
Фибринолизин - препарат фибринолитического действия. Механизм действия фибринолизина заключается в растворении сгустка крови благодаря протеолитическому расщеплению фибрина.
Препараты иммунологического действия
Из фракции глобулинов получают иммунологически активные препараты: γ-глобулины (иммуноглобулины), содержащие антитела в концентрированном виде. Препараты готовят из крови с высоким титром антител (крови людей, перенёсших соответствующее инфекционное заболевание, иммунных доноров, иммунизированных животных).
Иммунизация, проводимая по специальным схемам, позволяет получить высокоэффективные γ-глобулины направленного действия: антирезусный, противостолбнячный, противогриппозный и др. Указанные препараты - средства пассивной иммунизации. Выпускают иммуноглобулины в виде 10% раствора для внутримышечного введения. Как правило, реакций на их введение нет. В редких случаях возможны местные явления и незначительное повышение температуры тела. Перед введением необходимо уточнить аллергологический анамнез.
Кровезамещающие растворы
Переливание цельной крови, её компонентов и препаратов, несмотря на множество положительных моментов, несёт опасность переноса инфекционных заболеваний, а также развития реакций несовместимости, поэтому по возможности функции крови стараются заместить специальными препаратами, получившими название «кровезамещающие растворы» (или «кровезаменители»).
Кровезаменителями называют лечебные растворы, предназначенные для замещения утраченных или нормализации нарушенных функций крови.
В настоящее время в мире насчитывают несколько тысяч препаратов, относимых к группе кровезаменителей. Их широко применяют для поддержания и коррекции основных констант гомеостаза при различных патологических состояниях. Кровезаменители отличаются высокой эффективностью, целенаправленностью действия, их переливание проводят без учёта групповой принадлежности. Они имеют большие сроки хранения, их легко транспортировать, ими можно обеспечить большой контингент больных и раненых в экстремальных ситуациях.
По функциональным свойствам и преимущественной направленности кровезамещающие растворы делят на несколько групп:
• кровезаменители гемодинамического действия;
• дезинтоксикационные растворы;
• кровезаменители для парентерального питания;
• регуляторы водно-солевого обмена и кислотно-щелочного равновесия;
• переносчики кислорода;
• инфузионные антигипоксанты.
Переносчики кислорода
Создание кровезаменителей (так называемой «искусственной крови»), выполняющих перенос кислорода к тканям организма (основную функцию крови), - важная, но очень трудная задача.
В настоящее время интенсивно разрабатывают два направления в создании кровезаменителей с функцией переноса кислорода.
Растворы модифицированного гемоглобина
К этой группе относят геленпол (пиридоксиминированный полимеризованный гемоглобин крови человека). В состав геленпола входит лиофильно высушенное полимерное производное гемоглобина со стабилизаторами в виде глюкозы и аскорбиновой кислоты. Клинические наблюдения и данные экспериментальных исследований предполагают, что геленпол моделирует дыхательную функцию эритроцитов и функции плазменных белков, повышает содержание гемоглобина в циркулирующей крови и его синтез, усиливает транспорт оксида азота (NO) и S-нитрозотиолов (SNO). Геленпол применяют при гиповолемии, анемии и гипоксических состояниях.
Эмульсии перфторуглеродов
Основные препараты этой группы - перфторан, перфукол, флюсол-Да. Перфторуглероды пассивно переносят кислород и углекислый газ пропорционально перепаду парциального давления соответствующего газа.
Перфторуглероды - химически инертные вещества, не подвергающиеся метаболическим превращениям в организме человека.
Препараты применяют в качестве противошокового и противоишемического средства; они обладают реологическими, гемодинамическими, диуретическими, мембраностабилизирующими, кардиопротективными и сорбционными свойствами, уменьшают агрегацию эритроцитов. Их назначают при острой и хронической гиповолемии (травматический, геморрагический, ожоговый и инфекционно-токсический шок), нарушении микроциркуляции, изменениях тканевого обмена и метаболизма, при операциях на остановленном сердце как основной дилютант для заполнения аппарата искусственного кровообращения, для противоишемической защиты донорских органов.
Следует отметить, что до сих пор не удаётся решить проблему качественной стерилизации кровезаменителей-переносчиков кислорода и удешевления их производства. В связи с этим в клинической практике их применяют довольно редко.
Инфузионные антигипоксанты
Инфузионные антигипоксанты - самая молодая группа кровезаменителей. Они предназначены для повышения энергетического потенциала клетки. Основные препараты - мафусол , полиоксифумарин (содержат антигипоксант фумарат натрия) и реамберин (содержит сукцинат). За счёт вводимого фумарата или сукцината препараты этой группы восстанавливают клеточный метаболизм, адаптируя клетки к недостатку кислорода; за счёт участия в реакциях обратимого окисления и восстановления в цикле Кребса способ- ствуют утилизации жирных кислот и глюкозы клетками; нормализуют кислотно-основной баланс и газовый состав крови. Препараты показаны при гиповолемических состояниях, практически не имеют побочных эффектов.
Цитратная интоксикация
Причина. Интоксикация развивается при переливании больших доз крови, заготовленной с использованием в качестве стабилизатора цитрата натрия, особенно при большой скорости переливания. Цитрат натрия связывает в крови свободный кальций, вызывая гипокальциемию. Концентрация ионизированного кальция возвращается к норме сразу после прекращения переливания, что объясняется быстрой мобилизацией кальция из эндогенных депо и метаболизмом цитрата в печени.
Токсическая доза цитрата составляет 0,2-0,3 г на 1 кг массы тела, но при ряде патологических состояний, в том числе острой кровопотере, толерантность к цитрату снижается.
Клиническая картина. При снижении содержания свободного кальция в крови появляются неприятные ощущения за грудиной, судорожные подёргивания мышц голени, лица, нарушения ритма дыхания с переходом в апноэ при высокой степени гипокальциемии. Возможны снижение АД, нарастание сердечной недостаточности, на электрокардиограмме (ЭКГ) регистрируют удлинение интервала Q-T, нарушение ритма сердца: брадикардия вплоть до асистолии. Развитие всей полноты указанных изменений получило название «цитратный шок».
Лечение. При появлении клинических признаков гипокальциемии необходимо прекратить введение цельной консервированной крови, внутривенно ввести 10-20 мл 10% раствора глюконата кальция или 10 мл 10% раствора хлорида кальция.
Профилактика заключается в выявлении больных с исходной гипокальциемией, медленном введении крови, профилактическом введении 10% раствора хлорида (глюконата) кальция - 10 мл на каждые 0,5 л переливаемой крови.
Калиевая интоксикация
Причины. Гиперкалиемия может возникнуть при переливании длительно хранившейся консервированной крови или эритроцитарной массы (происходит разрушение форменных элементов с выходом калия в плазму).
Для клинической картины характерны брадикардия, аритмия, атония миокарда вплоть до асистолии. При биохимическом анализе крови подтверждают гиперкалиемию.
Лечение. Для устранения гиперкалиемии применяют внутривенное введение 10% раствора хлорида кальция и 0,9% раствора хлорида натрия, 40% раствора глюкозы с инсулином, кардиотонических средств.
Профилактика состоит в применении для клинических целей свежезаготовленной консервированной крови или эритроцитарной массы (особенно у пациентов с хронической недостаточностью почек, обычно сопровождающейся гиперкалиемией).
ГЛАВА 6
ПЕРЕЛИВАНИЕ КРОВИ И КРОВЕЗАМЕНИТЕЛЕЙ
Появление способов восполнения кровопотери значительно расширило возможности хирургии. Это позволило не только спасать пациентов от массивных кровотечений, но и выполнять большие травматичные хирургические вмешательства. В настоящее время сформировалась отдельная отрасль науки, специальная дисциплина, рассматривающая самые разнообразные аспекты переливания крови, её компонентов и заменителей, - трансфузиология.
Общие вопросы трансфузиологии
Успехи современной клинической медицины неразрывно связаны с широким внедрением методов трансфузиологии на различных этапах лечения больных.
Трансфузиология (transfusio - переливание, смешивание; logos - учение) - раздел медицинской науки об управлении функциями организма путём целенаправленного воздействия на морфологический состав крови с помощью переливания цельной крови, её компонентов, а также кровезаменителей и других средств.
Основные трансфузионные средства:
• кровь и её компоненты (эритроцитарная, лейкоцитарная и тромбоцитарная массы, плазма крови); переливание крови и её компонентов называют гемотрансфузией;
• кровезаменители - лечебные растворы, предназначенные для замещения утраченных или нормализации нарушенных функций крови.
Трансфузиология изучает также миелотрансплантацию (пересадку костного мозга) - эффективный метод лечения гемобластозов (злокачественных поражений органов кроветворения) и средство коррекции различных видов угнетения кроветворения.
Дата: 2019-03-05, просмотров: 2885.