1. Який об’єм водню виділиться внаслідок взаємодії розчину сульфатної кислоти з алюмінієм масою 12г, масова частка домішок у якому 10%?
2. Який об’єм кисню витратиться на спалювання сірки масою 10 г, масова частка домішок у якій становить 4%?
3. Який об’єм кисню витратиться на окиснсння сульфур (IV) оксиду об’ємом 27 л, об’ємна частка домішок у якому 20%?
Обчислення, пов’язані з масовою та об’ємною частками виходу продукту реакцій
За рівнянням реакції обчислюється лише теоретичний вихід. Практичний вихід завжди менший від теоретичного через неповний перебіг реакції та втрати. Вихід продукту обчислюється за формулами:
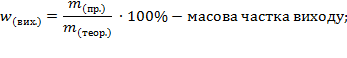
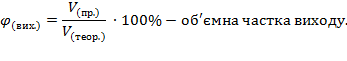
Задача. Під час нагрівання калій нітрату масою 30,3 г зібрали 3 л кисню. Обчисліть об’ємну частку виходу.
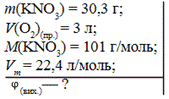 Дано: Розв’язання
Дано: Розв’язання
1. Обчислюємо об’єм кисню, який може віділитися теоретично:
30,3 г Xл
2KNO3 = 2KNO2 + O2 .
n=2моль n=1моль
m=2•101г V=22,4л
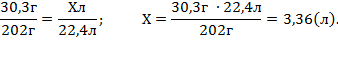
2. Знаходимо об’ємну частку виходу кисню.
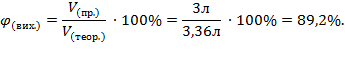
Відповідь: 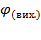 (O 2 ) = 89,2%.
(O 2 ) = 89,2%.
Задачі для самостійного розв’язування
1. З азоту масою 56 кг було синтезовано аміак масою 48 кг. Знайдіть масову частку виходу аміаку від теоретично можливого.
2. Який об’єм аміаку можна синтезувати з азоту масою 112 кг, якщо об’ємна частка виходу аміаку становить 90 % від теоретичного?
3. Який об’єм водню витратиться на добування аміаку масою 70 г, що становить 78 % від теоретично можливого?
Обчислення за хімічним рівнянням, якщо одна з реагуючих речовин дана в надлишку
Алгоритм розв’язку задач за цим способом:
1. Записуємо скорочену умову задачі.
2. Визначаємо речовину, яка перебуває в недостачі, обчислюємо кількості вихідних речовин за умовою задачі.
3. Записуємо хімічне рівняння реакції, складаємо мольні відношення вихідних речовин та порівнюємо отримані результати.
4. Розрахунки проводимо за речовиною, що перебуває в недостачі.
Задача. Обчисліть об’єм водню, що утвориться в результаті взаємодії цинку масою 13 г із сульфатною кислотою масою 20 г.
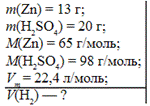 Дано: Розв’язання
Дано: Розв’язання
13 г 20г Xл
Zn + H2SO4 = ZnSO4 + H2
n=1моль n=1моль n=1моль
m=65г m=98г V=22,4л
1. Знаходимо вихідну речовину. Позначаємо одну з відомих величин через Y. Нехай m(H2SO4) = Y(г).
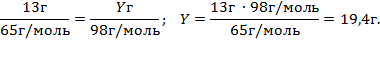
Оскільки з 13 г Zn може повністю прореагувати 19,4 г H2SO4, то кислота дана в надлишку, цинк — у недостачі, а отже, є вихідною речовиною.
2. Визначаємо, який об’єм водню виділиться.
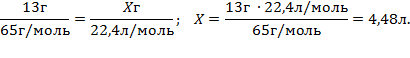
Відповідь: V(H2) = 4,48(л).
Задачі для самостійного розв’язування
1. До розчину, що містить натрій ортофосфат масою 20 г, додали кальцій хлорид масою 22,2 г. Яка маса осаду утвориться при цьому?
2. Яку масу сульфур діоксиду можна одержати із сірки масою 10 г і кисню об’ємом 5,6 л (н.у.)?
3. Яку масу алюміній сульфіду можна одержати під час сплавлення 8,1 г алюмінію з 9,6 г сірки? Яка речовина і з якою масою не прореагує?
Дата: 2019-03-05, просмотров: 419.