Термодинамическая вероятность состояния системы - это число способов, которыми может быть реализовано данное состояние макроскопической системы, или число микросостояний, осуществляющих данное макросостояние (т.е. термодинами-ческая вероятность не есть вероятность в математическом смысле).
Каждая случайная величина полностью определяется своей функцией распределения.
Если x .- случайная величина, то функция F(x) = Fx (x) = P(x < x) называется функцией распределения случайной величины x . Здесь P(x < x) - вероятность того, что случайная величина xпринимает значение, меньшее x.
Вопрос 41. Статистический метод описания системы частиц.
Статистический метод описания систем большого числа частиц основана на большом многообразии законов природы, которые не проявляют себя
При анализе поведения нескольких частиц(если частицы не квантовые), однако великолепно (с большой точностью) работают, если число частиц велико. Для квантовых частиц статистический метод
Необходимо применять даже для изучения небольшого количества частиц. Статистический метод рассматривает параметры движения частиц(например, координата, направление и модуль скорости частицы) как случайные величины, оперирует с усредненными характеристиками системы частиц, с функциями распределения, с вероятностями обнаружения частицы в томилином состоянии.
В основе статистического метода лежат следующие представления:
- свойства системы в целом определяются свойствами и характером движения частиц, ее составляющих;
- в силу многочисленности частиц и большого числа столкновений их поведение носит случайный характер;
- поведение системы в целом необходимо описывать не совокупностью координат и скоростей частиц, а усредненными характеристиками (средняя энергия, средняя плотность и т.д.). При сопоставлении этих усредненных характеристик с термодинамическими соотношениями выясняется смысл микроскопических параметров системы.
Закономерности, получаемые статистическим методом, называются вероятностными, или статистическими. Для их получения строится модель изучаемой системы.
Вопрос 42 Распределение частиц идеального газа по скоростям в условиях термодинамического равновесия (распределение Максвелла).
Молекулы газа при своем движении постоянно сталкиваются. Скорость каждой молекулы при столкновении изменяется. Она может возрастать и убывать. Однако среднеквадратичная скорость остается неизменной. Это объясняется тем, что в газе, находящемся при определенной температуре, устанавливается некоторое стационарное, не меняющееся со временем распределение молекул по скоростям, которое подчиняется определенному статистическому закону. Скорость отдельной молекулы с течением времени может меняться, однако доля молекул со скоростями в некотором интервале скоростей остается неизменной.
Распределение Максвелла описывает распределение по скоростям молекул (частиц) макроскопической физической системы, находящейся в статическом равновесии, при условии, что движение молекул подчиняется законам классической механики (например классический идеальный газ). Установлено Дж.Максвеллом в 1859 году. Согласно распределению Максвелла, вероятное число молекул в единице объёма f(v), компоненты скоростей которых лежат в интервалах от vx до vx+dvx, vy до vy+dvy, vz до vz+dvz, определяются функцией распределения Максвелла:
f(v) = n (m/2pkT)3/2exp( -mv2/2kT)
v - абсолютная скорость частицы, m - масса молекулы, n - число молекул в единице объёма. Отсюда следует, что число молекул, абсолютное значение скоростей которых лежат в интервале от v до v+dv, также называемое распределением Максвелла, имеет вид
dn=F(v)dv=4pn(m/2pkT)3/2exp(-mv2/2kT)v2dv
Оно достигает максимума при скорости vb = (2kT/m)1/2, называемой наиболее вероятной скоростью. При помощи распределения Максвелла можно вычислить также среднее значение любой функции от скорости молекулы. Так, например, средняя скорость <v> = (4/p)1/2vb и т.д. При этом среднеквадратичная скорость <v2>1/2 оказывается в (3/2)1/2 раза больше vb.
Вопрос 43. Средняя кинетическая энергия поступательного движения частиц идеального газа в условиях теплового равновесия и ее связь с абсолютной температурой.
Внутренняя энергия газа, в общем случае, состоит из кинетической энергии поступательного и вращательного движения молекул, энергии внутреннего (колебательного) движения атомов в молекуле, а также потенциальной энергии взаимодействия молекул. В случае идеального газа вкладом последнего слагаемого в полную энергию можно пренебрегать.
В классической статистической механике доказывается так называемая теорема о равномерном распределении кинетической энергии по степеням свободы молекул, согласно которой на каждую степень свободы молекулы в состоянии теплового равновесия в среднем приходится энергия, равная (1/2)kT.
Для газов, состоящих из одноатомных молекул, (например, инертные газы) средняя кинетическая энергия, приходящаяся на один атом, определена соотношением 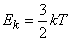 , поскольку она соответствует лишь поступательному движению атомов, (3 степени свободы). В этом случае
, поскольку она соответствует лишь поступательному движению атомов, (3 степени свободы). В этом случае
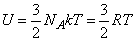 ,
, 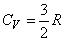
Существенно, что для идеального газа одноатомных молекул внутренняя энергия зависит только от температуры и не зависит от объема.
Вопрос 44. Термодинамическое равновесие системы частиц в поле внешней консервативной силы. Распределение Больцмана.
Больцмана распределение — распределение по энергиям частиц (атомов, молекул) идеального газа в условиях термодинамического равновесия, которое было открыто в 1868-1871 гг. австрийским физиком Больцманом. Согласно ему, число частиц ni с полной энергией ei равно:
ni = Aωiexp (-ei /kT)
где ωi — статистический вес (число возможных состояний частицы с энергией ei). Постоянная А находится из условия, что сумма ni по всем возможным значениям i равна заданному полному числу частиц N в системе (условие нормировки): ∑ni = N. В случае, когда движение частиц подчиняется классической механике, энергию ei можно считать состоящей из кинетической энергии ei, кин частицы (молекулы или атома), ее внутренней энергии ei, вн (например, энергии возбуждения электронов) и потенциальной энергии ei, пот во внешнем поле, зависящей от положения частицы в пространстве:
ei = ei, кин + ei, вн + ei, пот
Вопрос 45. Распределение молекул воздуха в поле силы тяжести. Барометрическая формула.
Барометрическая формула - определяет зависимость от высоты h плотности n или давления p идеального изотермического газа, находящегося в гидростатическом равновесии в однородном поле силы тяжести. Высота h отсчитывается в направлении, противоположном ускорению силы тяжести g. Барометрическая формула является частным случаем Больцмана распределения, обычно используется для описания атмосфер, космических тел (планет, звёзд). Для плотности Б. ф. можно записать в виде:
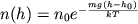 (1a) (1a)
|
| для давления: |
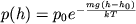 (1б) (1б)
|
где n0 и p0 - плотность п давление на некотором начальном уровне h0, m - масса частицы газа. Иногда вместо m удобнее пользоваться молекулярной массой m = m/mu (mu- атомная единица массы), при этом в показателе степени вместо mg/kT следует писать mg/RT, где R –газовая постоянная. Показатель экспоненты в (1) можно также записать в виде (h - h0)/H, где т. н. высота однородной атмосферы H = kT/mg характеризует протяжённость атмосферы (масштаб высоты) и скорость убывания n и р с высотой. H численно равна перепаду высот, на к-ром n (или р) уменьшается в е раз. Чем больше H, тем медленнее убывает с высотой n (или р) и тем протяженнее атмосфера.
Вопрос 46. Тепловое равновесие гармонического осциллятора.
Осциллятор - система (или материальная точка) совершающая колебательное периодическое движение около положения устойчивого равновесия.Гармонический осциллятор - осциллятор, колебания которого являются основной моделью движения частиц в атомах, атомных ядрах, молекулах, твердых телах.
Одна из важных задач о движении микрочастиц – это задача о движении гармонического осциллятора - системе, способной совершать гармонические колебания. История квантовой теории реально начинается с Макса Планка, который в 1900 г. получил формулу для правильного описания спектрального распределения теплового излучения. Планк пришел к выводу, что не может обеспечить вывод своей магической формулы для распределения излучения, если только не сделать предположения, которое с философской точки зрения он считал почти неприемлемым. Это предположение заключалось в том, что рассматриваемые им в качестве излучателей гармонические осцилляторы должны обладать энергиями, не распределенными как непрерывные переменные (чего следовало бы ожидать), а принимающими дискретные и регулярным образом расположенные значения. Осцилляторы с частотой υ должны были обладать значениями энергии, которые были бы кратны, т.е. n раз умножены (где n = 0,1, 2,3,...) на нечто, названное им квантом энергии hυ.
Вопрос 47. Степени свободы многоатомной молекулы. Поступательное, вращательное и колебательное тепловые движения. Теорема о равномерном распределении кинетической энергии теплового движения по степеням свободы молекул.
Степени свободы — характеристики движения механической системы. Число степеней свободы определяет минимальное количество независимых переменных (обобщённых координат), необходимых для полного описания движения механической системы.
Наиболее общая формулировка теоремы о равнораспределении гласит, что при определённых условиях, для физической системы с гамильтонианомH и степенями свободы xn, выполняется следующее соотношение для любых индексов m и n:
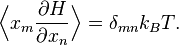
Энергия поступательного движения. Кинетическая энергия частицы газа с массой m и обладающая скоростью v задаётся в виде

где vx, vy и vz — декартовы компоненты вектора скорости v. Здесь символ H обозначает гамильтониан системы и используется как символ энергии в гамильтоновом формализме. Он играет центральную роль в большинстве обобщений закона равнораспределения.
Энергия вращательного движения. Вращательная энергия такой молекулы задана выражением
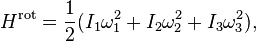
где ω1, ω2, и ω3 — главные компоненты угловой скорости.
Энергия колебательного движения. Равнораспределение подразумевает, что при тепловом равновесии осциллятор обладает средней энергией, которая равна
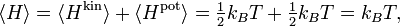
где угольные скобки 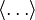 обозначают усреднение заключённой в них величины.
обозначают усреднение заключённой в них величины.
Вопрос 48. Статистический вес макросостояния системы частиц.
Элемент объема фазового пространства равен dT = d^(3N)qd^(3N)p
где (q, р) — совокупность координат и импульсов всех частиц. Например, в случае двух частиц (N = 2)
dГ = d^6 q d^6 p.
Здесь, в частности,
d^6 q = (dx1dy1dz1)(dx2dy2dz2) = d^3 q1 d^3 q2 = dV1 dV2.
Если разбить все фазовое пространство на ячейки объемом Г0, полагая, что на одну ячейку приходится одно микросостояние, то число состояний в объеме dГ окажется равным dG = dГ/Г0. В рамках классической механики нужно положить Го -> 0. Согласно квантовой механике элементарный объем следует выбрать равным Г0 = (2pi h)^(3N), где h — постоянная Планка. Поэтому число микросостояний (число элементарных ячеек) в элементе фазового пространства dГ можно найти по формуле
dG = dГ/(2pi h)^(3N).
Согласно сказанному одной ячейке соответствует одно микросостояние. Различные ячейки отвечают различным микросостояниям, но могут отвечать одному макросостоянию, если получаются перестановками одинаковых частиц. Пусть суммарный объем ячеек, отвечающих некоторому макросостоянию, есть Г. Тогда число микросостояний, реализующих данное макросостояние, равно G = Г/(2pi h)^(3N). Величина G называется статистическим весом рассматриваемогомакросостояния (или термодинамической вероятностью). Она пропорциональна обычной вероятности W реализации данногомакросостояния.
Вопрос 49. Формула Больцмана для энтропии.
S=k*ln(P), k = R/N = 1,38*10-23Дж/К,(1)
где k - фундаментальная мировая постоянная Больцмана;
R = 8,31 Дж/(моль*К) - молярная газовая постоянная;
N = 6,06*1023 моль-1 - число Авогадро;
Р - статистический вес: число способов осуществления данного состояния. Параметр S - энтропия - служит мерой рассеяния энергии Вселенной, а Р - характеризует любые самопроизвольные изменения, эта величина относится к миру атомов, определяющих скрытый механизм изменения.
В условиях равновесия энтропия - функция состояния системы, которую можно измерить или вычислить теоретически. Но стоит изолированной системе отклониться от равновесия - возникает свойство энтропии - она только возрастает.Представим формулу (1) в виде:
P = eS/K
и обратим внимание на то, что статистический вес состояния системы P экспоненциально растет с ростом S. Иными словами, менее упорядоченное состояние (больший хаос) имеет больший статистический вес*, т. к. оно может быть реализовано большим числом способов. Следовательно, энтропия - мера неупорядоченности системы.Из-за случайных перекладываний растет беспорядок на столе, в комнате. Порядок создается искусственно, беспорядок - самопроизвольно, т. к. ему отвечает большая вероятность, большая энтропия. Разумная деятельность человека направлена на преодоление разупорядоченности. Обратим внимание на то, что первое начало термодинамики (закон сохранения энергии) - закон абсолютно строгий, это детерминированный закон. Второе начало термодинамики - закон возрастания энтропии - закон статистический (вероятностный).Существует даже вероятность того, что молекулы, находящиеся в кубике размером 1 см3 могут все собраться в одной половине этого кубика. Вероятность для одной молекулы находиться в правой части кубика: q1=1/2. При нормальных условиях в 1 см3 содержится число молекул 2,7*1019 (число Лошмидта), тогда вероятность того, что все молекулы соберутся в правую половину кубика, равна 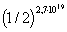 . Это исчезающе малая величина.
. Это исчезающе малая величина.
Вопрос 50 Статистический характер закона возрастания энтропии. Флуктуации.
Статистический характер второго закона термодинамики приводит к заключению, что увеличение энтропии в самопроизвольных процессах указывает на наиболее вероятныепути развития процессов в изолированной системе. Невозможность процесса следует понимать лишь как его малую вероятность по сравнению с обратным. Поэтому второй закон термодинамики в отличие от первого нужно рассматривать как закон вероятности. Он тем точнее соблюдается, чем больше размеры системы. Для систем, состоящих из громадного числа частиц, наиболее вероятноенаправление процесса практически является абсолютно неизбежным, а процессы, самопроизвольно выводящие систему из состояния равновесия, практически невозможны. Так, самопроизвольное изменение плотности 1 см воздуха в атмосфере с отклонением на 1% от ее нормальной величины может происходить лишь один раз за 3-10 лет. Однако для малых количеств веществафлуктуации плотности отнюдь не невероятны, а наоборот, вполне закономерны. Для объема воздуха 1 10" см повторяемость однопроцентных флуктуаций плотности составляет всего 10" с. Таким образам, действие второго закона нельзя распространять на микросистемы. Но также неправомерно распространять второй закон на вселенную.
Дата: 2019-03-05, просмотров: 321.