Термодинамический метод изучает свойства тел, не вдаваясь в их микроскопическую структуру, а опираясь на фундаментальные законы ( начала термодинамики), установленные обобщением экспериментальных фактов. Состояние термодинамической системы будет равновесным, если все параметры cостояния имеют определенные значения, не изменяющиеся с течением времени.
Макроскопическое Состояние (Макросостояние) Системы
Макроскопическое Состояние (Макросостояние) Системы определяется значениями ее термодинамических параметров: давления p, температуры Т, удельного объема v, внутренней энергии U и т. п. Для определения макроскопического состояния однокомпонентной системы достаточно знать значения любых 2 независимых параметров (напр., Т и p или Т и v).
Макроскопические параметры: масса системы, объем системы, температура системы, количества вещества в системе, давление системы на внешние тела, внутренняя энергия системы.
Уравнение состояния — уравнение, связывающее между собой термодинамические (макроскопические) параметры системы, такие, как температура, давление, объём, химический потенциал и др. Уравнение состояния можно написать всегда, когда можно применять термодинамическое описание явлений. При этом реальные уравнения состояний реальных веществ могут быть крайне сложными.
Состояние термодинамического равновесия системы частиц. Тепловое движение.
Согласно опыту любая замкнутая система, состоящая из большого числа взаимодействующих частиц, с течением времени самопроизвольно переходит в особое конечное состояние, которое называется термодинамическим равновесием. Состояние термодинамического равновесия является устойчивым относительно малых возмущений как начальных условий, так и самого конечного состояния. Вывод о существовании равновесного состояния термодинамической системы иногда называют нулевым началом термодинамики. Следует отметить, что переход системы в состояние термодинамического равновесия не может быть описан только на основе законов механического движения отдельной частицы. Иными словами, временная динамика такой системы частиц в целом имеет качественные отличия от динамики отдельной частицы.
В состоянии термодинамического равновесия частицы совершают особое движение, которое называется тепловым. Тепловое движение сложных составных частиц может быть поступательным, вращательным и колебательным. Интенсивность любого теплового движения характеризуется с помощью макроскопической величины, называемой температурой. В состоянии термодинамического равновесия температура T одинакова для всех макроскопических частей системы (условие теплового равновесия), что обеспечивает отсутствие теплообмена между макроскопическими частями системы. В Международной системе единиц СИ температура измеряется в кельвинах (K).
Модель идеального газа. Температура. Давление. Уравнение Клапейрона-Менделеева.
Модель идеального газа
Абстрактная модель, отражающая существенные черты явления, аналогичная материальной точке.
1. Молекулы (или атомы) газа не имеют собственного объема, то есть рассматриваются как материальные точки.
2. Силы взаимодействия между атомами и молекулами идеального газа пренебрежимо малы. Поэтому потенциальной энергией взаимодействия можно пренебречь. Отсюда, внутренняя энергия идеального газа – сумма кинетических энергий хаотического движения всех молекул. Взаимодействие же молекул сводится к упругим столкновениям.
Справедливо для газов в разреженном состоянии. Отсюда – идеальный газ: система невзаимодействующих материальных точек.
Температура
Если два тела находятся в состоянии термодинамического равновесия, то есть не обмениваются энергией путем теплопередачи, то этим телам приписывается одинаковая температура. Температура – физическая величина, характеризующая степень нагретости тел и определяет направление передачи тепла. Если между телами происходит направленный теплообмен, то телу отдающему энергию приписывают большую температуру по сравнению с телом, получающим тепловую энергию.
В физике и технике за абсолютную шкалу температур принята шкала Кельвина, названная в честь знаменитого английского физика, лорда Кельвина.
1 К - одна из основных единиц системы СИ. Кроме того, используются и другие шкалы:
- шкала Фаренгейта (немецкий физик 1724г) – точка таяния льда 32°F, точка кипения воды 212°F.
- шкала Цельсия (шведский физик 1742г) – точка таянья льда 0°С, точка кипения воды 100°С. 0°С = 273,15 К.
Давление
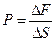 Давление газа – есть следствие столкновения газовых молекул со стенками сосуда. Именно давление чаще всего является единственным сигналом присутствия газа. Находящиеся под давлением газ или жидкость действуют с некоторой силой на любую поверхность, ограничивающую их объем. В этом случае сила действует по нормали к ограничивающей объем поверхности. Давление на поверхности равно:
Давление газа – есть следствие столкновения газовых молекул со стенками сосуда. Именно давление чаще всего является единственным сигналом присутствия газа. Находящиеся под давлением газ или жидкость действуют с некоторой силой на любую поверхность, ограничивающую их объем. В этом случае сила действует по нормали к ограничивающей объем поверхности. Давление на поверхности равно:
где ΔF–сила, действующая на поверхность площадь ΔS.
Внутреннее давление является одним и тем же во всех направлениях, и, во всем объеме независимо от формы сосуда. Этот результат называется законом Паскаля: если к некоторой части поверхности, ограничивающей газ или жидкость, приложено давление P0 , то оно одинаково передается любой части этой поверхности.
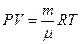 Уравнение Клапейрона-Менделеева:
Уравнение Клапейрона-Менделеева:
Дата: 2019-03-05, просмотров: 345.