Структура твердых тел. Твердые тела характеризуются, как правило, регулярным расположением атомов и молекул. Различают аморфную и кристаллическую структуру твердых тел.
Аморфные структуры – это структуры, не имеющие явно выраженного дальнего порядка в расположении атомов. К таким материалам относятся, например, стекла, многие органические материалы и т. д.
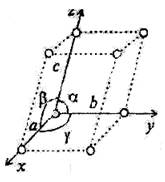
Рис. 1.4. Трехмерная кристаллическая структура
Кристаллические структуры – это структуры, представляющие периодическую решетку, в узлах которой расположены атомы (рис. 1.4). Трехмерная кристаллическая структура представляет собой решетку, построенную на трех координатных осях x , y , z , расположенных в общем случае под углами α, β, γ. Периоды трансляции атомов по осям (параметрам решетки) равны соответственно a , b , c . Элементарная ячейка кристалла – это параллелепипед, построенный на векторах трансляции a , b , c . В результате трансляции элементарной ячейки в пространстве получается пространственная простая ячейка – так называемая решетка Браве. Существует четырнадцать типов решеток Браве. Кроме того, в природе существует четыре типа сложных элементарных ячеек.
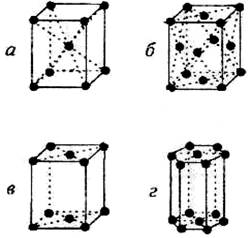
Рис. 1.5. Сложные элементарные ячейки:
а – объемоцентрированная;
б – гранецентрированная;
в – базоцентрированная;
г – гексацентрированная
Объемоцентрированная (ОЦ) ячейка (рис. 1.5,а) – содержит дополнительно один атом на пересечении диагоналей куба (или, в общем случае, параллелепипеда). В ОЦ кубической структуре кристаллизируются такие металлы, как 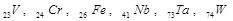 (индекс обозначает номер элемента в периодической системе элементов Д. И. Менделеева).
(индекс обозначает номер элемента в периодической системе элементов Д. И. Менделеева).
Гранецентрированная (ГЦ) ячейка (рис. 1.5,б) – содержит дополнительно по одному атому в плоскости каждой грани. В ГЦ кубической структуре кристаллизируются металлы 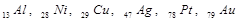
и др.
Базоцентрированная (БЦ) ячейка (рис. 1.5,в) – содержит дополнительно по одному атому в центрах противоположных граней.
Гексацентрированная ячейка (рис. 1.5,г), как и БЦ ячейка, содержит по одному атому в центре противоположных граней. В гексогональной структуре кристаллизируются многие кристаллы – 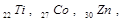
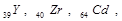
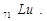
На основе первых трех типов сложных элементарных ячеек (ОЦ, ГЦ, БЦ) путем трансляции элементарной ячейки на расстояние А, меньше периода трансляции, получаются так называемые решетки с базисом (рис. 1.6). Например, кристаллическая решетка алмаза, Si, Ge, GaAs получаются путем трансляции ГЦК ячейки на расстояние, равное ¼ пространственной диагонали.
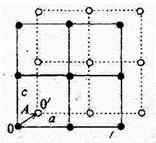
Рис. 1.6. Двумерная решетка с базисом
Для обозначения узлов, направлений и плоскостей используют индексы Миллера. В этом случае координаты любого узла можно выразить как 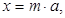
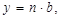
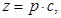 где
где 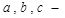 параметры решетки,
параметры решетки, 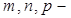 целые или дробные числа. Если за единицы измерения длин принять параметры решетки, то координатами узла будут просто целые или дробные числа
целые или дробные числа. Если за единицы измерения длин принять параметры решетки, то координатами узла будут просто целые или дробные числа 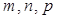 . Эти числа называются индексами узла и записывают следующим образом:
. Эти числа называются индексами узла и записывают следующим образом: 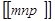 (рис. 1.7,а).
(рис. 1.7,а).
Для описания направления в кристалле выбирается прямая, проходящая через начало координат. Ее направление однозначно определяется индексами 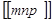 первого узла, через который она проходит
первого узла, через который она проходит
(рис. 1.7,а). Поэтому индексы узла одновременно являются и индексами направления. Индексы направления обозначаются 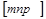 . Строго говоря, указанные индексы определяют целое семейство физически эквивалентных направлений в кристалле, получаемых циклической перестановкой значений индексов т, n , p. Индексы эквивалентных направлений обозначают
. Строго говоря, указанные индексы определяют целое семейство физически эквивалентных направлений в кристалле, получаемых циклической перестановкой значений индексов т, n , p. Индексы эквивалентных направлений обозначают 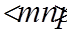 . Отметим, что если в символах узлов могут применяться дробные индексы, то для символов направлений и плоскостей используются только целочисленные индексы.
. Отметим, что если в символах узлов могут применяться дробные индексы, то для символов направлений и плоскостей используются только целочисленные индексы.
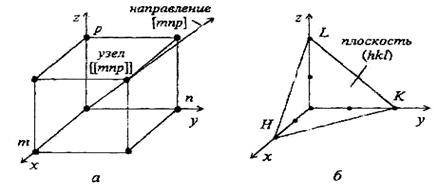
Рис. 1.7. Обозначение узлов, направлений (а)
и плоскостей (б) к кристаллической решетке
Индексы плоскости находятся следующим образом: выражают отрезки Н, K, L, которые плоскость отсекает на осях решетки (рис. 1. 7, б), в осевых единицах Н = m, K = n, L = p, где m , n , p – целые числа (координаты узлов), не равные нулю. Записывают величины, обратные этим отрезкам, 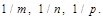 Находят наименьшее целое общее кратное (НОК) чисел m , n , p. Пусть НОК = d. В этом случае индексы Миллера плоскости будут являться целые числа h = d / m , k = d / n , l = d / p , которые записываются так:
Находят наименьшее целое общее кратное (НОК) чисел m , n , p. Пусть НОК = d. В этом случае индексы Миллера плоскости будут являться целые числа h = d / m , k = d / n , l = d / p , которые записываются так: 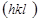 . Индексы Миллера для значений m , n или p, равных бесконечности (случай, когда плоскость параллельна одной или двум осям координат), принимаются равными нулю. Например, для значений
. Индексы Миллера для значений m , n или p, равных бесконечности (случай, когда плоскость параллельна одной или двум осям координат), принимаются равными нулю. Например, для значений 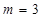 ,
, 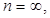
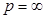 индексы Миллера данной плоскости равны (100).
индексы Миллера данной плоскости равны (100).
Так же, как и индексы направлений, индексы Миллера определяют не одну плоскость, а целое семейство плоскостей. Совокупность физически эквивалентных плоскостей, например всех шести граней куба, обозначают {hkl}. В качестве примера на рис. 1.8 приведены обозначения основных плоскостей и направлений в кубической и гексогональной решетке ках. В кубической решетке (рис. 1.8а,б,в) индексы плоскости совпадают с индексами направления, перпендикулярного этой плоскости.
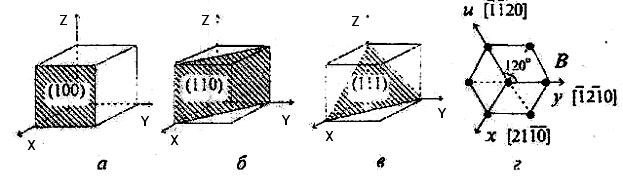
Рис. 1.8. Индексы плоскостей в кристаллических решетках:
а, б, в – плоскости (100), (110) и (111) в кубической решетке;
г – плоскость (0001) и направления координатных осей 
в гексагональной решетке (вид со стороны оси z)
Для удобства описания гексагональной решетки часто к трехосной системе координат добавляют четвертую координатную ось u, которая составляет равные углы (120°) с осями х и у и перпендикулярна гексагональной оси z (рис. 1.8,г). В получившейся четырехосной системе координат (х, у, и, z) каждая из граней элементарной гексагональной ячейки пересекает по две координатные оси, отсекая от них одинаковые отрезки. Проекции узловых точек на оси координат х, у, и, z могут представлять собой дробные или отрицательные числа. После приведения к общему знаменателю числители полученных дробей являются индексами направления. В качестве примера на рис. 1.8,г приведены индексы координатных осей х, у, и. Значения индекса, меньше щзя, отмечены знаком инверсии над соответствующим индексом. Например, координаты узла В, лежащего на оси у (рис. 1.8, г), равны [[-1/2, 1, -1/2, 0]]. Следовательно, индексы направления, совпадающего с осью у, равны [1210]. Индексы направлений координатных осей х и и равны [2110] и [1120], соответственно.
Структурные дефекты твердых тел. Реальные кристаллы всегда содержат некоторое число дефектов кристаллической структуры. Появление дефектов в кристаллах неизбежно, поскольку они образуются уже в процессе выращивания монокристалла вещества. Их концентрация быстро возрастает с температурой, а также при деформировании кристалла. Различают два основных вида дефектов кристаллической решетки.
Точечные дефекты создаются при внедрении в узлы и междуузлия идеальной кристаллической структуры «чужеродных» атомов, например при приготовлении сплава (рис. 1.9,а,б). Кроме того, к точечным дефектам относятся вакансии, то есть незаполненные атомами основного материала узлы кристаллической решетки. При этом атом основного материала может находиться рядом, в междуузлии кристаллической решетки (дефекты по Френкелю, рис.1.9,в). Возможен случай, когда атом вообще может испариться из объема материала и вакансия является одиночной (дефекты по Шоттки, рис. 1.9, г).
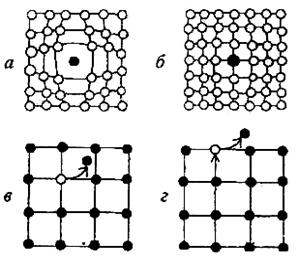
Рис. 1.9. Условное изображение точечных дефектов кристаллической решетки: а – дефекты типа внедрения;
б – дефекты типа замещения;
в – дефекты по Френкелю; г – дефекты по Шоттки
Точечные дефекты кристаллической решетки могут образовываться при бомбардировке поверхности кристалла ускоренными заряженными ионами различных веществ. Дефекты такого происхождения называют радиационными дефектами.
Дислокация – это линейный дефект, заключающийся в смещении плоскостей кристаллической решетки относительно друг друга. Различают два основных типа дислокаций:
линейная (краевая) дислокация представляет результат неполного сдвига кристаллической решетки. В итоге появляется незаконченная плоскость атомов (рис. 1.10, а);
винтовая дислокация возникает вследствие полного сдвига некоторого участка решетки (рис. 1.10, б).
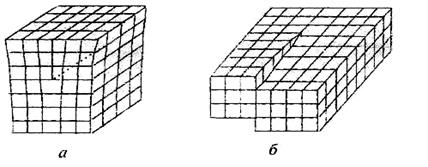
Рис. 1.10. Условное изображение линейных дефектов
кристаллической решетки: а – линейная дислокация;
б – винтовая дислокация
Выходы дислокаций на поверхность кристалла можно обнаружить по результатам травления кристалла в специальном травителе. В результате травления на поверхности кристалла появляются ямки травления, хорошо видимые под микроскопом. Плотность дислокаций оценивают визуально, подсчитывая под микроскопом число ямок травления на единице площади поверхности кристалла. Например, кристалл полупроводникового материала пригоден к дальнейшему использованию, если плотность дислокаций в нем не превышает 106…107 м-2.
Хотя относительная концентрация атомных дефектов может быть небольшой, но изменения физических свойств кристалла, вызываемые ими, могут быть огромными. Например, тысячные доли атомного процента некоторых примесей могут изменять электрическое сопротивление чистых полупроводниковых кристаллов в 105–106 раз. Протяженные дефекты структуры оказывают сильное влияние на механические свойства кристаллов.
Полиморфизм. Некоторые твердые вещества обладают способностью образовывать не одну, а две и более кристаллические структуры, устойчивые при различных температурах и давлениях. Такое свойство материалов называют полиморфизмом, а отвечающие им кристаллические структуры называют полиморфными формами или аллотропными модификациями вещества. Модификацию, устойчивую при нормальной и более низкой температуре, принято обозначать буквой α; модификации, устойчивые при более высоких температурах, обозначают соответственно буквами β, γ и т. д.
Полиморфизм широко распространен среди технических материалов и имеет важное значение для их обработки и эксплуатации. Классическим примером полиморфизма является низкотемпературное преращение белого олова (β-Sn) в серое (α-Sn), известное в технике как «оловянная чума».
Практический интерес представляет полиморфизм углерода – сущетвование его в виде алмаза или графита. В обычных условиях графит является более устойчивой модификацией, чем алмаз. Однако при повышении давления устойчивость алмаза растет, а графита падает, и при достаточно высоких давлениях алмаз становится более устойчивым. Если при этом повысить температуру, чтобы увеличить подвижность атомов, то графит можно перевести в алмаз.
Стекла и другие аморфные тела. Не все твердые тела имеют кристаллическую структуру, хотя кристаллическое состояние большинства твердых тел является естественным, потому что энергия при упорядоченном расположении атомов меньше, чем в случае их нерегулярного расположения, а любая система стремится перейти в состояние с минимальной свободной энергией. Однако атомы не всегда имеют благоприятную возможность располагаться упорядоченно в процессе затвердевания. Препятствием этому может быть резкое уменьшение скорости диффузии атомов при охлаждении среды. Твердые тела, которые характеризуются случайным хаотичным расположением частиц, называют аморфными. В отличие от кристаллов аморфные тела изотропны по свойствам, не имеют определенной температуры плавления и характеризуются достаточно широким температурным интервалом размягчения. Наглядным примером аморфных веществ могут служить стекла и многие пластинки. В стеклах при отсутствии периодичности в строении можно наблюдать определенный ближний порядок, т. е. закономерное расположение ближайших соседей относительно каждого атома. Стеклообразное состояние можно рассматривать как состояние сильно переохлажденной жидкости, т. е. жидкости с очень высокой вязкостью. Именно высокая вязкость ограничивает диффузионную активность атомов и препятствует образованию кристаллической фазы. Однако такое состояние термодинамически неустойчиво. Поэтому при отжиге может происходить «расстекловывание» материала, т. е. переход в более устойчивое кристаллическое состояние.
Дата: 2019-03-05, просмотров: 345.