Общее учение о болезни (В.В. Пашутин, А.Д. Адо, Н.Н. Зайко и др.). Понятие «здоровье» и понятие «болезнь». Периоды и исходы болезней. Ятрогенные заболевания и деонтологические аспекты патофизиологии и медицины.
Крупнейшим отечественным патофизиологом является ученик И.М. Сеченова профессор Виктор Васильевич Пашутин (1845-1901), который в 1874 г. в Казани возглавил кафедру общей патологии Казанского университета. В дальнейшем он руководил кафедрой общей и экспериментальной патологии Военно-медицинской академии в Санкт-Петербурге. В.В. Пашутин первым внедрил в медицину термин «патологическая физиология» и фактически основал ее как науку. В.В. Пашутин считал патологическую физиологию «философией медицины». Он доказал авитаминозную природу цинги, создал учение о кислородном голодании тканей (гипоксии), занимался изучением пищеварения, функций эндокринных желез.
Г.П. Сахаров (1873-1953) возглавлял кафедру общей патологии (а затем - патологической физиологии) медицинского факультета Московского университета с 1914 по 1929 гг. Г.П. Сахаров открыл явление сывороточной анафилаксии, описал изменения в тканях при местном аллергическом воспалении (феномен Артюса- Сахарова).
Н.Н. Зайко разрабатывал теорию патогенеза трофических расстройств при повреждении чувствительного нерва и исследовал механизмы нейрогенных дистрофий.
Академик РАМН Андрей Дмитриевич Адо и его школа создали новое направление в изучении аллергических процессов. Он заложил основы аллергологии, как самостоятельной науки, создал первую в стране аллергологическую лабораторию.
Академик РАМН В.А. Неговский считается основоположником реаниматологии. Он разработал патофизиологические основы реанимации организма, находящегося в состоянии клинической смерти, создал учение о постреанимационной болезни. В.А. Неговский основал сначала лабораторию, а затем Институт общей реаниматологии АМН СССР.
Крупные работы в области патологии нервной деятельности, а также в проблеме формирования и функционирования патологических систем принадлежат академику РАМН Г.Н. Крыжановскому, им было создано Международное общество патофизиологов. Таковы основные этапы развития отечественной патофизиологической науки.
В Уставе Всемирной организации здравоохранения записано: «Здоровье - это состояние полного физического, морального и социального благополучия, а не только отсутствие болезней или физических дефектов».
Болезнь - нарушение жизнедеятельности организма, вызванное действием чрезвычайных раздражителей, характеризуются снижением работоспособности, приспособляемости организма к условиям окружающей cреды и одновременным развитием не только патологических, но и компенсаторно-приспособительских реакций, направленных на восстановление нарушенных функций и структур, лежащих в основе выздоровления.
Периоды болезни
1. Скрытый, латентный (инкубационный при инф.) от момента действия раздражителя до появления первых самых незначительных симптомов. Процессы при инкубацион. периоде: попадание микроба, его размножение, выделение токсина.
Скрытый период - время скрытого молчаливого формирования многозвеньевых рефлект. реакций, новых динамических организаций из осколков разрушенных под действием раздражителя физиологических систем. Это время на организацию патологических систем.
2. Продромальный период - от появления неясных симптомов до яркой картины заболевания. Недомогание, повышение температуры. Иногда есть специфич. симптомы: пятна Филатова-Комликова при кори.
3. Период выраженной клинически болезни. При некоторых заболеваниях делится на фазы. При инфекционных заболеваниях - конкретные сроки длительности.
Могут быть стертые формы; абортивные формы - есть вся симптоматика, но менее выражена, быстро проходит.
По течению:
а) острые заболевания (2 дня - 2-3 недели)
б) хронические
в) могут быть острыми и хроническими (нефрит, пиелонефрит, лейкоз ...)
Главное - течение заболевания, а не конкретная длительность заболевания.
Острое - быстро нарастающее течение.
Хроническое - периоды обострения сменяются периодами ремиссии.
Нередко возникают осложнения - могут быть тяжелые, чем само заболевание.
Могут быть типичными (пневмония после кори).
4. Исход:
1. Полное выздоровление - после большинства травм.
2. Неполное выздоровление - есть остаточные явления (после скарлатины длительные изменения в почках).
3. Переход в патологическое состояние (после перенесенного эндокардита - порок сердца).
4. Смерть - при недостаточности компенсаторных восстановительных механизмов.
Терминальные состояния. Основные закономерности различных этапов умирания (снижение регуляции ЦНС, сердца, дыхания, обмена веществ и т.д.). Смерть клиническая и биологическая. Основные принципы и методы оживления (В.А. Неговский).
Терминальные состояния– это состояния, пограничные между жизнью и смертью, последние стадии умирания организма, это обратимое угасание функций организма, предшествующее биологической смерти, когда комплекс защитно-компенсаторных механизмов оказывается недостаточным, чтобы устранить последствия действия патогенного фактора на организм.Организм не погибает одновремённо с остановкой дыхания и сердечной деятельности, хотя в этом случае прекращается поступление к клеткам всех органов кислорода, без которого немыслимо существование живого организма. Однако различные ткани неодинаково реагируют на отсутствие кислорода, что обуславливает разные сроки их гибели. Наиболее чувствительна к недостатку кислорода ( гипоксии ) нервная ткань, и прежде всего кора полушарий головного мозга.Поэтому при терминальных состояниях в первую очередь страдают функции этого высшего отдела ЦНС ( центральной нервной системы ), вследствие чего пострадавший теряет сознание. Терминальные состояния могут быть вызваны различными причинами :массивной кровопотерей, шоком, закупоркой дыхательных путей ( асфиксией ), электротравмой, инфарктом миокарда, утоплением, заваливанием землёй и т.д.
В терминальном состоянии выделяют три стадии :
1. Предагональное состояние характеризуется :
- сохранением у пострадавшего сознания, которое, однако, спутанное;
- частым пульсом слабого наполнения ( нитевидный пульс );
- учащённым и затруднённым дыханием;
- бледными кожными покровами;
- длительным возбуждением.
2. Агония, которой свойственны :
- отсутствие сознания и пульса;
- отсутствие реакции зрачков на свет;
- неравномерное поверхностное дыхание, носящее характер заглатывания воздуха, или редкие, короткие, судорожные дыхательные движения ( 2-6 вздохов в минуту ). Агония завершается последним вдохом или последним сокращением сердца и переходит в клиническую смерть.
3. Клиническая смерть, продолжительность которой составляет 3-5 минут. Состояние характеризуется :
- отсутствием сознания, дыхания и кровообращения;
- зрачки максимально расширены и не реагируют на свет ;
- резко выражена бледность;
- наблюдается посинение кожных покровов и слизистых оболочек;
Состояние клинической смерти тем не менее ОБРАТИМО, если в первые 3-5 минут принять меры по возвращению пострадавшего к жизни ( реанимация ).
При биологической смерти ( истинной ), которая наступает в случае неоказания пострадавшему реанимационной помощи, происходят необратимые изменения в ЦНС и других жизненно важных органах. Такое состояние характеризуется рядом признаков, которые нужно оценивать в комплексе :
- отсутствие дыхательной и сердечной деятельности;
- отсутствие реакции зрачков на свет;
- наличие симптома “ кошачьего зрачка “ ( для проверки этого симптома необходимо сдавить глазное яблоко пострадавшего с обоих сторон пальцами – у трупа зрачок примет вид вертикальной щели );
- высыхание и помутнение роговицы;
- снижение температуры тела и появление сине-фиолетовых трупных пятен на коже. При положении трупа на спине они возникают в области лопаток, поясницы и ягодиц; при положении на животе – на лице, шее, груди и животе;
- появление трупного окоченения ( этот бесспорный признак смерти возникает через 2-4 часа после кончины ).
Понятие о патогенезе. Диалектно-материалистическое понимание роли местного и общего, ведущего звена и порочных кругов, причинно-следственных отношений и других философских категорий и законов в патогенезе. Повреждения первичные и вторичные.
Патогенез (от греческого страдание, болезнь и genesis - происхождение) механизм развития заболевания.
Ведущее (основное, главное) звено (или несколько звеньев) - тот процесс, который необходим для развертывания всех остальных (гипоксия при анемиях). Своевременная ликвидация главного звена приводит к устранению процесса в целом. Так, при сахарном диабете главным звеном является недостаток инсулина, при введении его исчезают другие проявления болезни (гипергликемия, кетоацидоз, кома).
Патогенез болезней и большинства патологических процессов включает комплекс тесно взаимосвязанных местных и общих звеньев. Значимость этих двух категорий различна и нередко меняется по ходу формирования болезни. Например, если кариес поддается местному лечению - достаточно поставить пломбу. Если он является следствием общих нарушений минерального и белкового обмена, то лечение должно быть общим. Соотношение между общим и местным меняется во времени. Местное (фурункул) может распространиться и стать общим (сепсис). Общий патологический процесс, благодаря защитным силам, может отграничиться, локализоваться и исчезнуть.
Причинно-следственная связь - ряд этапов, которые связаны между причинно-следственными отношениями. Т.е. изменения, возникшие в период заболевания, становятся причинами новых нарушений, а причины и следствия постоянно меняются местами. Смена причин и следствий иногда приводит к возникновению порочного круга. Это цепь причинно-следственных отношений, при которой следствие становится причиной, усугубляющей первоначальную. Пример о горной болезни. Гипоксия экзогенная в конечном итоге приводит к возникновению эндогенного типа гипоксии (сердечно-сосудистого и дыхательного)
Понятие о причинно-следственных связях в патогенезе представляет большой практический интерес, так позволяет врачу целеустремленно вмешиваться в развитие болезни. Среди звеньев патогенеза выделяют главные и второстепенные.
Механизмы болезнетворного действия акустической энергии (звук, ультразвук). Специфическое и неспецифическое действие шума, ранние и отдаленные последствия его действия. Использование ультразвука в медицине.
Нормальная громкость звука для человека 40-50Дб. Ультразвук (свыше 20кГц) применяется в диагностике, используются его свойства проходить в различных средах с разной скоростью. негативное влияние- движение эритроцитов, гранул гранулоцитов, явление кавитации.
Шум-совокупность звуков, нарушающих тишину и раздражающих человека. Различают специфическое и не специфическое действие шума. Специфическое- нарушение функций слухового сенсора-спазм звуковоспринимающего аппарата, приводящий к нарушению обменных процессов-снижение слуха. Неспецифическое- связано с поступлением возбуждения в кору ГМ, гипоталамус и СМ. Развивается запредельное торможение ЦНС-истощение нервных клеток.
Понятие о гериатрии и геронтологии. Старение организма. Теории старения. Особенности развития патологических процессов у людей пожилого и старческого возраста. Методы борьбы с преждевременной старостью.
Старение- это процесс прогресирующего снижения функциональных способностей организма после достижения им зрелости. Процесс старения характеризуется развитием структурных и функциональных изменений, которые ограничивают способность организма поддерживать состояние гомеостаза при действии разнообразных стрессоров, вызывают снижение резистентности и обусловливают повышенную заболеваемость людей пожилого и старческого возраста, что приводит в итоге к полной утрате жизнеспособности. Изменения в органах и тканях имеют генерализованный характер, хотя и могут развиваться неодновременно.
Внешними проявлениями старения являются дистрофические изменения кожи и ее придатков: она истончается, становится морщинистой, уменьшается количество потовых и сальных желез, седеют и выпадают волосы. Разрушаются зубы. Происходит уменьшение массы тела за счет снижения объема мышечной и костной ткани и уменьшения количества внутриклеточной жидкости. Снижается плотность костной ткани, она разрыхляется (остеопороз), в связи с этим возрастает частота переломов. Нередко возникает кифоз вследствие сплющивания тел позвонков. Снижается мышечная сила. Проявления старения на уровне клеток. Как в стареющих фибробластах в культуре (in vitro), так и в клетках многих тканей при старении снижается скорость процессов транскрипции и трансляции на уровне генома, нарастает количество хромосомных мутаций; происходит увеличение количества лизосом, тогда как число митохондрий уменьшается. Понижается чувствительность клеток к различным ростовым факторам и гормонам, что связано с уменьшением числа рецепторов и нарушениями в пострецепторной передаче сигналов. Замедляется деградация белков, что связано со снижением активности внутриклеточных протеаз. Увеличивается количество структурно измененных белков. В клетках накапливается липофусцин. В связи с пониженной доставкой кислорода, уменьшением в клетках количества митохондрий и нарушением синтеза дыхательных ферментов угнетаются процессы тканевого дыхания и окислительного фосфорилирования. В результате снижается синтез макроэргических соединений, что ограничивает функциональные резервы клеток и возможность синтеза различных веществ. Ослабляется работа энергозависимых мембранных насосов. В связи с этим в клетках повышается содержание Na+, Ca2+ и Cl-, а содержание калия, магния и фосфора снижается. Обнаруживается дисбаланс ферментативной активности - у одних ферментов она понижена, у других повышена; к числу последних относятся моноаминооксидаза, сукцинатдегидрогеназа, альдолаза и др. Следует иметь в виду, что при старении изменяются некоторые показатели, характеризующие метаболические процессы. В частности, возрастает средняя концентрация глюкозы в крови (до 6,7 ммоль/л) и мочевины (до 8,9 ммоль/л), существенно снижается содержание альбуминов в плазме крови. Биологическая наука, занимающаяся изучением изменений в организме при старении, называется геронтологией. Одной из задач, которую она пытается разрешить, является выяснение причин и механизмов старения.
| Вид системы | Характеристика возрастных изменений |
| Нервная система | Снижается в той или иной степени масса мозга, уменьшается количество нейронов в коре головного мозга, мозжечка и ядрах подкорки; увеличивается количество клеток глии. В нейронах изменяется активность ряда ферментов, что ведет к нарушению синтеза и обмена нейромедиаторов, например дофамина. Снижаются память, скорость образования условных рефлексов, познавательные способности |
| Органы чувств | Снижается острота зрения и слуха, нарушаются обоняние и вкусовая чувствительность |
| Эндокринная система | Уменьшается секреция гормонов щитовидной, поджелудочной и половыми железами, корой надпочечников, аденогипофизом и эпифизом. Снижается реакция β-клеток поджелудочной железы на гипергликемию и чувствительность тканей к действию инсулина |
| Сердечнососудистая система | Уменьшаются минутный объем и сердечный индекс, максимальная частота сердечных сокращений, скорость кровотока. Повышаются периферическое сопротивление сосудов и системное артериальное давление. Нарастает риск развития ишемической болезни сердца в связи с повышенным содержанием в крови холестерина, липопротеинов низкой и очень низкой плотности |
| Органы дыхания | Снижаются максимальная вентиляция и жизненная емкость легких, увеличивается остаточный объем воздуха в легких |
| Система органов пищеварения | Снижаются секреция пищеварительных ферментов и HCl, объем пищеварительных соков, двигательная функция желудка и кишечника; иногда возникают нарушения глотания |
| Мочевыделительная система | Уменьшаются количество функционирующих нефронов, уровень клубочковой фильтрации, концентрационная способность почек; замедляется выведение с мочой лекарственных препаратов; ночной диурез превалирует над дневным (никтурия). У женщин нередко возникает недержание мочи, у мужчин - затруднение мочеиспускания в связи с аденомой предстательной железы |
| Система гемостаза | Повышаются как прокоагулянтная, так и антикоагулянтная активность крови, однако последняя возрастает в меньшей степени, чем первая; снижается антиагрегационная способность стенок сосудов, что способствует образованию тромбов |
| Иммунная система | Ослабевает клеточный и гуморальный иммунитет. Возможно развитие иммунодефицита. Усиливаются аутоиммунные реакции |
Механизмы старения
И.И. Мечников высказал предположение, что старение является следствием эндогенной интоксикации организма веществами, образующимися в кишечнике при гнилостном брожении. Чтобы затормозить процесс старения, он предложил употреблять в пищу как можно больше молочнокислых продуктов и вести правильный образ жизни. Некоторым подтверждением этой гипотезы является высокое содержание молочнокислых продуктов в диете кавказских долгожителей.
Существующие в настоящее время теории и гипотезы относительно механизмов старения можно подразделить на две группы. Теории, относящиеся к одной из этих групп, рассматривают старение как генетически запрограммированный процесс, который развивается в «плановом» порядке, подобно другим стадиям онтогенеза. Другие считают, что старение является результатом накапливающихся в течение жизни повреждений в геноме и других клеточных структурах.
Среди теорий, рассматривающих старение как результат накопления в клетках различных повреждений в процессе их жизни, заслуживают особого внимания теория ошибок (L. Orgel, 1963) и свободнорадикальная теория старения, предложенная Д. Харманом (1956) и Н.М. Эмануэлем (1958).
На продолжительность жизни оказывают влияние генетические факторы, степень сохранения интеллектуальной деятельности, выраженность инстинкта самосохранения, способность организма перестраиваться в зависимости от условий жизни, склонность к развитию атеросклероза в жизненно важных органах. Наблюдения, проведенные на животных (главным образом, на грызунах), свидетельствуют о том, что положительное влияние на продолжительность жизни оказывает качественно полноценное, но количественно ограниченное питание, в особенности в первую половину жизни. На продолжительность жизни, по-видимому, оказывает влияние функция эпифиза. Удаление его у крыс приводит к уменьшению продолжительности жизни, а введение животным пептидного экстракта эпифиза сопровождается противоположным эффектом. Существует особый раздел медицины - гериатрия, которая ставит своей целью оказание медицинской помощи пожилым и старым людям, основываясь на знании особенностей физиологических и патологических процессов в позднем периоде жизни.
Общие закономерности патогенеза генных болезней. Примеры генных наследственных болезней с нарушением синтеза транспортных, структурных и ферментных белков. Типы передачи наследственных болезней (аутосомно-доминантный, аутосомно-рецессивный, ко-доминантный, промежуточный и смешанный).
Генные болезни – это разнородная по клиническим проявлениям группа заболеваний, которые вызываются генными мутациями. По фенотипическому проявлению: • связанные с нарушением обменов: аминокислотного, углеводного, липидного, минерального, нуклеиновых кислот;•нарушения свертывания крови; •гемоглобинопатии
аутосомно-доминантный тип наследования. примеры заболеваний: синдром марфана, гемоглобинопатия м, хорея хантингтона, полипоз толстой кишки, семейная гиперхолестеринемия, нейрофиб-роматоз, полидактилия.
признаки заболевания. одинаковая частота патологии у лиц мужского и женского пола. наличие больных в каждом поколении родословной, т.е. регулярная передача болезни из поколения в поколение (так называемый вертикальный характер распределения болезни). вероятность рождения больного ребёнка равна 50% (независимо от пола ребёнка и количества родов).
непоражённые члены семьи, как правило, имеют здоровых потомков (поскольку не имеют мутантного гена).
перечисленные признаки реализуются при условии полного доминирования (наличие одного доминантного гена достаточно для развития специфической клинической картины заболевания).
аутосомно-рецессивный тип наследования. примеры заболеваний: фенилкетонурия, адреногенитальный синдром, кожно-глазной альбинизм, галактоземия, гликогенозы, гиперлипопротеинемии, му-ковисцидоз.
признаки заболевания. равная частота патологии у лиц мужского и женского пола. проявление патологии в родословной «по горизонтали», часто у сибсов. отсутствие заболевания у единокровных (дети одного отца от разных матерей) и единоутробных (дети одной матери от разных отцов) братьев и сестёр. родители больного, как правило, здоровы. это же заболевание может обнаруживаться у других родственников, например у двоюродных или троюродных братьев (сестёр) больного.
появление аутосомно-рецессивной патологии более вероятно при кровнородственных браках за счёт большей вероятности встречи двух супругов, гетерозиготных по одному и тому же патологическому аллелю, полученному от их общего предка. чем больше степень родства супругов, тем эта вероятность выше.
сцепленное с хромосомой х-доминантное наследование. примеры заболеваний: одна из форм гипофосфатемии — витамин d-резистентный рахит, болезнь шарко—мари-тута х-сцепленная доминантная, ро-то-лице-пальцевой синдром типа i.
признаки заболевания. поражены лица мужского и женского пола, но женщины в 2 раза чаще. передача больным мужчиной патологического аллеля всем дочерям и только дочерям, но не сыновьям. сыновья получают от отца хромосому y. передача больной женщиной заболевания и сыновьям, и дочерям с равной вероятностью. более тяжёлое течение заболевания у мужчин, чем у женщин.
сцепленное с хромосомой х-рецессивное наследование. примеры заболеваний: гемофилия а, гемофилия в, х-сцепленная рецессивная болезнь шарко—мари—тута, дальтонизм, мышечная дистрофия дюшенна—бек-кера, синдром калльмана, болезнь хантера (мукополисахаридоз типа ii), гипо-гаммаглобулинемия брутоновского типа.
признаки заболевания больные рождаются в браке фенотипически здоровых родителей. заболевание наблюдается почти исключительно у лиц мужского пола. матери больных — облигатные носительницы патологического гена. сын никогда не наследует заболевание от отца. у носительницы мутантного гена вероятность рождения больного ребёнка равна 25% (независимо от пола новорождённого), вероятность рождения больного мальчика равна 50%.
голандрический, или сцепленный с хромосомой y , тип наследования. гены, ответственные за развитие патологического признака, локализованы в хромосоме y.. примеры признаков: гипертрихоз ушных раковин, избыточный рост волос на средних фалангах пальцев кистей, азооспермия.
признаки. передача признака от отца всем сыновьям и только сыновьям. дочери никогда не наследуют признак от отца. «вертикальный» характер наследования признака. вероятность наследования для лиц мужского пола равна 100%.
митохондриальное наследование. примеры заболеваний (митохондриальные болезни): атрофия зрительного нерва лебера, синдромы лея (митохондриальная миоэнцефалопатия), merrf (миоклоническая эпилепсия), кардиомиопатия дилатационная семейная.
признаки заболевания. наличие патологии у всех детей больной матери. рождение здоровых детей у больного отца и здоровой матери.
указанные особенности объясняются тем, что митохондрии наследуются от матери.
Основные механизмы развития наследственной патологии связаны с:
1) мутациями(инициальное звено), в результате кот возникает
а) выпадение нормальной наследственной информации,
б) увеличение объема нормальной наследственной информации,
в) замена нормальной наследственной информации на патологическую;
2) нарушением репарации поврежденной ДНК;
3) стойкими изменениями регуляции генной активности.
Заключительное звено-реализация действия аномального гена (генов).
Основные ее варианты:
1. Если аномальный ген утратил код программы синтеза структурного или функционально важного белка нарушается синтез соответствующих и-РНК и белка.(гемофилия)
2. Утрата мутантным геном кода программы синтеза того или иного фермента завершается уменьшением или прекращением его синтеза, дефицитом его в крови и тк и нарушением катализируемых им процессов(ряд болезней аминокислотного, углеводного обмена и др.)
3. Формирование гена с патологическим кодом,вследствие синтезируется аномальная РНК и аномальный белок с измененными свойствами(серповидно-клеточная анемия)
· Фенилкетонурия-дефект ферментов фенилаланингидроксилазы (фенилаланин→тирозин)и тирозиназы(тирозин→меланин). «Мышиный запах» от больных.Повышенная возбудимость и тонус мышц,тремор,эпилептиформные припадки.Позже-нарушения ВНД,умственная отсталость,микроцефалия.Нарушение синтеза меланина.
· Алкаптонурия -генетический дефект оксидазы,катализирующей превращение гомогентизиновой к-ты в малеилацетоуксусную.Первая откладывается в соединительной тк.→пигментация цвета охры.Потемнение мочи при стоянии на воздухе.Поражение суставов конечностей и позвоночника.
· Галактоземия-недостаточность фермента галактозо-1-фосфата,переводящей галактозо-1-фосфат в уридиндифосфогалактозу.Происходит накопление галактозы и галактоза-1-фосфата в крови и др.тк.Желтуха новорожденных,рвота и понос,приводящие к обезвоживанию организма,умственная отсталость,увеличение печени и селезенки,общая дистрофия,катаракта.
Хромосомные болезни – полиплоидии, анеуплоидии, их проявления и патогенетические особенности. Возможные пути профилактики и методы лечения наследственных заболеваний. Значение охраны окружающей среды.
Хромосомные болезни - наследственные заболевания, обусловленные изменениями числа или конфигурации хромосом, чаще отсутствием в кариотипе одной хромосомы из какой-либо пары гомологов (моносомия) или наличием добавочной 3-й хромосомы к паре гомологов.
Полиплоидия — это кратное увеличение гаплоидного набора хромосом. Клетки с разным числом гаплоидных наборов хромосом называют триплоидными (Зn), тетраплоидными (4n), гексаплоидными (6n), октаплоидными (8n) и т д.
Анеуплоидия или гетероплоидия. У анеуплоидов нормальное число хромосом увеличивается или уменьшается менее чем на целый набор. Анеуплоиды возникают тогда, когда не расходятся хроматиды отдельных хромосом в митозе или отдельные гомологичные хромосомы в мейозе. В результате нерасхождения хромосом при гаметогенезе могут возникать половые клетки с лишними хромосомами, и тогда при последующем слиянии с нормальными гаплоидными гаметами они образуют зиготу 2n + 1 (трисомик) по определенной хромосоме. Если в гамете оказалось меньше на одну хромосому, то последующее оплодотворение приводит к образованию зиготы 2n — 1 (моносомик) по какой-либо из хромосом. Кроме того, встречаются формы 2n — 2 или нуллисомики, так как отсутствует пара гомологичных хромосом, и 2n + n или полисомики.
Моносомия Х (синдром Шерешевского-Тернера). Кариотип состоит из 45 хромосом, половой хроматин отсутствует. Больные (женщины) отличаются низким ростом, короткой шеей, шейными боковыми кожными складками. Характерны лимфатический отек стоп, слабое развитие половых признаков, отсутствие гонад, гипоплазия матки и фолопиевых труб, первичная аменорея. Такие женщины бесплодны. Умственная способность, как правило, не страдает.
Трисомии -Болезнь Дауна. Кариотип больных в 94% состоит из 47 хромосом за счет трисомии по 21 хромосоме.Резкая задержка и нарушение физического и психического развития. Такие дети низкорослы, поздно начинают ходить, говорить. Голова со скошенным затылком,широкая,глубоко запавшая переносица,монголоидный разрез глаз,открытый рот,неправильный рост зубов,макроглоссия,гипотония с разболтанностью суставов,брахидактилия и др. Выраженная умственная отсталость.Нарушения во всех системах и органах.В большинстве случаев бесплодны.
-Синдром Патау (трисомия 13).Тяжелые пороки головного мозга и лица (дефекты строения костей мозгового и лицевого черепа, головного мозга, глаз; микроцефалия, расщелина верхней губы и неба), полидактилией (чаще – гексодактилия), дефекты перегородок сердца, незавершенный поворот кишечника, поликистоз почек, пороки развития других органов. 90% детей погибают в течение 1-го года жизни.
-Синдром Эдвардса (трисомия 18). Клинические проявления: многочисленные пороки костной системы (патология строения лицевой части черепа: микрогнатия, эпикант, птоз, гипертелоризм) сердечно-сосудистой (дефекты межжелудочковой перегородки, пороки клапанов легочной артерии, аорты), гипоплазия ногтей, подковообразная почка, крипторхизм у мальчиков. 90% больных погибает на первом году жизни.
-Трисомия по Х-хр(«сверхженщина») Женский организм с мужеподобным телосложением.Диагносцируется по обнаружению вместо одного двух телец Барра и по кариотипу 47,XXX.Отмечается гипоплазия яичников, матки, бесплодие, различные степени умственной неполноценности(шизофрения).
-С-м Клайнфельтера Встр у мужчин(1:1000).Общее количество хромосом47(кариотип XXY,но встр 48XXXY,49 XXXXXY).Наружные половые органы сформированы по мужскому типу.Характерны высокий рост,астеническое телосложение,длинные ноги,снижение сперматогенеза,умственная отсталость.
-«Супер мужчина» Кариотип 47, ХУУ.Импульсивное поведение с выраженными элементами агрессивности. Большое число таких индивидов выявляется среди заключенных.
Общие механизмы повреждения клетки. Расстройство энергетического обеспечения, повреждение мембран и ферментов клетки, значение перекисного окисления липидов, дисбаланса ионов натрия, калия и кальция и жидкости в механизмах повреждения клетки.
Различают непосредственное (первичное) и опосредованное (вторичное) повреждения. Последнее возникает как следствие первичных нарушений постоянства внутренней среды организма. В зависимости от скорости развития и выраженности основных проявлений повреждение клетки может быть острым и хроническим. Острое повреждение развивается быстро, как правило, в результате однократного, но интенсивного повреждающего воздействия, в то время как хроническое повреждение протекает медленно и является следствием многократных, но менее интенсивных патогенных влияний. В зависимости от периода жизненного цикла, на который приходится действие повреждающего агента, повреждение клетки может быть митотическим и интерфазным. В зависимости от степени нарушения внутриклеточного гомеостаза повреждение бывает обратимым и необратимым. Выделяют два патогенетических варианта повреждения клеток:
1. Насильственный. Развивается в случае действия на исходно здоровую клетку физических, химических и биологических факторов, интенсивность которых превышает обычные возмущающие воздействия, к которым клетка адаптирована. Наиболее чувствительны к данному варианту повреждения функционально малоактивные клетки, обладающие малой мощностью собственных гомеостатических механизмов.
2. Цитопатический. Возникает в результате первичного нарушения защитно-компенсаторных гомеостатических механизмов клетки. В этом случае фактором, запускающим патогенетические механизмы повреждения, являются естественные для данной клетки возмущающие стимулы, которые в этих условиях становятся повреждающими. К цитопатическому варианту относятся все виды повреждения клетки, возникающего вследствие отсутствия какихлибо необходимых ей компонентов (гипоксическое, нервнотрофическое, при голодании, гиповитаминозах, недостаточности антиоксидантной системы, генетических дефектах и др.). К цитопатическому повреждению наиболее чувствительны те клетки, реактивность, а следовательно, и функциональная активность которых в естественных условиях очень высоки (нейроны, кардиомиоциты).
Учение о конституции организма. Конституциональные типы: их классификация, различия и механизмы формирования. Значение конституции в патологии. Диатезы, их виды, значение в патологии (лимфатико-гипопластический, экссудативный, нервно-артритический).
Конституция - совокупность относительно устойчивых морфологических и функциональных свойств организма человека, обусловленных наследственностью (генотипом), продолжительными влияниями окружающей среды и определяющих своеобразие реактивных свойств организма. Основой конституции человека является его генотип. Основоположником учения о конституции считается Гиппократ, создавший первую классификацию конституциональных типов. Гиппократ разделил людей в зависимости от их темперамента, поведения в обществе на 4 группы:
-холерик - легко возбудимый, неуравновешенный, легко переходящий в состояние угнетения;
-меланхолик - неуверенный в себе, всегда неудовлетворенный;
-сангвиник - жизнерадостный, подвижный;
-флегматик - инертный, всегда спокойный, уравновешенный, застойный.
Учение И.М. Павлова о ведущей роли нервной системы в жизнедеятельности сложного организма открыло новую эпоху в развитии данной проблемы. На основании многолетней работы по выработке условных рефлексов И.П. Павлов создал классификацию типов высшей нервной деятельности животных и человека, в основу которой положены основные свойства нервных процессов (раздражительного и тормозного) - их сила, равновесие, подвижность. Были выделены 4 типа, соответствующие темпераментам, установленным Гиппократом:
-сильный, уравновешенный, подвижный (сангвиник)
-сильный, уравновешенный, инертный (флегматик);
-сильный, неуравновешенный (холерик);
-слабый (меланхолик).
По отношению первой и второй сигнальной систем для человека выделены дополнительно еще три типа: тип "художника" - с преимущественно развитой первой сигнальной системой; тип "мыслителя" - с преобладанием второй сигнальной системой и "средний". Преобладание первой или второй сигнальных систем может быть присуще любому темпераменту.
В настоящее время общепринятой в клинике является классификация М.В. Черноруцкого, которая делит людей на три типа - астеники, гиперстеники, нормостеники с учетом морфологических и функциональных особенностей, характера человека, склонностью к той или иной патологии. Так, люди с астеническим типом телосложения отличаются повышенной возбудимостью нервной системы, склонностью к птозу (опущению) внутренних органов, неврозам, гипотензии, туберкулезу, язвенной болезни желудка, в меньшей мере (по сравнению с другими типами) к развитию атеросклероза, ожирения, диабета. Нормостеники - (люди атлетического типа) энергичны, уверены в своих силах, у них отмечается склонность к заболеваниям верхних дыхательных путей, опорно-двигательного аппарата, невралгия, атеросклерозу коронарных артерий, чаще развивается инфаркт миокарда. Гиперстеники (пикники) - общительны, подвижны, практичны. У них преобладают процессы ассимиляции, функции половых желез и надпочечников обычно повышены, отмечается относительно более высокий уровень артериального давления. Они склонны к ожирению, диабету, атеросклерозу, гипертонической болезни, дисфункции желчного пузыря, желчно-каменной болезни.
Диатезы- крайние, пограничные с патологией варианты конституции (аномалии конституции). В настоящее время выделяют три основных вида диатезов как объективно существующих маргинальных типов реактивности:
-экссудативно-катаральный диатез, характеризующийся повышенной раздражительностью кожи и слизистых оболочек, склонностью к экзематозным появлениям на коже, зудящим волдырям, крапивницам, аллергическим реакциям немедленного типа, повышенным риском анафилактических реакций, гиперергическим течением воспаления, возникновением бронхиальной астмы, отеком Квинке, ложного крупа, наклонностью к атопической аллергии. В основе этих явлений лежит наследственная склонность к выработке антител типа реагинов;
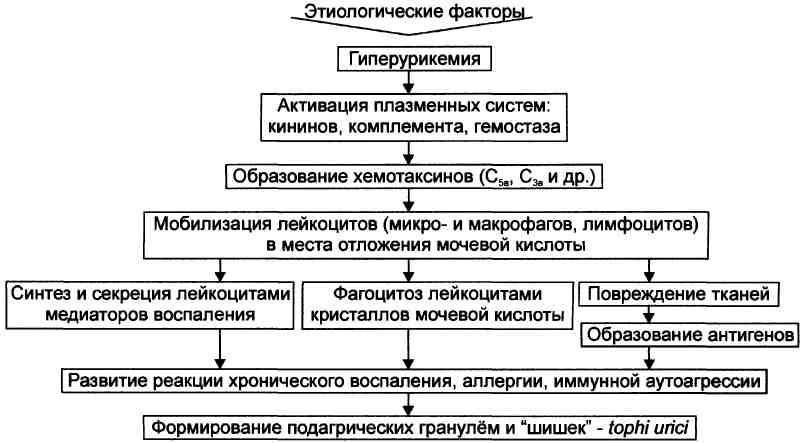
-нервно-артретический диатез - состояние, характеризующееся повышенной возбудимостью, лабильностью нервновегетативной регуляции, сильным неуравновешенным возбудимым типом высшей нервной деятельности, высокой интенсивностью пуринового обмена и повышенным содержанием мочевой кислоты в крови, периодическим повышениям уровня кетоновых тел, предрасположением к дискинезиям желудочно-кишечного тракта, сахарного диабета, мигрени, невралгии, артритов, атеросклероза, подагры, хронической почечной недостаточности. Эти проявления связаны в значительной степени с накоплением уратов в организме, а также с кофеиноподобным действием на нервную и мышечную ткани мочевой кислоты, которая оказывается хронически действующим своеобразным "эндогенным допингом". Носители этого диатеза нередко проявляют незаурядные умственные способности.
-лимфатико-гипопластический диатез (status thymico-lymphaticus) характеризуется гиперплазией тимиколимфатического аппарата и гипоплазией надпочечников, хромаффинной ткани, щитовидной железы, половых органов, сердца, аорты, гладкомышечных органов, пониженными адаптационными возможностями, малой устойчивостью к стрессам, легким развитием фазы истощения при стрессорных реакциях, что обусловлено пониженными функциональными возможностями надпочечников. Отмечается тимомегалия, увеличение миндалин, лимфоузлов, фолликулов языка, селезенки; аденоиды, лимфоцитоз, нейтропения. Серьезным осложнением этого диатеза является синдром внезапной смерти детей (СВСД) - "mors thymica" - тяжелый коллапс с остановкой дыхания и сердечной деятельности при энергичных процедурах, сильных раздражениях, наркозе или во сне, возникающий чаще всего в первые два года жизни. Способствуют СВСД низкий социально-экономический статус родителей, курение, и токсикомания у матерей. Большинство исследователей трактует СВСД как полиэтиологический синдром с участием значения status thymico-lymphaticus.
Общая тактика
• Лечение определяется типом иммунодефицита.
• При тяжёлой патологии Т-клеток показана трансплантация костного мозга.
• При недостаточности IgG — внутривенное введение растворов, содержащих Ig.
• Не следует вводить живые вакцины больным с иммунодефицитом и членам их семей.
Лекарственная терапия
• Практически при всех формах необходимо назначение: Антибиотиков, Иммуностимуляторов.
• При гуморальных и комбинированных иммунодефицитах — заместительная терапия Ig.
• При недостаточности аденозиндезаминазы — заместительная терапия ферментом, конъюгированным с полиэтиленгликолем (Адаген). Проводится также генная терапия (корригированные Т-лимфоциты пациента).
Лечение первичных иммунодефицитов сложная задача. Для назначения комплексного лечения обязательно установление точного диагноза с определением нарушенного звена иммунной защиты. При недостатке иммуноглобулинов проводят пожизненную заместительную терапию сыворотками, содержащими антитела или обычной донорской плазмой. При возникновении инфекционных осложнений назначают лечение антибиотиками, противовирусными или противогрибковыми препаратами.
При вторичных иммунодефицитах, нарушения иммунной системы выражены в меньшей степени, чем при первичных. Как правило, вторичные иммунодефициты носят приходящий характер. В связи с этим лечение вторичных иммунодефицитов гораздо проще и эффективнее по сравнению с лечением первичных нарушений функции иммунной системы. Обычно лечение вторичного иммунодефицита начинают с определения и устранения причины его возникновения. Восстановительные способности иммунной системы велики, поэтому устранение причины иммунодефицита, как правило, приводит к восстановлению иммунной системы. Для ускорения выздоровления и специфической стимуляции иммунитета проводят курс лечения иммуностимулирующими препаратами.
Синдром приобретенного иммунодефицита (СПИД). Этиология, частота, патогенез, последствия.
Синдром приобретённого иммунодефицита (СПИД) - вторичный иммунодефицитный синдром, развивающийся в результате ВИЧ-инфекции. СПИД является одним из наиболее клинически значимых иммунодефицитов. Этот синдром был описан в научной литературе в 1981 г. американскими исследователями. Этиология. Возбудителями являются вирусы иммунодефицита человека рода Retrovirus подсемейства Lentivirinae семейства Retroviridae.
Эпидемиология
• Источник инфекции - человек в любой стадии инфекционного процесса. Вирус выделяют из крови, спермы, влагалищного секрета, материнского молока, слюны.
• Пути передачи - половой, парентеральный, трансплацентарный, через материнское молоко.
Группы риска. Гомосексуальные и бисексуальные мужчины и женщины; наркоманы, использующие наркотики внутривенно; реципиенты крови и её компонентов, трансплантируемых органов.
Патогенез
• ВИЧ поражает активированные CD4+-клетки (T-лимфоциты, особенно TH первого типа; моноциты, макрофаги и некоторые другие клетки), используя молекулу CD4 в качестве рецептора.
• Центральное звено патогенеза СПИДа - иммуносупрессия.
♦ Главная причина уменьшения числа T-клеток - проявление цитопатического эффекта, вызванного репликацией вируса. Аккумуляция неинтегрированной вирусной ДНК в цитоплазме инфицированных клеток обусловливает бурную репликацию ВИЧ и гибель клеток.
♦ Появление вирусных гликопротеинов в мембране заражённых T-клеток - пусковой механизм для аутоиммунных процессов против подобных клеток.
♦ ВИЧ инфицирует клетки-предшественники в тимусе и костном мозге, что приводит к развитию тромбоцито- и лейкопений.
♦ Дефекты гуморального и клеточного иммунитета обусловлены дефицитом T-хелперов. Так, B-клетки продуцируют только АТ с низкой специфичностью к Аг ВИЧ. Иммунодефицит позволяет ВИЧ избегать действия факторов ИБН.
Лечение
• Основной принцип лечения - этиотропный. В настоящее время применяют ингибиторы обратной транскриптазы ВИЧ (зидовудин, залцитабин, диданозин), ингибиторы протеаз (индинавира сульфат), ингибиторы процессов сборки и созревания дочерних популяций (например, α-интерферон).
• Проводят профилактику оппортунистических инфекций. С этой целью используют антибактериальные, противовирусные и противопротозойные препараты.
Патобиохимическая стадия
• Комплементзависимые реакции. Цитотоксичность и цитолиз реализуются путём нарушения целостности цитолеммы клетки-мишени и её опсонизации.
- Нарушение целостности мембраны клетки-мишени достигается благодаря активации под действием комплекса «АТ+Аг» системы комплемента.
- Цитолиз осуществляется благодаря опсонизации клеток-мишеней при помощи факторов комплемента, а также IgG и IgM.
- Аналогичным образом могут повреждаться неклеточные структуры и ба-зальные мембраны, на которых фиксирован чужеродный Аг.
• Антителозависимый клеточный цитолиз осуществляется без непосредственного участия факторов комплемента.
- Прямой цитотоксический и цитолитический эффект оказывают клетки, обладающие киллерным действием: макрофаги, моноциты, гранулоциты (главным образом нейтрофилы), естественные киллеры, Т-киллеры. Все эти клетки не сенсибилизированы Аг. Киллерное действие они осуществляют путём контакта с IgG в области Fc-фрагмента AT. При этом FaB-фрагмент IgG взаимодействует с антигенной детерминантой на клетке-мишени.
- Цитолитический эффект клетки-киллеры реализуют путём секреции гидролитических ферментов, генерации активных форм кислорода и свободных радикалов. Эти агенты достигают поверхности клетки-мишени, повреждают и лизируют её.
- Наряду с антигенно изменёнными клетками в ходе реакций могут повреждаться и нормальные клетки. Это связано с тем, что цитолитические агенты (ферменты, свободные радикалы и др.) не «инъецируются» прицельно в клетку-мишень, а секретируются киллерами в межклеточную жидкость вблизи неё, где находятся и другие — антигенно неизменённые клетки. Последнее является одним из признаков, отличающих данный тип аллергической реакции от иммунного — прицельного цитолиза.
Стадия клинических проявлений. Описанные выше цитотоксические и цитолитические реакции лежат в основе формирования ряда клинических синдромов аллергического характера: так называемых «лекарственных» цитопений (эритро-, лейко-, тромбоцитопений); агранулоцитоза; аллергических или инфекционно-аллергических форм нефрита, миокардита, энцефалита, гепатита, тиреоидита, полиневрита и др.
38. Аллергические реакции 3 типа (иммунокомплексные). Стадии, медиаторы, механизмы их действия, клинические проявления (сывороточная болезнь, феномен Артюса).
Для реакций гиперчувствительности типа III (иммунокомплексные, преципи-тиновые) характерно образование иммунных комплексов. Комплексы, образованные Аг и соответствующим AT, активируют систему комплемента, приводя к развитию воспалительной реакции.
Клинические примеры: сывороточная болезнь (после введения чужеродных белков или медикаментов), экзогенный аллергический альвеолит, СКВ, а также гломерулонефрит после инфекций.
Причиной аллергических реакций этого типа являются хорошо растворимые белки, повторно попадающие в организм или образующиеся в самом организме.
Стадия сенсибилизации
• В-лимфоциты продуцируют и секретируют IgG и IgM, обладающие выраженной способностью образовывать преципитаты при их контакте с Аг. Эти преципитаты называют иммунными комплексами, а болезни, в патогенезе которых они играют существенную роль, иммунокомплексными.
- Если иммунные комплексы образуются в крови или лимфе, а затем фиксируются в различных тканях и органах, то развивается системная (генерализованная) форма аллергии. Примером её может служить сывороточная болезнь.
- В тех случаях, когда иммунные комплексы формируются вне сосудов и фиксируются в определённых тканях, развиваются местные формы аллергии (например, мембранозный гломерулонефрит, васкулиты, периартери-иты, альвеолит, феномен Артюса).
- Наиболее часто иммунные комплексы фиксируются в стенках микро-сосудов, на базальной мембране гломерул почек, в подкожной клетчатке, на клетках миокарда, синовиальных оболочках и в суставной жидкости.
- Местные аллергические реакции типа III всегда сопровождаются развитием воспаления.
• Высокий уровень преципитирующих IgG и IgM выявляется на 5—7-е сутки после появления Аг в организме. На 10—14-е сутки, в связи с повреждением тканей под влиянием иммунных комплексов и развитием острого воспаления, появляются клинические признаки заболевания.
Патобиохимическая стадия. В связи с фиксацией в тканях иммунных комплексов, а также активацией реакций по их удалению в тканях и крови появляются медиаторы аллергии.
• Реализация эффектов указанных БАВ ведёт к повреждению клеток и неклеточных образований. Это вызывает развитие острого воспаления с характерными для него местными и общими признаками.
• Устранение иммунных комплексов при участии гранулоцитов и мононукле-арных клеток сопровождается выделением ими ряда других БАВ. Это потенцирует и расширяет масштаб и степень аллергической альтерации тканей, а также развивающегося в связи с этим воспаления.
• Повышение проницаемости стенок сосудов приводит к отёку тканей и способствует проникновению иммунных комплексов среднего и малого размера из крови в ткани, в том числе — в стенки самих сосудов с развитием васкули-тов.
• Увеличение проницаемости и разрыхление базальных мембран обеспечивает проникновение и фиксацию в них иммунных комплексов.
• Активация проагрегантов и прокоагулянтов создаёт условия для тромбообра-зования, нарушений микроциркуляции, ишемии тканей, развития в них дистрофии и некроза.
Стадия клинических проявлений. Прямое действие иммунных комплексов на клетки и ткани и вторичные реакции, развивающиеся в связи с этим, реализация эффектов медиаторов аллергии, а также особенности реактивности организма у конкретных пациентов приводят к развитию различных клинических вариантов аллергии типа III. Этот тип аллергической реакции является ключевым звеном патогенеза сывороточной болезни, мембранозного гломерулонефрита, альвеолитов, васкулитов, узелковых периартериитов, феномена Артюса и других.
Сывороточная болезнь - аллергическое заболевание немедленного типа, вызываемое введением гетерологичных или гомологичных сывороток или сывороточных препаратов и характеризуется преимущественным воспалительным повреждением сосудов и соединительной ткани, которое развивается через 7-12 дней после введения чужеродной сыворотки.
Феномен Артюса – это гиперергическая реакция, то есть реакция, характеризующаяся резким ускорением процесса воспаления в ответ на действие тех или иных раздражителей. В ее основе лежит образование иммунных комплексов (состоящих из иммуноглобулинов — белков, защищающих организм от чужеродных агентов (бактерий, вирусов, грибов), которые откладываются на стенке капилляров (мелких кровеносных сосудов), негативно влияя на организм, вызывая аллергический васкулит (воспаление сосудов аллергической природы)). Как правило, такая реакция возникает в ответ на повторное введение лекарственного средства, на которое есть аллергия, подкожно или внутримышечно. Реакция может развиться как через 1-2 дня, так и через 1 месяц после введения лекарственного препарата. В среднем, это происходит через 7-9 дней. Тяжесть повреждения тканей при феномене Артюса зависит от природы и времени экспозиции (продолжительности воздействия) вводимого вещества: если контакт длился недолго, то все симптомы обратимы, если воздействие было длительным, то может наблюдаться тканевая деструкция (разрушение).
Причины
• Компоненты микроорганизмов, одно- и многоклеточных паразитов, грибов, гельминтов, вирусов, а также вируссодержащие клетки.
• Собственные, но изменённые и чужеродные белки.
• Гаптены: например, ЛС (пенициллин, новокаин), органические мелкомолекулярные соединения (динитрохлорфенол).
Патогенез Стадия сенсибилизации
• Происходит антигензависимая дифференцировка Т-лимфоцитов. Эти сенсибилизированные Т-клетки циркулируют во внутренней среде организма, выполняя надзорную функцию. Часть лимфоцитов находится в организме в течение многих лет, храня память об Аг.
• Повторный контакт иммунокомпетентных клеток с Аг (аллергеном) обусловливает бластгрансформацию, пролиферацию и созревание большого числа различных Т-лимфоцитов, но преимущественно Т-киллеров. Именно они совместно с фагоцитами обнаруживают и подвергают деструкции чужеродный Аг, а также — его носитель.
Патобиохимическая стадия
• Сенсибилизированные Т-киллеры разрушают чужеродную антигенную структуру, непосредственно действуя на неё
• Т-киллеры и мононуклеары образуют и секретируют в зоне аллергической реакции медиаторы аллергии, регулирующие функции лимфоцитов и фагоцитов, а также подавляющие активность и разрушающие клетки-мишени.
В очаге аллергических реакций типа IV происходит ряд существенных изменений.
- Повреждение, разрушение и элиминация клеток-мишеней
- Альтерация, деструкция и элиминация неизменённых клеток и неклеточных элементов тканей.
- Развитие воспалительной реакции. В очаге аллергического воспаления накапливаются преимущественно мононуклеарные клетки: лимфо- и моноциты, а также макрофаги. Часто эти и другие клетки (фанулоциты, тучные) скапливаются вокруг мелких вен и венул, образуя периваскулярные манжетки.
- Образование гранулём, состоящих из лимфоцитов, мононуклеарных фагоцитов, формирующихся из них эпителиоидных и гигантских клеток, фиб-робластов и волокнистых структур. Гранулёмы типичны для аллергических реакций типа IV. Этот тип воспаления обозначается как гранулёматозный (в частности при туберкулиновых, бруцеллиновых и подобных им реакциях).
- Расстройства микрогемо- или лимфоциркуляции с развитием капиллярот-рофической недостаточности, дистрофии и некроза ткани.
Патогенез шока
Основа:несоответствие потребностей метаболизма и его циркуляторного,обеспечения.
1. Возбуждение сосудо-двигательного центра, избыточный выброс катехоламинов, тиреоидных гормонов- генерализованная вазоконстрикция ,↑АД, раскрываются артериовенозные анастомозы(шунтирование кровотока) Что приводит к:-увеличению числа рециркуляции крови(централизация кровообращения") - переход крови из артерий с высоким уровнем давления в вены,что↑ давление в них,в рез затрудняется отток крови в вены из капилляров. Происходит замедление капиллярного кровотока,снабжение тканей кислородом нарушается.
2. Нарастающая гипоксия тканей усугубляется возросшими в связи с активизацией (за счет возбуждения ЦНС, гипоталамуса, в частности) обменных процессов потребности в кислороде.Затруднение оттока крови в вены сопряжено также с депонированием крови в капиллярном русле и↓ m циркулирующей крови. К концу эректильной стадии из общей циркуляции исключается до 20-30% крови.
3. Травма сопровождается значительной кровопотерей→возврат крови к сердцу и ударный объем крови падает.Значительная тахикардия,усугубляет положение,т.к.резко сокращается период диастолы,и полости сердца не успевают заполниться кровью:сердце,тратя энергию на сокращения, работает вхолостую.МОК резко падает.Компенсаторно-приспособительная р-я(учащение сокращений сердца) переходит при чрезмерной её выраженности в противоположность и становится патологической.
4. При переходе шока в торпидную стадию высокий тонус сосудов сменяется гипотонией, формируются многочисленные порочные круги ,в рез.разбалансировка гемодинамики и метаболизма достигает такой степени,что обратное развитие процесса нередко становится уже невозможным.
Причины.
Физические факторы . Наиболее частые физические факторы: механическая травма тканей, чрезмерно высокая или низкая температура, воздействие электрического тока или лучистой энергии, внедрение в ткань инородного тела и т.п.
Химические факторы : экзо- и эндогенные органические или неорганические кислоты и щелочи в высоких концентрациях; избыток в тканях органических соединений: продуктов метаболизма, экскретов, компонентов биологических жидкостей; ЛС, вводимые в ткани и др.
Биологические агенты — одна из наиболее распространённых причин воспаления: инфекционные; иммуноаллергические; токсины насекомых, животных, растений.
Экзогенные воспалительные факторы. Биологические агенты, инфекционно-паразитарные возбудители, токсины и яды растений, насекомых и животных. Чужеродная плазма, сыворотка или цельная кровь; взвеси клеток; трансплантированные ткани или органы.
Эндогенные факторы. Биологические агенты (продукты деструкции повреждённых или погибших тканей, например, в результате их ушиба, ожога, отморожения или нарушения кровотока в них; активировавшаяся условно-патогенная микрофлора; иммуноаллергические комплексы Аг+АТ+комплемент и др.). Эндогенные химические агенты (в частности продукты нормального или нарушенного метаболизма, если они не выводятся из организма с экскретами).
Принято выделять следующие компоненты воспаления: альтерация, сосудистые реакции и изменения крово- и лимфообращения, экссудация и эмиграция лейкоцитов, фагоцитоз, пролиферация.
Зона первичной альтерации.
Причина формирования : флогогенный фактор, действующий на ткань.
Локализация : место прямого контакта причины воспаления с тканью (эта зона — эпицентр очага воспаления).
Основные механизмы
• Повреждение мембранных структур и внутриклеточных ферментов, а также структур межклеточного вещества.
• Расстройства энергетического обеспечения функций и пластических процессов в повреждённой ткани.
• Нарушения трансмембранного переноса и градиента ионов, соотношения их между собой, содержания жидкости внутри и за пределами клетки и в зоне альтерации в целом.
Проявления
• Расстройства функции повреждённых, но ещё жизнеспособных участков ткани вне зоны некроза.
• Некроз.
• Значительные физико-химические изменения.
• Различные формы дистрофии.
Зона вторичной альтерации
Причины
• Эффекты флогогенного агента (хотя за пределами эпицентра очага воспаления эффективность его патогенного воздействия значительно ниже).
• Влияние факторов, вторично формирующихся в зоне первичной альтерации в связи с образованием медиаторов воспаления, развитием метаболических, физико-химических и дистрофических изменений.
Локализация
• Частично в месте контакта флогогенного агента с тканью (там, где сила его воздействия была минимальной).
• В основном вокруг области первичной альтерации. Обычно площадь этой зоны значительно больше площади первичной.
Механизмы развития
• Расстройства местных механизмов нервной регуляции в связи с повреждением тел нейронов, нервных стволов и/или их окончаний, синтеза, накопления и высвобождения из них нейромедиаторов.
• Нарушение выброса нейромедиаторов (норадреналина, ацетилхолина и др.) из нервных терминалей симпатической и парасимпатической системы в очаге воспаления и стадийные изменения чувствительности тканей к нейромедиаторам в этом очаге.
• Расстройства аксонного транспорта трофических и пластических факторов (углеводов, липидов, белков, адениннуклеотидов, нуклеиновых кислот, БАВ, ионов и других агентов) от тел нейронов к соматическим клеткам.
• Стадийные изменения тонуса сосудов микроциркуляторного русла и в связи с этим — расстройства кровообращения
• БАВ, поступающие в зону вторичной альтерации из зоны первичной альтерации, а также образующие за пределами очага воспаления.
В совокупности эти изменения обусловливают расстройства обмена веществ, значительные физико-химические сдвиги в зоне вторичной альтерации, развитие различных видов дистрофий и даже некроза.
Проявления • Изменения структуры клеток и межклеточного вещества тканей, обычно обратимые (например, признаки повреждения клеток, архитектуры ткани и др.).
• Расстройства метаболизма (выражается различными отклонениями в обмене веществ и развитии).
• Умеренные отклонения физико-химических параметров (например, рН, осмоляльности жидкости, температуры тканей, трансмембранного распределения ионов).
• Обратимые изменения функции тканей и органов.
Долговременная адаптация
Причина включения механизмов долговременной адаптации к гипоксии: повторная или продолжающаяся недостаточность биологического окисления умеренной выраженности.
Условия включения механизмов долговременной адаптации к гипоксии
• Повторное или длительно продолжающееся воздействие умеренной гипоксии, вызывающее многократную активацию срочных механизмов адаптации.
• Выраженность умеренной гипоксии.
• Оптимальное состояние жизнедеятельности организма.
Стадии лихорадки. Терморегуляция на разных стадиях лихорадки. Изменения обмена веществ и физиологических функций организма при лихорадке. Виды лихорадки и типы температурных кривых при лихорадке. Биологическое значение лихорадочной реакции.
1) Stadium incrementi - стадия подъема температуры тела,
2) Stadium fastigii - стадия стояния высокой температуры,
3) Stadium decrementi - стадия снижения температуры и возврат ее к норме.
Клиническая характеристика стадий:
1-я стадия - повышение температуры - характеризуется ознобом, сопровождающимся ощущением холода. Патогенез озноба - происходит спазм сосудов кожи и понижение температуры кожи на 10-12 градусов (кроме подмышечной и паховой области). Это вызывает раздражение холодовых рецепторов (ощущение холода) и ответную реакцию на холод - мышечную дрожь. Субъективно все это воспринимается, как озноб. Подъем температуры тела может быть быстрым, а озноб очень сильным и наоборот, медленным, постепенным, с незначительным ознобом или даже без него.
Во второй стадии (патогенез ощущения жара) больной говорит, что он горит от жара. Это ощущение обусловлено расширением сосудов кожи при высокой температуре тела. По особенностям температурной кривой (высоты подъема) в зависимости от характера ее колебаний в течение суток различают следующие виды лихорадки:
1) субфебрильную - до 38 градусов,
2) умеренную - 38-39 градусов,
3) высокую - 39-40 градусов и
4) чрезмерную - гиперпиретическую (41 градус и выше). Во время лихорадки температура тела может доходить до 42 градусов. При превышении этой границы возникают глубокие нарушения функции ЦНС и может возникнуть угроза для жизни больного.
Степень повышения температуры при различных заболеваниях зависит:
1) от реактивности организма (например у холериков температура тела выше),
2) от введения возбуждающих ЦНС веществ: кофеин, фенамин (а наркоз и бромиды снижают реакцию),
3) от пирогенной активности микробов,
4) от интенсивности выработки эндогенных пирогенов, то определяется количеством лейкоцитов,
5) от функционального состояния центров терморегуляции и образования медиаторов.
Типы лихорадочных (температурных) кривых:
1) постоянная температурная кривая (febris continua) - колебания в пределах не более 1 градуса,
2) ремиттирующая - febris remittens - или послабляющая (колебания температуры в пределах 1,5 - 2 градусов),
3) перемежающаяся или интермиттирующая - febris intermittens- это правильное чередование нормальной температуры с периодами подъема,
4) возвратная - febris recurrens -5-7 дней лихорадка и 3-4 дня норма, т.е. промежутки между лихорадочным периодом и периодами нормы, как правило, не одинаковые.
5) изнуряющая или гектическая - febris hectica колебания температуры в течение суток доходят до 3-5 градусов (утром норма, вечером 40 градусов). При этом лихорадка может быть атипичной, когда утром температура выше, чем вечером.
Состояние центров теплорегуляции находит отражение в характере температурной кривой:
● лихорадка постоянного типа свидетельствует об устойчивом - оптимальном возбуждения центра терморегуляции,
● ремиттирующая кривая свидетельствует о неустойчивости возбуждения центра терморегуляции,
● интермиттирующая лихорадка характерна для септического состояния.
● неблагоприятно протекает гектическая - она свидетельствует о том, что периоды возбуждения центра терморегуляции сменяются периодами запредельного торможения. Характер температурной кривой отражает состояние реактивности еще ряда центров: ДЦ и ВМЦ.
Патогенез 3 стадии (снижения температуры) проявляется клинически потоотделением. Потоотделение является основным видом отдачи тепла в период снижения температуры и возврата ее к норме. Температура тела может падать быстро (критически) и медленно (литически). Быстрое падение температуры может быть опасным, особенно у лиц пожилого возраста, перенесших инфаркт миокарда или имеющих кардиосклероз. Кризис может привести к коллапсу от острой сердечной недостаточности.
Биологическое значение лихорадки - в основном создание более высокого температурного фона для обменных процессов, что ведет к повышению уровня защитных реакций:
1) активирование ферментов,
2) усиление фагоцитоза.
Известно, что биохимические процессы протекают значительно быстрее при температуре 39 градусов, чем при 36. Это одна из приспособительных реакций организма.
64. Опухоли, роль бластомогенных факторов химического и физического характера, онкогенных вирусов. Биологические особенности доброкачественных и злокачественных новообразований. Отличие опухолевой клетки от нормальной.
Опухоль - это типический патологический процесс, главным признаком которого является вызванное действием внешних факторов бесконечное и неконтролируемое организмом размножение клеток с нарушением их способности к дифференцировке и формированию организованных структур, т.е. местное патологическое разрастание ткани. (2 этапа: инициации и промоции)
Особенности опухоли:
1) атипия органоидного строения,
2) способность к бесконечному размножению,
3) утрата или уменьшение способности к дифференцировке,часто невозможно установить к какой ткани они принадлежат,
4) относительная автономия и независимость от регулирующего влияния организма. Клетки не могут организовать полноценные структуры и плохо взаимодействуют друг с другом,
5) опухоль способна к проникающему - инвазивному росту,
6) клетки способны метастазировать - распространяться от первичного очага,
7) есть еще ряд особенностей: а) антигенных свойств, в) обмена веществ, б) химического состава.
химические канцерогены. К возникновению опухолей приводят преимущественно факторы сгорания табака; химические агенты, входящие в состав пищи и соединения, используемые в различных сферах производства. Примеры: компоненты сгорания угля в печах часто вызывают рак мошонки у трубочистов; асбест — мезотелиому плевры, табакокурение — плоскоклеточную карциному лёгких.
Наиболее опасные канцерогены относятся к нескольким классам химических веществ.
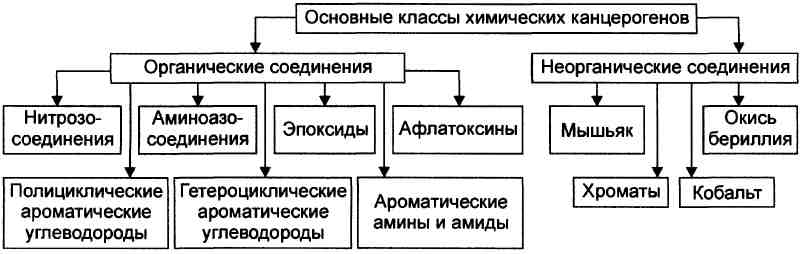
К канцерогенам биологической природы относят онкогенные (опухолеродные) вирусы. Роль вирусов в канцерогенезе привлекает внимание, с одной стороны, как самостоятельная проблема, а с другой, в связи с тем, что большое число клеточных протоонкогенов сходны с онкогенами ретровирусов. Примеры. Вирус Эпстайна—Барр приводит к развитию лимфомы Беркетта и носоглоточной карциномы; вирус простого герпеса 2 — рака шейки матки; вирус Т-клеточного лейкоза человека типа 1 — Т-клеточного лейкоза у взрослых; вирус гепатита В — гепатоклеточной карциномы.
Онкогенные вирусы.
♦ ДНК-вирусы, вызывающие опухолевую трансформацию, называют онковирусами. Гены ДНК-онковирусов способны непосредственно внедряться в геном клетки-мишени. Участок ДНК-вируса (собственно онкоген), интегрированный с клеточным геномом, может осуществить опухолевую трансформацию клетки. Не исключают также, что один из генов онковируса может играть роль промотора клеточного протоонкогена. К ДНК-содержащим онковирусам относят некоторые аденовирусы, паповавирусы и герпесвирусы (так, вирус Эпстайна-Барр вызывает развитие лимфом, а вирус гепатита B способен инициировать рак печени).
♦ РНК-содержащие вирусы, относящиеся к ретровирусам. Интеграция РНК-генов ретровирусов в клеточный геном происходит не непосредственно, а после образования их ДНК-копий.
Физические канцерогенные факторы. К ним относятся, главным образом, радиационное и ультрафиолетовое излучения.
Примеры: ультрафиолетовый спектр света может вызвать плоскоклеточную карциному кожи; ионизирующее излучение — рак лёгких у шахтёров урановых рудников, лейкозы у переживших атомную бомбардировку (Хиросима) и атомную катастрофу (Чернобыль); а папиллярный рак щитовидной железы возникает у больных, прошедших лучевую терапию области шеи.
Доброкачественные опухоли. Характеризуются медленным ростом. Обладают признаками тканевого атипизма. Клетки зрелые, очень похожи на клетки нормальной ткани: Не метастазируют. Не рецидивируют. Вторичные изменения возникают редко, обычно в больших опухолях и чаще представлены петрификацией, ослизнением.
Злокачественные опухоли. Обладают преимущественно инфильтрирующим ростом. Растут быстро. Имеют признаки как тканевого, так и клеточного атипизма. Степень дифференцировки клеток может быть различной (высокой, умеренной и низкой), но клетки не достигают полной зрелости. Метастазируют. Рецидивируют. Обычно выражены вторичные опухолевые изменения: некроз, кровоизлияния.
Виды азотистого баланса
•Нулевой (количество поступающего и выводящегося азота совпадает).
•Положительный (количество азота, поступающего в организм, выше, чем выводящегося). Наблюдается как в норме (например, при регенерации тканей или беременности), так и в патологии (например, при гиперпродукции соматотропного гормона или полицитемии).
•Отрицательный (количество азота, поступающего в организм меньше, чем выводящегося). Наблюдается, например, при голодании, стресс‑реакциях, тяжелом течении СД, гиперкортицизме.
Патогенез.
Сахарный диабет, его виды. Нарушения углеводного и других видов обмена и физиологических функций при сахарном диабете. Диабетические комы (кетоацидотическая, гиперосмолярная), их патогенетические особенности.
САХАРНЫЙ ДИАБЕТ - заболевание, которое характеризуется нарушением всех видов метаболизма и расстройством жизнедеятельности организма; развивается в результате гипоинсулинизма (т.е. абсолютной или относительной инсулиновой недостаточности).
Первичные формы сахарного диабета. Первичные формы СД характеризуются отсутствием у пациента каких-либо определённых заболеваний, вторично приводящих к развитию диабета. Выделяют две разновидности первичного СД:
• инсулинзависимый сахарный диабет (ИЗСД);
• инсулиннезависимый сахарный диабет (ИНСД).
Вторичные формы сахарного диабета. Вторичные формы СД характеризуются наличием у пациента какой-либо основной болезни или патологического состояния, повреждающих поджелудочную железу, а также действие на неё физических или химических факторов. Это приводит к возникновению СД. К таким болезням, патологическим состояниям и факторам относятся:
• Заболевания, поражающие ткань поджелудочной железы (например, панкреатит).
• Другие болезни эндокринной системы (например, семейный полиэндокринный аденоматоз).
• Воздействие на поджелудочную железу химических или физических агентов.
 Сахарный диабет типов I и II . В более ранних классификациях выделяли СД типов I и II. Эти обозначения вначале применяли как синонимы ИЗСД и ИНСД соответственно
Сахарный диабет типов I и II . В более ранних классификациях выделяли СД типов I и II. Эти обозначения вначале применяли как синонимы ИЗСД и ИНСД соответственно
Инсулиновая недостаточность сопровождается нарушением всех видов обмена веществ в организме, прежде всего углеводного, проявлением чего является гипергликемия и гликозурия.
Основными причинами гипергликемии являются: замедление гексокиназной реакции (→ замедление образования глюкозо-6-фосфата→ замедление синтеза гликогена, пентозофосфатного пути и гликолиза), усиление гликонеогенеза ( недостаток Г-6-Ф компенсируется реакцией гликонеогенеза) и повышением активности Г-6-Ф (→ повышение глюкозообразования в печени и понижение образования гликогена).
Гипергликемия и нарушение процессов фосфорилирования и дефосфорилирования глюкозы в канальцах нефрона приводят к гликозурии. Повышение осмотического давления мочи приводит к полиурии, которая приводит к обевоживанию организма и к усиленной жажде ( полидипсия).
Нарушения обмена жиров: ожирение печени (из-за повышенного липолиза и поступления жирных кислот в печень, повышенное образование кетоновых тел)
Нарушение белкового обмена: угнетение анаболических процессов, усиление катаболизма белков с использованием дезаминированных аминокислот для гликонеогенеза → отрицательный азотистый баланс.
Осложнения: Диабетическая кома = гиперкетонемическая= гипергликемическая. (возникает из-за интоксикации организма кетоновыми телами.) Характеризуется потерей сознания, дыханием типа Куссмауля, снижением артериального давления. Кома может развится при отсутствии кетоновых тел, но при гиперкликемии 50 ммоль/л и выше.
Диабетический кетоацидоз. Диабетический кетоацидоз характерен для ИЗСД. Кетоацидоз и кетоацидоти-ческая кома относятся к числу основных причин смерти пациентов с диабетом.
Причины : Недостаточное содержание в крови инсулина и/или его эффектов и Повышение концентрации и/или выраженности эффектов контринсу-лярных гормонов (глюкагона, катехоламинов, СТГ, кортизола, тирео-идных).
Механизм развития включает несколько звеньев: существенная активация глюконеогенеза, протекающая на фоне стимуляции гликогенолиза, протеолиза и липолиза; нарушение транспорта глюкозы в клетки, ведущее к нарастанию гипергликемии; стимуляция кетогенеза с развитием ацидоза.
Гиперосмолярная кома. Гиперосмолярная некетоацидотическая (гипергликемическая) кома наиболее характерна для пожилых пациентов с ИНСД. Гиперосмолярная кома развивается существенно медленнее, чем кетоацидотическая. Однако летальность при ней выше.
Причины
• избыточное (более 12 г в сутки) поступление натрия в организм
• сниженное выведение натрия из организма
• гипогидратация организма, сочетающаяся с гиповолемией
• гемоконцентрация вследствие перераспределения жидкости из сосудов в ткани.
проявления. гиперосмоляльность крови и других внеклеточных жидкостей, расстройства высшей нервной деятельности, гипогидратация клеток, повышение нервно-мышечной возбудимости, отёк, артериальная гипертензия.
Причины гипонатриемии
• недостаточное (менее 8—6 г в сутки) поступление натрия в организм
• избыточное выведение натрия из организма
• гемодилюция — увеличение содержания воды в крови
проявления. гипоосмоляльность крови и других внеклеточных жидкостей, снижение тургора кожи и слизистых, мышечная гипотония, гипергидратация клеток, расстройства высшей нервной деятельности, снижение нервно-мышечной возбудимости, артериальная гипотензия, диспептические расстройства.
Нарушения обмена калия
к+ является основным катионом внутриклеточной жидкости. расстройства метаболизма калия проявляются гиперкалиемией или гипокалиемией.
гиперкалиемия. гиперкалиемия — увеличение [к+] в сыворотке крови выше нормального уровня (более 5,5 ммоль/л).
Причины гиперкалиемии
• уменьшение экскреции почками в результате:
• перераспределение калия из клеток в кровь вследствие:
• введение избытка калия в организм (с продуктами питания или лс) не приводит к стойкой гиперкалиемии.
проявления. мышечная гипотония, атония кишечника, паралич мышц, боли в мышцах, брадикардия, аритмии сердца.
Причины гипокалиемии
• недостаточное (менее 10 мэкв/сут) поступление калия в организм с пищей.
• избыточное выведение калия из организма
• перераспределение к+ из крови и/или межклеточной жидкости в клетки
проявления. снижение нервно-мышечной возбудимости, мышечная гипотония, гипокинезия желудка и кишечника, дистрофия тканей, артериальная гипотензия, психастения, аритмии сердца, остановка в дисастоле, внутриклеточный ацидоз.
Нарушения обмена кальция
обмен кальция тесно связан с обменом фосфора: гиперкальциемия обусловливает снижение уровня фосфатов в крови, а гипокальциемия — увеличение.
гиперкальциемия. гиперкальциемия — повышение общего содержания кальция в сыворотке крови выше нормы (более 2,57 ммоль/л, или 10,3 мг%).
Причины гиперкальциемии
• избыточное поступление солей кальция в организм
• уменьшение экскреции са2+ почками
• перераспределение кальция из тканей в кровь
• усиление ионизации кальция
• злокачественные опухоли — одна из наиболее частых причин гиперкальциемии
Проявления
гиперкальциурия, нефро- и уролитиаз, остеопороз, психоневрологические расстройства, желудочно-кишечные расстройства.
Нарушения обмена фосфора
метаболизм фосфора тесно связан с обменом кальция. фосфор является одним из основных минеральных компонентов костной ткани.
гиперфосфатемия. гиперфосфатемия — увеличение концентрации фосфатов в сыворотке крови выше нормы (более 1,45 ммоль/л, или 4,5 мг%).
Причины гиперфосфатемии
• введение в организм избытка фосфатов.
• уменьшение выведения фосфатов из организма
• увеличение высвобождения фосфатов из тканей
проявления. артериальная гипотензия, гипокальциемия, сердечная недостаточность.
Причины гипофосфатемии
• недостаточное поступление фосфатов с пищей.
• чрезмерное выведение фосфатов из организма
• избыточная потеря фосфатов через жкт.
• перераспределение фосфатов из крови и межклеточной жидкости в клетки
проявления. фосфатурия, мышечная гипотензия и гипокинезия, расстройства высшей нервной деятельности, сердечная недостаточность, остеомаляция, остеопороз.
Нарушения кислотно-основного равновесия. Ацидозы, алкалозы и их виды. Расстройства в организме при различных видах ацидозов и алкалозов. Компенсаторные реакции организма при нарушениях кислотно-основного равновесия.
КЩР зависит от состояния буферных систем (бикарбонатный, фосфатный, белковый, гемоглобиновый).
Ацидоз – повышение в крови кислого компонента (РН низкий) и водородных ионов.
Алкалоз – повышение в крови абсолютного и относительного количества оснований и водородных ионов.
По механизму развития различают газовые (дыхательные, респираторные) и негазовые (обменные, метаболические).
Газовый ацидоз развивается при избытке угольной кислоты в организме (гиперкапния). Причины:
1.недостаточность внешнего дыхания (заболевания легких, угнетение дыхательного центра).
2. Недостаточность кровообращения.
3. Высокая концентрация СО2 в воздухе.
Срочная компенсация – раздражение дыхательного центра – одышка. СО 2 в крови находится в виде Н+ и НСО3. Н+ в гемоглобине, НСО3 в плазме в обмен на ионы хлора. Компенсаторные механизмы направлены на связывание СО2 и увеличение бикарбонатов, то есть на сохранение соотношения между Н2СО3 и NаНСО3 1:20 (компенсированный ацидоз). При дальнейшем накоплении СО2 соотношение становится меньше 1:20 (декомпенсированный ацидоз) – происходит на фоне гипоксии и переходит на метаболический ацидоз. При высоком СО2 сужаются бронхи, увеличивается слиз, нарушается кровообращение, снижается образование мочи, повышается уровень катехоламинов, но давление крови падает, так как ослаблены адренорецепторы.
Газовый алкалоз. Гипокапния вследствие гипервентиляции, снижается возбудимость дыхательного центра, появляется периодическое дыхание, угнетение сосудодвигательного центра, сосудистая гипотезия, падает минутный обьем сердца, падает осмотическое давление крови (из-за выведения солей натрия и калия), возрастает диурез, развивается обезвоживание. При сохранении соотношения между Н2СО3 и NаНСО3 1:20 (компенсированный алкалоз). При дальнейшем снижении СО2 соотношение становится больше 1:20 (декомпенсированный алкалоз).
Негазовый ацидоз. Частая и тяжелая форма. Причины:
1.избыточное образование кислых продуктов (кетоновые тела, ацетоуксусная, молочная кислота) при сахарном диабете, гипоксии, голодании;
2. Нарушение выведения кислых продуктов почками;
3. Потеря щелочей при поносах, кишечных свищах.
Компенсаторные механизмы:
-Разбавление кислых продуктов внеклеточными жидкостями.
-Выведение СО2, который образуется при соединении бикарбонатов с кислыми продуктами.
-Включается белковый буфер.
При сохранении соотношения между Н2СО3 и NаНСО3 1:20 (компенсированный ацидоз). При дальнейшем накоплении кислых продуктов соотношение становится меньше 1:20 (декомпенсированный ацидоз).
Последствия: нарушение сердечней деятельности, падение АД, понижается сродство кислорода к гемоглобину, гипоксия и гипоксемия.
Негазовый алкалозю Причины:1. Введение в организм большого количества щелочных веществ (бикарбоната, цитрата, лактата). 2. Потеря большого количества желудочного сока (неукротимая рвота, желудочный свищ, стеноз привратника). 3. Гиперпродукция глюкокотикоидов. 4. Описан врожденный метаболический алкалоз у детей (хлордиарея). В основе лижит потря хлора и калия с изменением в кишечнике.
Компенсаторные механизмы направлены на удаление избытка бикарбонатов и задержка углекислоты. При понижении в крови водородных ионов тормозится дыхательный центр, в результате снижается легочная вентиляция и в крови накапливается СО2. Соотношение Н2СО3 : NаНСО3 сохраняется на 1:20. Одновременно белки отдают водородные ионы и связывают натрия. С мочой выделяется большое количество бикарбоната и двуосновного фосфата (компенсированный алкалоз). Однако повышается возбудимость дыхательного центра СО2 удаляется, увеличивается в крови ионы кальция, начинаются судороги (декомпенсированный алкалоз).
Гипервитаминоз A
• Причины
♦ Передозировка препаратов этого витамина.
♦ Избыточное употребление в пищу печени белого медведя, тюленя, кита, моржа, содержащей большое количество свободного витамина А.
• Проявления гипервитаминоза А: торможение процессов остео- и хондрогенеза, деструкция хрящевой и костной ткани, остеопороз и кальцификация органов, торможение протеосинтеза.
Витамин D (холекальциферол и эргокальциферол, антирахитический витамин) совместно с ПТГ и кальцитонином регулирует уровень Ca2+
и фосфатов в плазме крови, а также - насыщение кальцием костей. Биологический эффект витамина D заключается в стимуляции всасывания Ca2+ и фосфатов в кишечнике и в почечных канальцах.
Гиповитаминоз D
• Причины:
♦ Приобретённые формы гиповитаминоза D обусловлены недостаточным поступлением витамина в организм с пищей и его образованием в коже под действием солнечных лучей.
♦ Наследственные формы гиповитаминоза D обусловлены дефектами генов, кодирующих полипептиды, которые принимают участие в метаболизме витамина.
• Проявления:
♦ Ослабление минерализации костной ткани (остеопороз) и частые переломы костей.
♦ Искривление рук, ног и позвоночника; деформация и размягчение плоских костей черепа.
♦ Мышечная гипотония развивается вследствие нарушения иннервации мышц и расстройств обменных процессов в них.
♦ У детей развивается рахит: происходит рассасывание элементов костной ткани и размягчение костей (остеомаляция), на границе кости и хряща образуются рахитические чётки.
Гипервитаминоз D
• Причины:
♦ Острое или хроническое избыточное введение в организм препаратов витамина D.
♦ Генетически обусловленная повышенная чувствительность к витамину.
• Проявления:
♦ Гиперкальциемия.
♦ Почечная недостаточность.
♦ Повышенное АД и сердечные аритмии.
♦ Сердечная недостаточность (является следствием кальцификации клапанов сердца и перегрузки миокарда).
♦ Изменения психоневрологического статуса циклического характера (вялость, угнетённость состояния, сонливость, которые сменяются периодами возбуждения и повышенной двигательной активности). Возможны также потеря сознания, кома и развитие гиперкальциемических клонико-тонических судорог.
Витамин E (токоферол) выполняет роль антиоксиданта, тормозит СПОЛ, участвует в биосинтезе гема и белков, в тканевом дыхании. В умеренных дозах α-токоферол является иммуностимулятором, активирующим как гуморальный, так и клеточный иммунитет, что повышает резистентность организма к инфекции.
Гиповитаминоз Е
Первичный гиповитаминоз Е развивается у младенцев при искусственном вскармливании, а также у детей при недостатке белка в рационе. Вторичный гиповитаминоз Е встречается чаще.
• Причины:
♦ Нарушения пищеварения (недостаточность поджелудочной железы, дефицит жёлчных кислот, заболевания тонкого кишечника).
♦ Нарушения транспорта витамина Е (дефект токоферол-связывающего белка, гипопротеинемия).
♦ Прочие причины: гельминтозы, лямблиоз, приём некоторых ЛС.
• Проявления:
♦ Гемолиз эритроцитов с развитием гемолитической анемии.
♦ Креатинурия.
♦ Отложения сфинголипидов в мышцах.
♦ Демиелинизация аксонов нейронов центральной и периферической нервной системы обусловливает мозжечковую атаксию, периферические невропатии, нарушения проприоцептивной чувствительности.
Гипервитаминоз E. При ошибочном введении больших доз витамина Е (100 мг/кг/сут) у детей может развиться некротизирующий энтероколит и сепсис.
Витамин K участвует в синтезе ряда факторов свёртывания крови в печени: II (протромбин), VII (проконвертин), IX (фактор Кристмаса), X (фактор Стюарта-Прауэр).
Гиповитаминоз К
• Причины
♦ Нарушение синтеза витамина К кишечной микрофлорой, например, при пероральном приёме антибиотиков и сульфаниламидов.
♦ Нарушение всасывания витамина К.
♦ Печёночная недостаточность.
♦ Приём антикоагулянтов непрямого действия.
♦ У новорождённых кишечник ещё не заселён микрофлорой, способной синтезировать витамин К в достаточном количестве.
Случаи дефицита витамина К вследствие недостаточного его поступления с пищей не описаны.
• Проявления:
♦ Геморрагический синдром (носовые, желудочно-кишечные кровотечения, кровотечения из дёсен, внутрикожные и подкожные кровоизлияния).
♦ У новорождённых детей могут возникать внутричерепные кровоизлияния.
Гипервитаминоз K
Гипервитаминоз K развивается только у новорождённых и характеризуется развитием гемолитического синдрома.
• Причины:
♦ Применение препаратов витамина К (например, фитоменадиона) у детей с недостаточностью глюкозо-6-фосфат дегидрогеназы.
♦ Передозировка препаратов витамина К.
• Проявления: развитие гемолитической анемии, гипербилирубинемии и ядерной желтухи (особенно у недоношенных детей).
Гиповитаминоз биотина
• Причины:
♦ Потребление большого количества сырого яичного белка.
♦ Дисбактериоз кишечника.
• Проявления: дерматиты, сочетающиеся с избыточной продукцией секрета сальных желёз кожи, выпадением волос, ломкостью ногтей; мышечные боли; анемии; психические расстройства.
Пантотеновая кислота (витамин B5) в виде кофермента A участвует в реализации многих биохимических процессов: окисления и синтеза жирных кислот; окислительного декарбоксилирования α-кетокислот; цикла трикарбоновых кислот; синтеза нейтральных жиров, стероидных гормонов, фосфолипидов, ацетилхолина, гема и многих других.
Перегрузочная форма сердечной недостаточности. Механизмы срочной и долговременной адаптации сердца к перегрузкам. Гипертрофия миокарда, стадии, особенности гипертрофированного сердца, механизм его декомпенсации.
Перегрузочная форма сердечной недостаточности возникает при исходно нормальной сократимости миокарда на фоне избыточной нагрузки на сердце (в условиях повышенного притока или, наоборот, затруднения оттока крови). Перегрузка возможна при пороках сердца, артериальной гипертензии, гиперволемии, чрезмерной активности симпатоадреналовой системы, беременности, ожирении и других состояниях. Различают перегрузку сердца объёмом (при гиперволемии, недостаточности митрального или аортального клапанов) и сопротивлением (при артериальных гипертензиях, стенозе устья аорты или лёгочной артерии, коарктации аорты).
Механизм долговременной адаптации: При тяжелой (стрессовой) физической нагрузке происходит резкое уменьшение резервов АТФ, вследствие чего отношение продуктов ее распада к оставшемуся количеству возрастает. Увеличение продуктов энергообмена АТФ активирует накопление энергии в макроэргах. При этом активируется биосинтез нуклеиновых кислот и белка, что является основой долговременной адаптации. В процессе долговременной адаптации растет масса и увеличивается мощность внутриклеточных систем транспорта кислорода, питательных и биологически активных веществ, завершается формирование доминирующих функциональных систем, наблюдаются специфические морфологические изменения во всех органах, ответственных за адаптацию. Так, масса сердца может увеличиться на 20-40 %; при нормальных темпах адаптации параллельно увеличивается и капиллярная сеть сердечной мышцы.
Механизм срочной адаптации: Связан с увеличением катехоламинов во время физической нагрузки. Установлено, что под влиянием катехоламинов увеличивается количество Са-каналов сарколеммы, способных открываться во время потенциала действия (катехоламины через цАМФ-опосредованный механизм вызывают фосфорилирование белков Са-каналов). В результате этих процессов увеличивается поступление ионов кальция в саркоплазму, где повышается их концентрация, и, как следствие, увеличивается сила сокращений кардиомиоцитов, поскольку возрастает количество образующихся кальций-тропониновых комплексов.
Инотропное действие катехоламинов является ведущим механизмом адаптации сердца к физическим нагрузкам. При этом показатели кардиодинамики изменяются следующим образом:
а) увеличивается ударный объем;
б) увеличивается минутный объем сердца как за счет увеличения ударного объема, так и за счет увеличения частоты сердечных сокращений (положительный хронотропный эффект катехоламинов);
в) уменьшается конечнодиастолический объем (при рентгеновском исследовании отмечается уменьшение объема сердца);
г) уменьшается конечносистолический объем.
Гипертрофия миокарда — явление приспособительное, направленное на выполнение повышенной работы без существенного повышения нагрузки на единицу мышечной массы миокарда. По динамике изменения обмена, структуры и функции миокарда в компенсаторной гиперфункции сердца можно выделить три основные стадии (Ф.З.Меерсон).
1) Аварийная стадия развивается непосредственно после возникновения порока, характеризуется сочетанием выраженных патологических изменений в миокарде и явлений острой недостаточности сердца с мобилизацией резервов миокарда и организма в целом. В этой стадии наблюдается быстрое (в течение недель) увеличение массы сердца на 30-70\%.
2) Стадия относительно устойчивой гиперфункции. В этой стадии постепенно уменьшаются и даже исчезают патологические изменения обмена и структуры миокарда, нормализуется гемодинамика, масса миокарда увеличена на 100-120\% и больше не растет. Гипертрофированное сердце приспособилось к новым условиям нагрузки, имеется полная компенсация. Эта фаза длительная.
3) Стадия постепенного истощения и прогрессирующего кардиосклероза характеризуется глубокими обменными и морфологическими изменениями, которые исподволь накапливаются в энергообразующих и сократительных структурах мышечной клетки, гибелью части мышечных волокон и заменой их соединительной тканью. Эти изменения приводят к недостаточности сердца и в дальнейшем к недостаточности кровообращения.
Особенности гипертрофированного миокарда. Гипертрофированное сердце отличается от нормального такими структурными, обменными и функциональными признаками:
-Гипертрофированное сердце увеличено в объеме (главным образом за счет цитоплазмы).
-Резко ограничена способность ядра высокодифференцированной клетки к делению, происходит относительное уменьшение массы ядра.
-Ухудшается пластическое обеспечение клетки.
-Длительная и интенсивная нагрузка на сердечное мышечное волокно приводит к его истощению и нарушению функции.
-Вследствие нарушения образования энергии митохондриями и использования энергии сократительным аппаратом возникают изменения сократительной функции мышечного волокна.
-Ухудшается сосудистое обеспечение гипертрофированного миокарда, поскольку увеличение мышечных волокон чаще всего не сопровождается адекватным увеличением капиллярной сети.
-Кардиомиоциты замещаются соединительной тканью и, если 20-30\% массы сердца будет заменено соединительной тканью, нормальная работа сердца невозможна.
Патогенез декомпенсации гипертрофированного сердца.
1. Отставание роста микрососудов от нарастания массы миокарда –> относительная коронарная недостаточность.
2. Отставание биогенеза митохондрий от нарастания массы миофибрилл –> нарушение энергетического обеспечения кардиомиоцитов.
3. Отставание активности АТФазы миозинов от потребной –> снижение сократимости миокарда.
4. Отставание скорости синтеза структур кардиомиоцитов от должной –> нарушение пластических процессов; дистрофия миокарда.
Нарушение секреторной функции желудка. Типы патологической секреции. Нарушения резервуарной и моторной функции желудка. Нарушение эвакуации, отрыжка, тошнота, рвота. Их механизмы, последствия и значение для организма.
В основе нарушений пищеварения в желудке находятся парциальные, а чаще сочетанные расстройства секреторной, моторной, всасывательной, барьерной и защитной функций желудка.
Расстройства секреторной функции желудка классифицируют с учётом нескольких критериев:
• Изменение общего количества сока: увеличение, уменьшение, отсутствие.
• Нарушение динамики секреции.
• Расстройства выработки слизи: повышение, уменьшение, прекращение.
• Нарушение образования соляной кислоты и изменения кислотности сока: гиперхлоргидрия, гипохлоргидрия, ахлоргидрия.
• Нарушение образования и секреции пепсина: увеличение, снижение, прекращение.
В целом указанные нарушения обусловливают несоответствие динамики или уровня секреции различных компонентов желудочного сока реальным потребностям в них.
Причины
♦ Нарушения нервной регуляции двигательной функции желудка: усиление влияний блуждающего нерва усиливает его моторную функцию, а активация симпатической нервной системы подавляет её.
♦ Расстройства гуморальной регуляции желудка. Например, высокая концентрация в полости желудка соляной кислоты, а также секретин и холецистокинин тормозят моторику желудка. Напротив, гастрин, мотилин, сниженное содержание соляной кислоты в желудке стимулируют моторику.
♦ Патологические процессы в желудке (эрозии, язвы, рубцы, опухоли могут ослаблять либо усиливать его моторику в зависимости от их локализации и выраженности процесса).
Последствия
Последствия нарушений моторики желудка: развитие синдрома раннего насыщения, изжоги, тошноты, рвоты и демпинг-синдрома.
• Синдром раннего (быстрого) насыщения - результат снижения тонуса и моторики антрального отдела желудка. Приём небольшого количества пищи вызывает чувство тяжести и переполнения желудка.
• Изжога - ощущение жжения в области нижней части пищевода (результат гастроэзофагеального рефлюкса).
• Тошнота. При подпороговом возбуждении рвотного центра развивается тошнота - неприятное, безболезненное субъективное ощущение, предшествующее рвоте.
• Рвота - непроизвольный рефлекторный акт, характеризующийся выведением содержимого желудка (иногда и кишечника) наружу через пищевод, глотку и полость рта.
♦ Механизмы развития: усиленная антиперистальтика стенки желудка, сокращение мышц диафрагмы и брюшной стенки, расслабление мышц кардиального отдела желудка и пищевода.
♦ Значение рвоты двояко: защитное (при рвоте из желудка устраняются токсичные вещества или инородные тела) и патогенное (потеря организмом жидкости, ионов, продуктов питания).
• Демпинг-синдром - патологическое состояние, развивающееся в результате быстрой эвакуации желудочного содержимого в тонкий кишечник. Развивается, как правило, после удаления части желудка.
♦ Основные звенья патогенеза: гиперосмолярность содержимого тонкого кишечника; интенсивный транспорт жидкости из сосудов в полость кишечника (сопровождается диареей и гиповолемией); активация всасывания глюкозы в кишечнике (развивается гипергликемия); активация синтеза и выделения БАВ (приводят к вазодилатации и артериальной гипотензии).
♦ Основные проявления демпинг-синдрома: прогрессирующая слабость после приёма пищи, аритмии сердца, острая артериальная гипотензия, сонливость, головокружение, тошнота, мышечная дрожь (особенно конечностей), нарушения сознания.
Эвакуация пищевых масс из желудка в ДПК происходит, когда пища становится жидкой, а предыдущая порция кислого химуса нейтрализуется дуоденальным соком. Патология эвакуации выражается в ускорении или замедлении эвакуации.Ускорение эвакуации наблюдается при гипосекреции желудочного сока, ахилии, ахлоргидрии, приеме гипоосмолярной пищи, а также пищи, богатой углеводами.
Замедление эвакуации отмечается при гиперсекреции желудочного сока, попадании в желудок большого количества пищи, особенно плохо разжеванной, на измельчение которой (до размера менее 1 мм) требуется много времени. Растяжение желудка большим объемом пищи усиливает перистальтические сокращения антрального отдела и проталкивание пищи к привратнику и ДПК, что может сопровождаться болевыми ощущениями. Замедление эвакуации отмечается также при приеме гипертонических растворов и гиперосмолярной, белковой и особенно жирной пищи, способствующей выработке энтерогастрона в слизистой кишечника, который относят к дуоденальному тормозному механизму (тормозит моторику). Резервуарная и эвакуаторная функции страдают при оперативных вмешательствах на органах брюшной полости, желудке, при частичной его резекции, наложении гастроэнтерального анастомоза, рубцовых изменениях желудка вследствие язвенной болезни либо после химических ожогов. Все это препятствует нормальному прохождению пищевого химуса и нарушает функции перемешивания и эвакуации.
При замедлении эвакуации отмечается задержка в желудке пищевых масс, жидкости, газов. Стенка желудка растягивается, истончается, ослабляются его перистальтика и тонус, снижается секреция желудочного сока. При длительной задержке пищевых масс расширенный желудок оказывает давление на диафрагму, ДПК, возникают тошнота, рвота, что ведет к потере жидкости, хлоридов. Как следствие этого, могут возникнуть нарушение кислотнощелочного равновесия в сторону алкалоза, обезвоживание, коллапс и кома.
Печеночные.
Механическая желтуха развивается при нарушениях оттока желчи от печени. Для механической (подпечёночной, застойной, обтурационной) желтухи характерно развитие холемии и ахолии.
Причина: стойкое нарушение выведения жёлчи по жёлчным капиллярам (что приводит к внутрипечёночному холестазу), по жёлчным протокам и из жёлчного пузыря. Два последних вида нарушения выведения желчи вначале приводят к внепечёночному (подпечёночному) холестазу, а при хроническом действии — и к внутрипечёночному. Повышается давление в жёлчных капиллярах, перерастяжение (вплоть до микроразрывов) и повышение проницаемости стенок желчеотводящих путей, диффузию компонентов жёлчи в кровь. При этом развивается билиарный гепатит.
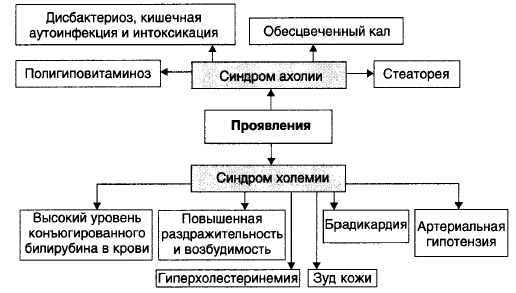
Стадии желтухи.
Первая стадия (преджелтушная):
- Повреждение и снижение активности ферментов, разрушающих уроби-линоген. Проявления: уробилиногенемия и уробилиногенурия.
- Альтерация мембран гепатоцитов, повышение их проницаемости и выход в интерстиций и кровь компонентов цитоплазмы. Проявления: фер-ментемия (в крови повышается активность трансаминаз АЛТ и ACT, a также других ферментов, характерных для печени) и гиперкалиемия (вызвана повреждением большого числа гепатоцитов).
- Снижение активности глюкуронилтрансферазы. Проявления: уменьшение образования прямого билирубина и как следствие — содержания стеркобилиногена в крови, моче и экскрементах.
Вторая стадия (желтушная):
Для желтушной стадии характерно дальнейшее усугубление альтерации гепатоцитов и их ферментов. Это приводит к нарушению работы «би-лирубинового конвейера» (цитоплазматический белок гепатоцитов — лигандин и глюкуронилтрансфераза). Лигандин способствует транспорту жёлчных пигментов из региона гепатоцита, обращенного к кровеносному капилляру, в регион, прилежащий к жёлчному капилляру. Расстройство этого механизма в совокупности с повреждением мембран клеток обусловливает нарушение однонаправленного транспорта билирубина.
Проявления: выход прямого билирубина в кровь и развитие билирубине-мии, фильтрация прямого билирубина почками и его экскреция с мочой, попадание компонентов жёлчи в кровь и развитие холемии.
Третья стадия печёночной желтухи:
- Прогрессирующее снижение активности глюкуронилтрансферазы гепатоцитов. Это приводит к нарушению трансмембранного переноса конъюгированного билирубина в гепатоциты и торможению процесса глюкуронизации билирубина. Проявления: нарастание уровня непрямого билирубина в крови, уменьшение содержания в крови прямого билирубина (как результат подавления реакции глюкуронизации), снижение (в связи с этим) концентрации стеркобилиногена в крови, моче и экскрементах, уменьшение содержания уробилиногена (вплоть до исчезновения) в крови и как следствие — в моче. Последнее является результатом малого поступления прямого билирубина в желчевыводящие пути и кишечник.
- Нарастающее усугубление повреждения структур и ферментов гепатоцитов. Проявления: нарастание холемии, сохранение ферментемии и гиперкалиемии, прогрессирование печёночной недостаточности, чреватой развитием комы.
Паренхиматозная (печеночно-клеточная) желтуха вызывается различными гепатотропными повреждающими факторами (вирусами, бактериями, паразитами, четыреххлористым углеродом, алкоголем, аутоантителами) она характеризуется увеличением в крови содержания прямого и, особенно, непрямого билирубина, уробилиногена, уровня печеночных трансаминаз и уменьшением активности глюкуронилтрансферазы, резким повышением в моче уровня уробилиногена, а также прямого билирубина, увеличением содержания в кале прямого билирубина, стеркобилина и желчных кислот, появлением более темного, чем в норме цвета мочи и кала. Является одним из вариантов печеночной желтухи (Печеночная желтуха возникает в результате изолированного или сочетанного нарушения процесса захвата (из крови), связывания (с глюкуроновой кислотой) и выведения (с желчью прямого и непрямого) билирубина.)
Чаще всего канальцевый ацидоз является следствиемтубулоинтерстициального синдрома – особой формы поражения почек, для которой характерно развитие атрофии эпителия канальцев нефронов, в основном дистальной части их, в сочетании с выраженным склерозом стромы и нарушением основных канальцевых функций в ответ на различные токсические, метаболические, физические (ионизирующая радиация) и инфекционные воздействия.
Нарушение секреции мочевой кислоты сопровождается повышением концентрации в крови мочевой кислоты и ее солей (гиперурикемия) и развитием почечной формы подагры. Соответствующий дефект является наследственно обусловленным и передается по доминантному типу.
Нарушение секреции чужеродных веществ (лекарственных – антибиотики, красящих – фенолрот, йодсодержащих контрастных препаратов). Наблюдается при поражениях почек с выраженным тубулоинтерстициальным синдромом. Задержка в крови в связи с нарушением секреции некоторых чужеродных веществ, в частности пенициллина и продуктов его превращения, может сопровождаться токсическими проявлениями.
Общие закономерности и причины нарушения деятельности эндокринных желез, нарушение центральных и периферических механизмов регуляции, внежелезистые факторы, ведущие к гипо- и гиперфункции желез внутренней секреции.
Эндокринная система- система, состоящая из специализированных структур, расположенных в центральной нервной системе, различных органах и тканях, а также желез внутренней секреции, вырабатывающих специфические биологически активные вещества - гормоны.
Наряду с нервной эндокринная система участвует в регуляции функций различных систем, органов и метаболических процессов, является важнейшим звеном координации функций, обеспечивающих единство организма, сохранение его гомеостаза, его связь и приспособление к внешней среде. Как любая функциональная система, она включает в себя три звена или компонента:
1. афферентный, воспринимающий аппарат, представленный всеми видами экстеро-, проприо- и интерорецепторов функциональных элементов органов и тканей;
2. центральное звено регуляции сосредоточено в симпатических и парасимпатических центрах вегетативного отдела нервной системы, особенно в гипоталамусе.
3. исполнительный (эффекторный) аппарат в виде желез внутренней секреции: гипофиз, щитовидная железа, паращитовидные железы, поджелудочная железа, надпочечники и половые железы.
Общие причины и механизмы патологии эндокринной системы:
1) инфекции и интоксикации;
2) острые и хронические воспаления;
3) наследственные дефекты биосинтеза гормонов;
4) опухоли;
5) травмы;
6) недостаточность кровообращения.
В механизмах нарушения функций эндокринной системы выделяют четыре патогенетических пути:
1) нарушение центральных механизмов регуляции,
2) патология самих желез,
3) нарушение активности гормонов на периферии,
4) нарушение принципа обратной связи между гипофизом и периферической железой, между количеством гормонов и выработкой тропных гормонов - + взаимодействие по Завадовскому.
1. Этиология и патогенез нарушений центральных механизмов регуляции эндокринных желез. Это связано прежде всего с состоянием гипоталамуса (hypothalamus). Его поражение может быть
1) первичным: воспаление, опухоли, кровоизлияния и
2) вторичным в результате патологического влияния на гипоталамус ретикулярной формации и вышележащих отделов центральной нервной системы (лимбической системы, коры головного мозга).
2. Патология самих желез. Причины и патогенез:
1) инфекция (панкреатит),
2) травма,
3) опухоли: а) инсулома, б) аденома гипофиза,
4) недостаток кровообращения (гипоксия → диабет).
3. Этиология и патогенез периферических внежелезистых механизмов - это нарушение активности гормонов уже выделенных и циркулирующих в крови:
1) слишком прочная связь гормона с белком носителем плазмы крови (например, липопротерический диабет), или слишком рыхлая (тиреотоксикоз),
2) нарушение инактивации гормонов в тканях, особенно в печени. При гепатитах и циррозах усиление активации инсулиназы при гипоксии в печени и образование внепанкреатической инсулиновой недостаточности,
3) аутоагрессия к молекуле гормона в результате образования антител, блокирующих белковые и полипептидные молекулы гормонов в крови,
4) нарушение соединения гормона со своими рецепторами: а) в клетках-мишенях или б) с рецепторами соответствующих ферментов и нарушение механизмов аллостерического эффекта (например, глюкокортикоиды находятся на гексокиназе вместо инсулина).
В результате этих внежелезистых механизмов гормона в крови достаточно, или его содержание в крови даже повышено, но действия своего он не проявляет.
4. Этиология и патогенез нарушения принципа обратной связи. Большое значение в механизмах нарушения эндокринных желез имеет нарушение принципа обратной связи или закона + - взаимодействия по Завадовскому между гипофизом и периферическими железами. Об этом механизме особенно важно помнить при введении в организм гормонов с лечебной целью, которые вызывают:
1) угнетение эндогенной выработки гормонов, что ведет
2) к гипофункции соответствующих желез, а при длительном введении гормонов даже к
3) атрофии. Это особенно опасно в отношении коры надпочечников. Например, при длительном лечении ревматизма по ???? наступает атрофия надпочечников и после отмены гормонов развивается синдром отмены - острая надпочечниковая недостаточность, что ведет к резкому снижению сопротивляемости организма. В итоге любое стрессовое состояние, бытовая или операционная травма, может закончиться смертью в результате острой кортикостероидной недостаточности.
Основные этапы развития патофизиологии (Гиппократ, Гален, Демокрит, Вирхов, Селье). Гуморальная и солидарная теория патологии, ятрофизическое и ятрохимическое направления в медицине.
Основоположник медицины Гиппократ (5 в. до н.э.) полагал, что организм человека построен из 4 родов жидкости: крови, слизи, желтой и черной желчи, и правильное их смешение (кразис) обеспечивает здоровье. Болезни возникают в результате внешних воздействий, вызывающих неправильное смешение или загрязнение этих жидкостей (дискразия).
Наряду с гуморальной существовала и солидарная (солидус - твердый) теория патологии, основанная на учении Демокрита (5 в. до н.э.). Согласно ей сущность болезни заключается в изменении плотности тела, расположения твердых составных частей ткани вследствие хаотического движения атомов. Эти взгляды уже содержали элементы материалистического объяснения сущности болезни и пользовались признанием в течение многих столетий.
К. Гален (около 130-200) видел причину болезней в порче соков подобно Гиппократу, однако здоровье и болезнь объяснял с виталистических позиций. Его учение использовалось врачами на протяжении почти полутора тысячелетий и было оставлено лишь в связи с дальнейшим развитием науки.
На протяжении средних веков господствовали виталистические (vita - дух) взгляды на сущность болезни. В противовес религиозным взглядам Авиценна (Ибн- Сина) пытался материалистически обосновать представления о различных болезнях.
Начало развития науки относится к эпохе разложения феодализма и зачатков возникновения капитализма (эпоха Возрождения - 16-17 в.в.). В этот период сформировались два основных направления в медицине - иатрохимическое и иатрофизическое (иатрос - врач). Иатромеханики (-физики) объясняли сущность болезни с помощью законов физики (статики и гидравлики). Они являлись представителями механистического взгляда на сущность болезни (Гарвей, Мальпиги). Иатрохимики сущность приписывали изменению химического состава соков организма, преимущественно пищеварительных и крови (Парацельс). Основным недостатком этих учений был идеализм.
Развитие новых взглядов в патологии появилось в 18 в. после трех великих открытий (закон сохранения энергии, клеточная теория строения организмов, теория эволюционного развития органического мира). Выдающийся немецкий патолог Р.Вирхов (1821-1902) создал целлюлярную (клеточную) теорию патологии, согласно которой всякий патологический процесс представляет собой сумму клеточных изменений. Несмотря на то, что она явилась первой научной теорией, объясняющей сущность болезни, у нее есть и недостатки:
1. Витализм, выражающийся в персонификации клеток (придании им особых свойств).
2. Метафизичность. Повреждения рассматривались изолированно.
3 Механицизм, рассматривали органы как клеточное государство, а болезнь - как поражение отдельных клеток.
4. Антиэволюционность, т. е. он отрицательно относился к теории Дарвина
Теория Вирхова была односторонней и не принимала во внимание сложные процессы взаимодействия в организме при участии нервной и эндокринной систем.
3. Основные этапы развития отечественной патофизиологии, ее особенности, принципы (эволюционный – И.И. Мечникова, нервизма – И.И. Сеченова, С.П. Боткина, И.П. Павлова). Методы патофизиологии, экспериментальное моделирование болезней.
Огромный вклад в патологическую физиологию был сделан Ильей Ильичом Мечниковым (1845-1916). Им разработан сравнительно-эволюционный метод исследования, он занимался вопросами иммунологии, микробиологии, геронтологии (основал этот раздел науки и дал ему название), философии, демографии. Он открыл явление фагоцитоза, сформулировал эволюционно-приспособительную теорию воспалительной реакции, заложил основы клеточной теории иммунитета (за работы в этой области в 1909 г. И.И. Мечников был совместно с Паулем Эрлихом удостоен Нобелевской премии), открыл новый класс антител - цитотоксины, т. е. антитела к чужеродным клеткам, создав тем самым основу теории аутоиммунных процессов.
Созданием материалистических основ физиологии и патофизиологии медицинская наука обязана И.М.Сеченову, С.П.Боткину, И.П.Павлову.
И.М.Сеченов впервые высказал положение о рефлекторной природе психических процессов. Своими исследованиями ЦНС он обосновал необходимость изучения организма как целого в его реакциях на воздействия внешней среды.
С.П.Боткин признавал важное значение нервной системы в патогенезе заболеваний и необходимости индивидуального подхода в лечении больного.
Особенно яркое обоснование этих идей было сделано в учении И.П. Павлова о ВНД. Он рассматривал реакции организма как целого, в его неразрывном единстве с внешней средой.
Для изучения патологических процессов применяются следующие экспериментальные методы.
Методика выключения состоит в удалении того или иного органа хирургическим или каким-либо другим воздействием (тепло, холод, радиация, фармакологические средства и др.).
Методика раздражения служит для того, чтобы вызывать изменение функции того или иного органа.
Введение в организм различных веществ (гормонов, ферментов и их ингибиторов, антигенов и т.д.) широко применяется в патофизиологии.
Методика изолированных органов и тканевых культур - дает важную информацию о сущности патологических процессов.
Важную роль играет сравнительно-эволюционный метод. Например, воспаление, лихорадка возникали и усложнялись в эволюции в связи с усложнением и совершенствованием защитных и приспособительных реакций организма на изменяющиеся условия существования.
Кроме эксперимента на животных, применяется моделирование патологии - физическое (на животных и человеке с использованием искусственных физических систем (искусственных сердца, почки, крови и др.)), и, формализованное (компьютерное, математическое, логическое).
Общее учение о болезни (В.В. Пашутин, А.Д. Адо, Н.Н. Зайко и др.). Понятие «здоровье» и понятие «болезнь». Периоды и исходы болезней. Ятрогенные заболевания и деонтологические аспекты патофизиологии и медицины.
Крупнейшим отечественным патофизиологом является ученик И.М. Сеченова профессор Виктор Васильевич Пашутин (1845-1901), который в 1874 г. в Казани возглавил кафедру общей патологии Казанского университета. В дальнейшем он руководил кафедрой общей и экспериментальной патологии Военно-медицинской академии в Санкт-Петербурге. В.В. Пашутин первым внедрил в медицину термин «патологическая физиология» и фактически основал ее как науку. В.В. Пашутин считал патологическую физиологию «философией медицины». Он доказал авитаминозную природу цинги, создал учение о кислородном голодании тканей (гипоксии), занимался изучением пищеварения, функций эндокринных желез.
Г.П. Сахаров (1873-1953) возглавлял кафедру общей патологии (а затем - патологической физиологии) медицинского факультета Московского университета с 1914 по 1929 гг. Г.П. Сахаров открыл явление сывороточной анафилаксии, описал изменения в тканях при местном аллергическом воспалении (феномен Артюса- Сахарова).
Н.Н. Зайко разрабатывал теорию патогенеза трофических расстройств при повреждении чувствительного нерва и исследовал механизмы нейрогенных дистрофий.
Академик РАМН Андрей Дмитриевич Адо и его школа создали новое направление в изучении аллергических процессов. Он заложил основы аллергологии, как самостоятельной науки, создал первую в стране аллергологическую лабораторию.
Академик РАМН В.А. Неговский считается основоположником реаниматологии. Он разработал патофизиологические основы реанимации организма, находящегося в состоянии клинической смерти, создал учение о постреанимационной болезни. В.А. Неговский основал сначала лабораторию, а затем Институт общей реаниматологии АМН СССР.
Крупные работы в области патологии нервной деятельности, а также в проблеме формирования и функционирования патологических систем принадлежат академику РАМН Г.Н. Крыжановскому, им было создано Международное общество патофизиологов. Таковы основные этапы развития отечественной патофизиологической науки.
В Уставе Всемирной организации здравоохранения записано: «Здоровье - это состояние полного физического, морального и социального благополучия, а не только отсутствие болезней или физических дефектов».
Болезнь - нарушение жизнедеятельности организма, вызванное действием чрезвычайных раздражителей, характеризуются снижением работоспособности, приспособляемости организма к условиям окружающей cреды и одновременным развитием не только патологических, но и компенсаторно-приспособительских реакций, направленных на восстановление нарушенных функций и структур, лежащих в основе выздоровления.
Периоды болезни
1. Скрытый, латентный (инкубационный при инф.) от момента действия раздражителя до появления первых самых незначительных симптомов. Процессы при инкубацион. периоде: попадание микроба, его размножение, выделение токсина.
Скрытый период - время скрытого молчаливого формирования многозвеньевых рефлект. реакций, новых динамических организаций из осколков разрушенных под действием раздражителя физиологических систем. Это время на организацию патологических систем.
2. Продромальный период - от появления неясных симптомов до яркой картины заболевания. Недомогание, повышение температуры. Иногда есть специфич. симптомы: пятна Филатова-Комликова при кори.
3. Период выраженной клинически болезни. При некоторых заболеваниях делится на фазы. При инфекционных заболеваниях - конкретные сроки длительности.
Могут быть стертые формы; абортивные формы - есть вся симптоматика, но менее выражена, быстро проходит.
По течению:
а) острые заболевания (2 дня - 2-3 недели)
б) хронические
в) могут быть острыми и хроническими (нефрит, пиелонефрит, лейкоз ...)
Главное - течение заболевания, а не конкретная длительность заболевания.
Острое - быстро нарастающее течение.
Хроническое - периоды обострения сменяются периодами ремиссии.
Нередко возникают осложнения - могут быть тяжелые, чем само заболевание.
Могут быть типичными (пневмония после кори).
4. Исход:
1. Полное выздоровление - после большинства травм.
2. Неполное выздоровление - есть остаточные явления (после скарлатины длительные изменения в почках).
3. Переход в патологическое состояние (после перенесенного эндокардита - порок сердца).
4. Смерть - при недостаточности компенсаторных восстановительных механизмов.
Дата: 2019-03-05, просмотров: 977.