Решение:
Для 0,2 М, n(NaOH)=20/40=0,5 моль,
0,2 моль 1 л
0,5 моль х л
Х=0,5/0,2=2,5 л
Для 0,5 н
0,5 моль 1 л
0,5 моль х л
Х=0,5/0,5=1 л
Ответ: 2,5 л, 1 л.
106. Вычислить температуру замерзания водного 30%-ного раствора C2H5OH. Криоскопическая постоянная воды 1,86 град.
Решение:
Следствие из закона Рауля: температура замерзания раствора ниже температуры замерзания чистого растворителя:
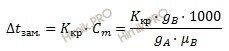
Где:
Dt зам. – понижение температуры замерзания раствора (температура кристаллизации);
Ккр. – криоскопическая постоянная;
Cm– моляльная концентрация;
gB – масса растворенного вещества;
gA – масса растворителя;
µB – молярная масса растворенного вещества.
Температура замерзания раствора. Пусть масса раствора равна 100 грамм, следовательно, масса растворённого вещества равна 30 грамм, а масса растворителя 100 – 30 = 70 грамм.
Учитывая, что молярная масса этилового спирта (C2H5OH) равна 46 г/моль, получаем:
Dt зам. = 1,86 ⋅ 1000 ⋅ 30 / 46 ⋅ 70 = 17,3 (0С).
Вода кристаллизуется при температуре 0 0С, следовательно, температура замерзания раствора:
tзам = -17,3 0С.
Ответ: tзам = -17,3 0С.
113. Вычислить степень диссоциации и концентрацию ионов H+ в 0,1%-ном растворе CH3COOH (плотность 1г/см3), если константа дисоциации К=1,85 × 10-5.
Решение:
Найдем молярную концентрацию раствора:
CM=m/Mr∙V= 0,1/64∙0,1=0,016 моль/л
α=(K/CM)1/2=(1,85∙10-5/0,016)1/2=3,4∙10-2
[H+]=αCM=3,4∙10-2∙0,016=5,4∙10-4
Ответ: 3,4∙10-2, 5,4∙10-4
122. Вычислить растворимость сульфата бария в 0,1 М растворе сульфата натрия, если ПРBaSO4 = 10-10.
Решение:
ПР(BaSO4) = [Ва2+] [SO4 2- ] = 1,1•10-10
[Ва2+]= [SO4 2- ]=S
S=(1,1•10-10)1/2=1,05∙10-5 моль/л
Ответ: 1,05∙10-5 моль/л
131.Составьте молекулярные и ионные уравнения реакции гидролиза и определите реакцию среды раствора:
NH4NO3 , Al(CH3COO)3*, Na2SO4
Решение:
Уравнение диссоциации нитрата аммония:
NH4NO3 = NH4 + +NO3 -
Нитрат аммония - соль слабого основания (гидроксида аммония NH4OH) и сильной кислоты (азотной - HNO3). Поэтому гидролиз протекает по катиону, реакция раствора – кислая.
Полное ионно-молекулярное уравнение:
NH4 + +NO3 - +H2O = NH4OH + H+ + NO3 -
Сокращенное ионно-молекулярное уравнение:
NH4 + +H2O = NH4OH + H+
Молекулярное уравнение:
NH4NO3 + H2O = NH4OH + HNO3
Ацетат алюминия
Определяем тип гидролиза.
Al(CH3COO)3 = Al3+ + 3CH3COO–
Соль слабого основания и слабой кислоты – совместный гидролиз.
2. Ионные уравнения гидролиза, среда.
Al3+ + H2O = AlOH2+ + H+;
CH3COO– + H2O =CH3COOH + OH–
Учитывая, что гидроксид алюминия очень слабое основание, предположим, что гидролиз по катиону будет протекать в большей степени, чем по аниону, следовательно, в растворе будет избыток ионов водорода и среда будет кислая.
3. Молекулярное уравнение.
Al(CH3COO)3 + H2O = AlOH(CH3COO)2 + CH3COOH
Среда нейтральная, необратимый гидролиз
Сульфат натрия
Раствор сульфата натрия Na2SO4 – нейтрален, эта соль образована сильным основанием – едким натром NaOH и сильной серной кислотой H2SO4. Лакмус не меняет цвет.
Na2SO4+H2O=2NaOH+H2SO4
2Na++SO4 2-+H2O=2Na++2OH-+2H++SO42-
148. Определите методом электронного баланса коэффициенты в уравнениях окислительно-восстановительных реакций:
K2Cr2O7 + FeSO4 + H2SO4 = Cr2 (SO4)3 + Fe2(SO4)3 + K2SO4 + H2O
KMnO4 + H2S + H2SO4 = MnSO4 + S + K2SO4 + H2O
Решение:
K2Cr2O7 + FeSO4 + H2SO4 = Cr2 (SO4)3 + Fe2(SO4)3 + K2SO4 + H2O
Схемы электронного баланса выглядят следующим образом:
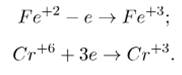
Окисление – это отдача электронов веществом, т.е. повышение степени окисление элемента. Вещества, отдающие свои электроны в процессе реакции, называются восстановителями (в данном случае это сульфат железа (II)).
Восстановление – это смещение электронов к веществу или понижение степени окисления элемента. Вещества, принимающее электроны, называется окислителем (в данном случае это дихромат калия).
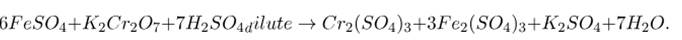
KMnO4 + H2S + H2SO4 = MnSO4 + S + K2SO4 + H2O
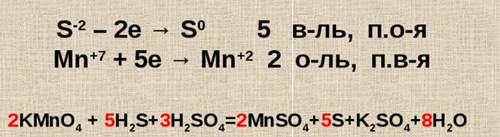
Дата: 2019-02-25, просмотров: 614.