Вариант 18
Контрольная работа № 1
18. Некоторый элемент проявляет в оксиде степень окисления +4. Массовая доля этого элемента в оксиде составляет 71,17 %. Какой это элемент?
1.Действительно,если элемент имеет степень окисления +4,то формула оксида будет EO2.
Если вспомнить формулу по определению массовой доли элемента, то получим такое уравнение: 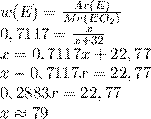
Элемент с относительной атомной массой 79 действительно Селен
Сколько литров ацетилена при 300 К и 202 кПа образуется при взаимодействии 230 г карбида кальция с водой?
Решение:
СaC2+2H2O=Ca(OH)2+C2H2
n(C2H2)=n(CaC2)=230/(40+12·2)=3,5 моля
По уравнению Менделеева-Клапейрона получаем:
V=nRT/P
n(C2H2)=3,5 моль ·8.31·300K/202 кПа = 43,2 л
Ответ: 43,2 л
На восстановление 1,8 г оксида металла израсходованного 0,838 л водорода, измеренного при н.у. Вычислите эквивалентную массу металла.
Решение:
833 мл / 22,4 л = 37,1875 ммоль водорода H2
В пересчёте на атомарный водород:
37,1875 ммоль х 2 = 74,375 ммоль H
Тогда:
74,375 ммоль H - 1,8 г оксида
1 моль H - Х г оксида
Х = 1,8 / 74,375 х 1000 = 24,2 г/моль
Ответ: молекулярная масса эквивалента оксида металла = 24,2 г/моль.
В чем сущность принципа Паули ? Какое максимальное число электронов на
S- , p- , d- и f- подуровнях ?
Определите, к какому типу (s- , p- , d- и f-) относятся эти элементы и их положение в Периодической системе (период, подгруппа)* 23 и 52.
Решение:
Принцип Паули формулируется так:
В атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковы.
Хотя бы одно из квантовых чисел n, l, ml и ms, должно обязательно различаться проекцией спина. Поэтому в атоме могут быть лишь два электрона с одинаковыми n, l и ml: один с ms = +1/2 другой c ms = -1/2 . Напротив, если проекции спина двух электронов одинаковы, должно отличаться одно из квантовых чисел n, l или ml.
Зная принцип Паули, посмотрим, сколько же электронов в атоме может находиться на определенной «орбите» с главным квантовым числом n. Первой «орбите» соответствует n = 1. Тогда l = 0, ml=0 и ms может иметь произвольные значения: +1/2 или -1/2 . Мы видим, что если n = 1, таких электронов может быть только два.
Соответственно для s- подуровня 2
По аналогии для p- 6
для d 10
для f 14
23V ванадий 1s 22s 22p 63s 23p64s 23d3
элемент побочной подгруппы пятой группы, четвёртого периода периодической системы химических элементов Д. И. Менделеев
Относиться к d-элементам
52Te теллур 1s 22s 22p 63s 23p64s 23d104p65s24d105p4
химический элемент VI группы периодической системы главной подгруппы
Относиться к p=элементам.
Что такое ковалентность элементов? Напишите электронные формулы кислорода и серы, распределите электроны по энергетическим ячейкам в нормальном и возбужденном состояниях, определите возможные ковалентности этих элементов.
Ковалентность - мера способности атома к образованию ковалентных химических связей, возникающих за счёт двух электронов (по одному от каждого атома) и имеющих малополярный характер
Валентные электроны атомов кислорода имеют следующие электронно-графические формулы:
8O кислород 1s 22s 22p 4
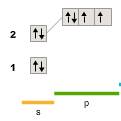
O2-
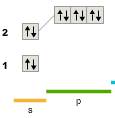
Возможная валентность равна 2
16S сера 1s 22s 22p 63s 23p4
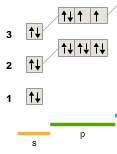
Возможные валентность II, IV, VI
А )
K: Sn 2+ +2e- = Sn
А: SO4 2- — 2e- = SO2+О2
SnSO4 =Sn + SO2 +O2
б ) SnSO4 и MgCl2
K: Sn 2+ +2e- = Sn
А: 2Cl- — 2e- = Cl2
SnSO4 + MgCl2+H2O→Sn+Cl2 +MgSO4
Q=It =zF m/Mr= 2·96500·1000 /119 =1,6·106Кл
Ответ: 1,6·106Кл
177. Составьте уравнения электродных реакций, протекающих при коррозии с кислородной и водородной деполяризацией Fe и Zn. Приведите уравнение реакции образования вторичных продуктов коррозии.
Решение: Железо будет анодом (E°= –0,44В), а цинк – катодом (E°=-0,763 В).
Коррозия – это самопроизвольно протекающий процесс разрушения металлов в результате химического или электрохимического взаимодействия их с окружающей средой.
При электрохимической коррозии на поверхности металла одновременно протекают два процесса:
1) анодный – окисление металла: 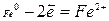 .
.
2) катодный – восстановление ионов водорода: 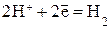 ,
,
или молекул кислорода, растворенного в воде: 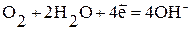 .
.
Ионы или молекулы, которые восстанавливаются на катоде, называются деполяризаторами. При атмосферной коррозии – коррозии во влажном воздухе при комнатной температуре – деполяризатором является кислород.
Суммарное уравнение для водородной коррозии:
Fe+2H+=H2+Fe2+
Для кислородной уравнения:
Fe+О2+H2O=Fe(OH)2
Контрольная работа № 2
Вариант 18
Контрольная работа № 1
18. Некоторый элемент проявляет в оксиде степень окисления +4. Массовая доля этого элемента в оксиде составляет 71,17 %. Какой это элемент?
1.Действительно,если элемент имеет степень окисления +4,то формула оксида будет EO2.
Если вспомнить формулу по определению массовой доли элемента, то получим такое уравнение: 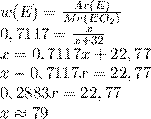
Элемент с относительной атомной массой 79 действительно Селен
Сколько литров ацетилена при 300 К и 202 кПа образуется при взаимодействии 230 г карбида кальция с водой?
Решение:
СaC2+2H2O=Ca(OH)2+C2H2
n(C2H2)=n(CaC2)=230/(40+12·2)=3,5 моля
По уравнению Менделеева-Клапейрона получаем:
V=nRT/P
n(C2H2)=3,5 моль ·8.31·300K/202 кПа = 43,2 л
Ответ: 43,2 л
Дата: 2019-02-25, просмотров: 517.