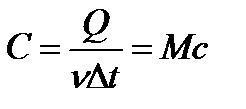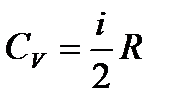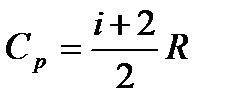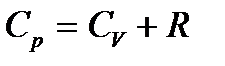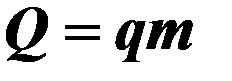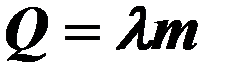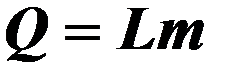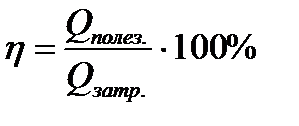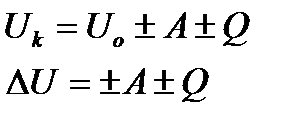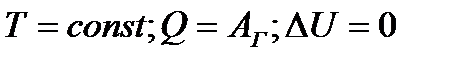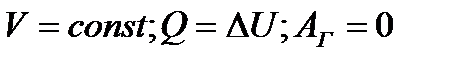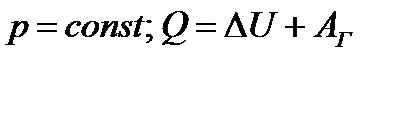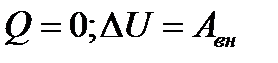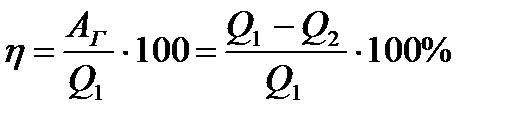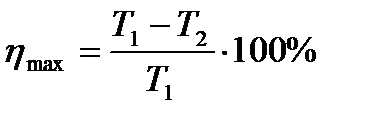Молекулярная физика
| 1. | | Относительная молекулярная ( атомная ) масса. |
| mo – масса 1 молекулы вещества, moс – масса атома углерода 12С. | ||
| 2. |
| Молярная масса. |
| mo – масса 1 молекулы (атома) вещества, Na – постоянная Авогадро, Na = 6∙1023 моль-1. | ||
| 3. |
| Связь молярной с относительно молекулярной массой. |
| Мr –относительно молекулярная масса. | ||
| 4. |
| Масса любого вещества. |
| mo – масса 1 молекулы вещества, Na – постоянная Авогадро, Na = 6∙1023 моль-1, М – молекулярная масса, ν – количество вещества (моль), N – количество молекул. | ||
| 5. |
| Количество вещества. |
| m – масса вещества, Na – постоянная Авогадро, Na = 6∙1023 моль-1, М – молекулярная масса, ν – количество вещества, N – количество молекул. | ||
| 6. | | Уравнение Клаузиуса. Основное уравнение МКТ. |
| Р – давление, mo – масса 1 молекулы вещества, n – концентрация, ͞ν2 – квадрат средней квадратичной скорости. | ||
| 7. | | Связь давления со средней кинетической энергией. Основное уравнение МКТ. |
| n – концентрация, Е- средняя кинетическая энергия поступательного движения. | ||
| 8. |
| Абсолютная температура ( термодинамическая температура или температура по шкале Кельвина ) |
| Т – абсолютная температура (К), t – температура по Цельсию. | ||
| 9. | | Температура-мера средней кинетической энергии. Формула Больцмана. |
| Е- средняя кинетическая энергия поступательного движения, R – универсальная газовая постоянная, R = 8,31 Дж/моль∙К, Т – термодинамическая температура. | ||
| 10. |
| Давление через концентрацию и температуру. |
| Р – давление, n – концентрация, R – универсальная газовая постоянная, R = 8,31 Дж/моль∙К, Т – абсолютная температура. | ||
| 11. |
| Средняя квадратичная скорость. |
| R – универсальная газовая постоянная, R = 8,31 Дж/моль∙К, Т – термодинамическая температура, mo – масса 1 молекулы вещества, М – молекулярная масса, к – постоянная Больцмана, к = 1,38∙1023 Дж/К. | ||
| 12. |
| Закон Дальтона (давление смеси газов). |
| Р1 – парциальное давление первого газа (Па), Р2 – парциальное давление второго газа (Па). | ||
| 13. |
| Уравнение состояния идеального газа. (Уравнение Менделеева – Клапейрона ) |
| Р – давление, V – объём газа, m – масса газа, М – молекулярная масса, R – универсальная газовая постоянная, R = 8,31 Дж/моль∙К, Т – термодинамическая температура(К).. | ||
| 14. | | Уравнение Клапейрона, (объединенный газовый закон). |
| Р – давление (Па), V – объём газа (м3), Т – термодинамическая температура | ||
| 15. |
| Изотермический процесс. |
| Р – давление, V – объём газа. | ||
| 16. |
| Изобарный процесс. |
| V – объём газа, Т – термодинамическая температура. | ||
| 17. |
| Изохорный процесс. |
| Р – давление, Т – термодинамическая температура. | ||
| 18. |
| Абсолютная влажность воздуха. |
| ρ- абсолютная влажность (г/м3), V – объём газа, m – масса водяного пара. | ||
| 19. |
| Относительная влажность воздуха. |
| Р – парциальное давление водяного пара при данной температуре, Рн.п. – давление насыщенного пара при той же температуре, n – концентрация водяного пара, nн.п. – концентрация насыщенного пара, ρ- абсолютная влажность, ρн.п. – плотность насыщенного пара. |
Термодинамика
| 1 |
| Внутренняя энергия идеального газа. |
| i- число степеней свободы, m – масса газа, R – универсальная газовая постоянная, R = 8,31 Дж/моль∙К ,Т – термодинамическая температура, М- молярная масса. | ||
| 2 | | Работа газа. |
| р- давление газа, ∆V – изменение объёма газа. | ||
| 3 |
| Работа внешних сил. |
| р- давление газа, ∆V – изменение объёма газа. | ||
| 4 |
| Уравнение теплового баланса. |
| ∑ - сумма, Qотд – количество теплоты отданное, Qпол – количество теплоты полученное. | ||
| 5 |
| Количество теплоты при изменении температуры тела. |
| с– удельная теплоемкость (Дж/кг∙К), m – масса тела, t – температура тела, ∆t – изменение температуры. | ||
| 6 | CТ = | Теплоемкость тела. |
| Ст – теплоемкость тела (Дж/К), Q – количество теплоты, ∆t – изменение температуры, с – удельная теплоемкость вещества (Дж/кг∙К), m – масса тела. | ||
| 7 |
| Молярная теплоемкость. |
| С- молярная теплоемкость, Q – количество теплоты, ∆t – изменение температуры, с – удельная теплоемкость, М- молярная масса, ν – количество вещества. | ||
| 8 |
| Молярная теплоёмкость газа при постоянном объёме. |
| i- число степеней свободы, Сv - молярная теплоёмкость газа при постоянном объёме R – универсальная газовая постоянная, R = 8,31 Дж/моль∙К. | ||
| 9 |
| Молярная теплоёмкость газа при постоянном давлении. |
| i- число степеней свободы, Ср - молярная теплоёмкость газа при постоянном давлении, i- число степеней свободы, R – универсальная газовая постоянная, R = 8,31 Дж/моль∙К. | ||
| 10 |
| Уравнение Майера. |
| Ср - молярная теплоёмкость газа при постоянном давлени, Сv - молярная теплоёмкость газа при постоянном объёме, R – универсальная газовая постоянная, R = 8,31 Дж/моль∙К. | ||
| 11 |
| Количество теплоты выделяемом при полном сгорании топлива. |
| q- удельная теплота сгорания топлива, m – масса топлива. | ||
| 12 |
| Количество теплоты необходимое для плавления тела. |
| λ – удельная теплота плавления, m – масса тела. | ||
| 13 |
| Количество теплоты необходимое для парообразования вещества при температуре кипения. |
| L – удельная теплота парообразования, m – масса тела. | ||
| 14 | | КПД теплового процесса. |
| Qполез – полезно использованное количество теплоты, поглощаемого одними телами термодинамической системы, Qзатр – затраченное количество теплоты, выделенное другими телами этой системы. | ||
| 15 | | Первый закон термодинамики. |
| Uk – внутренняя энергия термодинамической системы в конечном состоянии (Дж), Uo – внутренняя энергия в начальном состоянии (Дж), ∆U – изменение внутренней энергии, Q – количество теплоты («+» берем, если система принимает количество теплоты, «-», если отдает), А –работа (если работа совершается над системой, то значение Авн.сил принимают положительным, если же работу совершает сама система, то значение Агаза принимают отрицательным). | ||
| 16 | | Применение первого закона термодинамики к изотермическому процессу. |
| ∆U – изменение внутренней энергии, Q – количество теплоты, Аг -работа газа. | ||
| 17 | | Применение первого закона термодинамики к изохорному процессу. |
| ∆U – изменение внутренней энергии, Q – количество теплоты, Аг –работа газа, | ||
| 18 | | Применение первого закона термодинамики к изобарному процессу. |
| ∆U – изменение внутренней энергии, Q – количество теплоты, Аг –работа газа, | ||
| 19 | | Применение первого закона термодинамики к адиабатному процессу. |
| ∆U – изменение внутренней энергии, Q – количество теплоты, Авн –работа внешних сил. | ||
| 20 | | КПД теплового двигателя. |
| Аг – работа газа, Q1 – количество теплоты, полученное от нагревателя, Q2 – количество теплоты, отданное холодильнику. | ||
| 21 | | КПД идеальной тепловой машины. Формула Карно. |
| Т1 – температура нагревателя (К), Т2 – температура холодильника |
Электростатика
1.
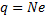
2.
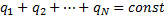
3.
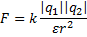
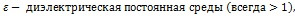 r - расстояние между зарядами
r - расстояние между зарядами 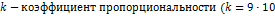 9
9 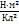 ;
; 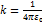 ),
q 1 , q 2 - электрические заряды (Кл),
),
q 1 , q 2 - электрические заряды (Кл), 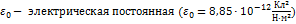
4.
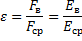
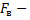 сила взаимодействия точечных зарядов в вакууме (Н),
сила взаимодействия точечных зарядов в вакууме (Н), 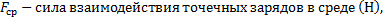
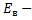 напряженность в вакууме (В/м); Еср - напряженность в среде (В/м).
напряженность в вакууме (В/м); Еср - напряженность в среде (В/м).
5.

 - N –число сил
- N –число сил
6.
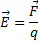
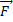 - сила, с которой поле действует на заряд (Н), q – электрический заряд (Кл),
- сила, с которой поле действует на заряд (Н), q – электрический заряд (Кл), 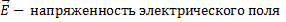 (В/м).
(В/м).
7.
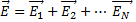
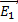 - напряженность
- напряженность 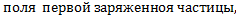
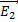 - напряженность
- напряженность 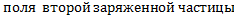
8.
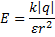
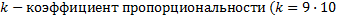 9
9 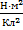 ;
; 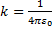 ), q – электрический заряд (Кл),
), q – электрический заряд (Кл), 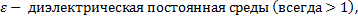 r – расстояние от данной точки до этого заряда (м)
r – расстояние от данной точки до этого заряда (м)
9.
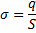
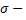 поверхностная плотность заряда (Кл/м2)
поверхностная плотность заряда (Кл/м2)
10.
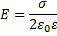
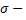 поверхностная плотность заряда (Кл/м2),
поверхностная плотность заряда (Кл/м2), 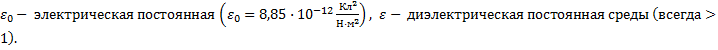
11.
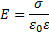
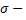 поверхностная плотность заряда (Кл/м2),
поверхностная плотность заряда (Кл/м2), 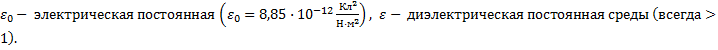
12.
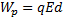
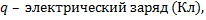
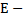 напряженность поля (В/м); d – расстояние (м)
напряженность поля (В/м); d – расстояние (м)
13.
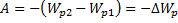
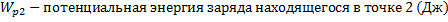
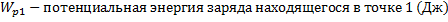
14.
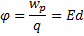
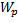 -
- 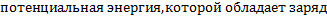
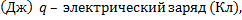
15.
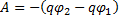
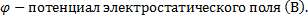
16.
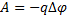
17.
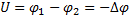
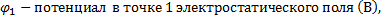 φ2 - потенциал в точке 2 электростатического поля (В) Δφ – изменение потенциала (В)
φ2 - потенциал в точке 2 электростатического поля (В) Δφ – изменение потенциала (В)
18.
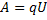
19.
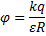
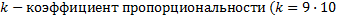 9
9 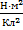 ;
; 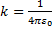 ), q – электрический заряд (Кл),
), q – электрический заряд (Кл), 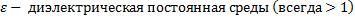
20.
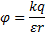
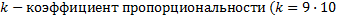 9
9 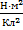 ;
; 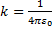 ), q – электрический заряд (Кл),
), q – электрический заряд (Кл),  .
.
21.
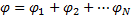
22.
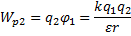
23.
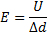
24.
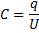
25.
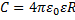
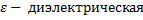 постоянная среды,
постоянная среды, 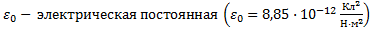 , R – радиус шара (м)
, R – радиус шара (м)
26.
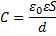
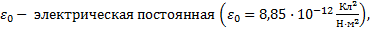
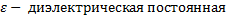 среды, S – площадь каждой пластины, d – расстояние между пластинами
среды, S – площадь каждой пластины, d – расстояние между пластинами
27.

28.
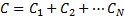
29.
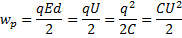
Закон ы постоянного тока
1.
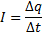
Напряжение
А – работа поля (Дж), q – электрический заряд (Кл)
5.
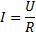
Закон Ома для участка цепи
U - напряжение (В), I – сила тока (А), R – сопротивление (Ом)
6.
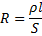
Работа электрического тока
А - работа электрического тока (Дж), I – сила тока (А), U – напряжение (В), R – сопротивление (Ом), t – время (с)
12.
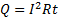
Закон Джоуля - Ленца
I – сила тока (А), R – сопротивление (Ом), t - время (с), Q – количество теплоты
13.
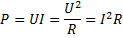
Электродвижущая сила (ЭДС)
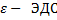 (В), q – электрический заряд (Кл) Аст – работа сторонних сил (Дж)
(В), q – электрический заряд (Кл) Аст – работа сторонних сил (Дж)
15.
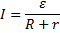
Закон Ома для полной цепи
R – внешнее сопротивление цепи (Ом), r – внутреннее сопротивление источника тока (Ом), 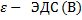
16.
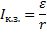
Сила тока короткого замыкания
r – внутреннее сопротивление источника тока (Ом), 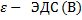 , Iк.з. ток короткого замыкания (А)
, Iк.з. ток короткого замыкания (А)
17.
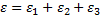
Полное ЭДС цепи
ε1 - ЭДС первого источника тока( В), ε2 – ЭДС второго источника тока( В), ε3 – ЭДС третьего источника тока( В),
18.
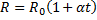
Магнитное поле
1
М=ВIS sinα
Магнитная индукция
В – модуль магнитной индукции (Тл)
3
μ = 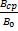
Сила Ампера
B – модуль вектора магнитной индукции (Тл), I – сила тока в проводнике (А), ∆L – длина участка проводника (м) , α – угол между магнитной индукцией и направлением тока в проводнике
6
F = μ0 μ I1 I2 L / 2πR
Сила Лоренца
q – заряд (Кл), B – модуль вектора магнитной индукции (Тл), υ – скорость заряженной частицы (м/с), α – угол между направлением вектора скорости заряда и вектором индукции магнитного поля.
8
R = mυ / qB
Электромагнитная индукция
1
Iинд = εi / R
Сила индукционного тока
ε - ЭДС индукции (B), R - сопротивление замкнутого проводящего контура (Oм)
2
q = εi t / R
Магнитный поток
B - модуль вектора магнитной индукции (Тл), S - площадь витка контура ( м2), α - угол между вектором магнитной индукции и нормалью к поверхности
6
εsi = - L∆I / ∆t
ЭДС самоиндукции
L - индуктивность катушки (Гн), ∆I /∆t- скорость изменения тока в катушке
( А/с)
7
L = / I
Индуктивность катушки (коэффициент пропорциональности, зависящий от формы, размеров проводника и магнитных свойств среды)
Ф – магнитный поток (Вб), I - сила тока в проводнике (А)
8
W = L I2 / 2
Период колебаний
T – период колебаний (с), ν – частота колебаний (Гц), n – число колебаний , t – время n колебаний (с)
2
Т = 2π /ω , где ω = 2πν
Скорость колеблющейся точки
Хмах – амплитуда колебаний ( м), φ – начальная фаза колебаний
4
а = υ´ = х´´ = - Хмахω2 со (ωt +φ)
Формула Томсона
Т – период собственных колебаний (с), L - индуктивность катушки (Гн), C -электроемкость конденсатора (Ф)
2
ω = 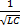
Активное сопротивление
R - aктивное сопротивление (Ом), I max - амплитудное значение силы тока (А),
U max - амплитудное значение напряжения (В)
6
XL = ω L
Индуктивное сопротивление
ХL – индуктивное сопротивление (Ом), L - индуктивность катушки (Гн), ω - циклическая частота собственных колебаний (рад/с)
7
Xc = 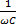
Емкостное сопротивление
ХС – емкостное сопротивление (Ом), ω - циклическая частота собственных колебаний (рад/с), С – электроемкость конденсатора (Ф)
8
Z = 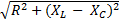
Коэффициент трансформации
N1 , N2 - число витков в катушках, U1 , U2 - напряжения на первичной и вторичной обмотках, I2 , I1 – сила тока в первичной и вторичной обмотках
10
R = ct /2
Радиолокация
R – расстояние до объекта (м), с – скорость света (м/с), с = 3∙108м/с, t- время движения электромагнитной волны (с)
11
∆ r = k λ или ∆ r = 2 k λ /2
Условие максимума
∆r - геометрическая разность хода волн (м), k = 1,2,3.. - целое число, λ - длина световой волны (м)
11
∆ r = (2k+ 1)  или ∆ r = ( k +
или ∆ r = ( k +  ) λ
) λ
Условие минимума
∆r - геометрическая разность хода волн (м), k = 1,2,3.. - целое число, λ - длина световой волны (м)
n – абсолютный показатель преломления среды, ∆r – геометрическая разность хода волн (м)
13
d sin φ = k λ, где d = 
Условие максимума для дифракционной решетки
d - период дифракционной решетки (м), φ - угол дифракции, k = 1,2,3.. - целое число, λ - длина световой волны (м), L - длина дифракционной решетки (м), N - число штрихов
Геметрическая оптика
1
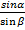 = n21 =
= n21 = 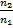 =
= 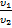 ,где n =
,где n = 
Закон преломления света (Закон Снелиуса)
α- угол падения, β - угол преломления, n21 - относительный показатель преломления, n1 n2 - абсолютные показатели преломления, υ - скорость света в среде (м/с), с – скорость света (м/с)
2
sin αпр = 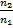 , n2 = 1, sin αпр =
, n2 = 1, sin αпр = 
Формула тонкой линзы
d - расстояние от предмета до линзы (м), f - расстояние от линзы до изображения (м), F - фокусное расстояние линзы (м).
Знак «плюс» ставится перед 1 /d , когда предмет действительный, перед 1 /f , когда изображение действительное, перед 1 / F, когда фокус действительный.
Знак «минус» ставится перед 1 /d , когда предмет мнимый, перед 1 /f , когда изображение мнимое, перед 1 / F, когда фокус мнимый.
4
D =  ± D = ±
± D = ±  ±
± 
Оптическая сила линзы
D – оптическая сила линзы (дптр)
5
Г =  =
= 
Линейное увеличение линзы
Г – линейное увеличение линзы, h - линейный размер предмета (м), Н –линейный размер изображения (м), d - расстояние от предмета до линзы (м), f - расстояние от линзы до изображения (м)
Следствия СТО
1
L = L0 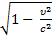
Относительность расстояний
L0 - длина тела в неподвижной СО, L - длина тела в подвижной СО, которая движется относительно неподвижной со скоростью υ
2
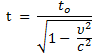
Релятивистский импульс
Р – релятивистский импульс (кг∙ м/с), υ – скорость движения тела (м/с)
6
E = 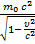 ,
, 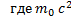 = E0
= E0
Связь между массой и энергией
E - полная энергия тела или системы тел (Дж), E0 – энергия покоя
Квантовые свойства света
1
E = hν = 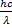 = A +
= A + 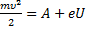
Формула Планка
υ - скорость движения фотона в среде (м/с), n - абсолютный показатель преломления среды.
3
p =  =
= 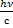
Импульс фотона
p - импульс фотона (кг∙м/с)
4
m = 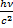 =
= 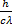
Релятивистская масса фотона
m - масса фотона (кг), с – скорость света (м/с)
5
λ = 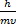
Дебройлевская длина волны
h - постоянная Планка, m - масса частицы (кг), υ - скорость частицы (м/с)
6
ν = R ( 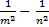 )
)
Физика атомного ядра
1
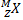 →
→ 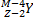 +
+ 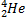
Правило Содди для α - распада
X – символ химического элемента, M – массовое число, Z – число протонов в ядре (число электронов), Y – вновь образованный химический элемент, 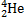 –
–
α – частица ( атом гелия)
2
M = N + Z
Массовое число
Z - число протонов, N - число нейтронов
3
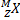 →
→ 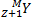 +
+ 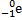
Правило Содди для β - распада
X – символ химического элемента, M – массовое число, Z – число протонов в ядре (число электронов), Y – вновь образованный химический элемент, 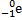 – β- частица (электрон)
– β- частица (электрон)
4
Ec = ∆Mc2
Энергия связи
∆M - дефект масс (а.е.м), c – скорость света (м/с)
5
∆M = Z mp + N mn – Mядра
Дефект масс
Z –число протонов, N – число нейтронов, mp – масса протона (а.е.м.), mn – масса нейтрона (а.е.м) , M ядра – масса ядра (а.е.м.)
6
N = N0 ∙ 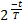
Молекулярная физика
| 1. | | Относительная молекулярная ( атомная ) масса. |
| mo – масса 1 молекулы вещества, moс – масса атома углерода 12С. | ||
| 2. |
| Молярная масса. |
| mo – масса 1 молекулы (атома) вещества, Na – постоянная Авогадро, Na = 6∙1023 моль-1. | ||
| 3. |
| Связь молярной с относительно молекулярной массой. |
| Мr –относительно молекулярная масса. | ||
| 4. |
| Масса любого вещества. |
| mo – масса 1 молекулы вещества, Na – постоянная Авогадро, Na = 6∙1023 моль-1, М – молекулярная масса, ν – количество вещества (моль), N – количество молекул. | ||
| 5. |
| Количество вещества. |
| m – масса вещества, Na – постоянная Авогадро, Na = 6∙1023 моль-1, М – молекулярная масса, ν – количество вещества, N – количество молекул. | ||
| 6. | | Уравнение Клаузиуса. Основное уравнение МКТ. |
| Р – давление, mo – масса 1 молекулы вещества, n – концентрация, ͞ν2 – квадрат средней квадратичной скорости. | ||
| 7. | | Связь давления со средней кинетической энергией. Основное уравнение МКТ. |
| n – концентрация, Е- средняя кинетическая энергия поступательного движения. | ||
| 8. |
| Абсолютная температура ( термодинамическая температура или температура по шкале Кельвина ) |
| Т – абсолютная температура (К), t – температура по Цельсию. | ||
| 9. | | Температура-мера средней кинетической энергии. Формула Больцмана. |
| Е- средняя кинетическая энергия поступательного движения, R – универсальная газовая постоянная, R = 8,31 Дж/моль∙К, Т – термодинамическая температура. | ||
| 10. |
| Давление через концентрацию и температуру. |
| Р – давление, n – концентрация, R – универсальная газовая постоянная, R = 8,31 Дж/моль∙К, Т – абсолютная температура. | ||
| 11. |
| Средняя квадратичная скорость. |
| R – универсальная газовая постоянная, R = 8,31 Дж/моль∙К, Т – термодинамическая температура, mo – масса 1 молекулы вещества, М – молекулярная масса, к – постоянная Больцмана, к = 1,38∙1023 Дж/К. | ||
| 12. |
| Закон Дальтона (давление смеси газов). |
| Р1 – парциальное давление первого газа (Па), Р2 – парциальное давление второго газа (Па). | ||
| 13. |
| Уравнение состояния идеального газа. (Уравнение Менделеева – Клапейрона ) |
| Р – давление, V – объём газа, m – масса газа, М – молекулярная масса, R – универсальная газовая постоянная, R = 8,31 Дж/моль∙К, Т – термодинамическая температура(К).. | ||
| 14. | | Уравнение Клапейрона, (объединенный газовый закон). |
| Р – давление (Па), V – объём газа (м3), Т – термодинамическая температура | ||
| 15. |
| Изотермический процесс. |
| Р – давление, V – объём газа. | ||
| 16. |
| Изобарный процесс. |
| V – объём газа, Т – термодинамическая температура. | ||
| 17. |
| Изохорный процесс. |
| Р – давление, Т – термодинамическая температура. | ||
| 18. |
| Абсолютная влажность воздуха. |
| ρ- абсолютная влажность (г/м3), V – объём газа, m – масса водяного пара. | ||
| 19. |
| Относительная влажность воздуха. |
| Р – парциальное давление водяного пара при данной температуре, Рн.п. – давление насыщенного пара при той же температуре, n – концентрация водяного пара, nн.п. – концентрация насыщенного пара, ρ- абсолютная влажность, ρн.п. – плотность насыщенного пара. |
Термодинамика
| 1 |
| Внутренняя энергия идеального газа. |
| i- число степеней свободы, m – масса газа, R – универсальная газовая постоянная, R = 8,31 Дж/моль∙К ,Т – термодинамическая температура, М- молярная масса. | ||
| 2 | | Работа газа. |
| р- давление газа, ∆V – изменение объёма газа. | ||
| 3 |
| Работа внешних сил. |
| р- давление газа, ∆V – изменение объёма газа. | ||
| 4 |
| Уравнение теплового баланса. |
| ∑ - сумма, Qотд – количество теплоты отданное, Qпол – количество теплоты полученное. | ||
| 5 |
| Количество теплоты при изменении температуры тела. |
| с– удельная теплоемкость (Дж/кг∙К), m – масса тела, t – температура тела, ∆t – изменение температуры. | ||
| 6 | CТ = | Теплоемкость тела. |
| Ст – теплоемкость тела (Дж/К), Q – количество теплоты, ∆t – изменение температуры, с – удельная теплоемкость вещества (Дж/кг∙К), m – масса тела. | ||
| 7 |
| Молярная теплоемкость. |
| С- молярная теплоемкость, Q – количество теплоты, ∆t – изменение температуры, с – удельная теплоемкость, М- молярная масса, ν – количество вещества. | ||
| 8 |
| Молярная теплоёмкость газа при постоянном объёме. |
| i- число степеней свободы, Сv - молярная теплоёмкость газа при постоянном объёме R – универсальная газовая постоянная, R = 8,31 Дж/моль∙К. | ||
| 9 |
| Молярная теплоёмкость газа при постоянном давлении. |
| i- число степеней свободы, Ср - молярная теплоёмкость газа при постоянном давлении, i- число степеней свободы, R – универсальная газовая постоянная, R = 8,31 Дж/моль∙К. | ||
| 10 |
| Уравнение Майера. |
| Ср - молярная теплоёмкость газа при постоянном давлени, Сv - молярная теплоёмкость газа при постоянном объёме, R – универсальная газовая постоянная, R = 8,31 Дж/моль∙К. | ||
| 11 |
| Количество теплоты выделяемом при полном сгорании топлива. |
| q- удельная теплота сгорания топлива, m – масса топлива. | ||
| 12 |
| Количество теплоты необходимое для плавления тела. |
| λ – удельная теплота плавления, m – масса тела. | ||
| 13 |
| Количество теплоты необходимое для парообразования вещества при температуре кипения. |
| L – удельная теплота парообразования, m – масса тела. | ||
| 14 | | КПД теплового процесса. |
| Qполез – полезно использованное количество теплоты, поглощаемого одними телами термодинамической системы, Qзатр – затраченное количество теплоты, выделенное другими телами этой системы. | ||
| 15 | | Первый закон термодинамики. |
| Uk – внутренняя энергия термодинамической системы в конечном состоянии (Дж), Uo – внутренняя энергия в начальном состоянии (Дж), ∆U – изменение внутренней энергии, Q – количество теплоты («+» берем, если система принимает количество теплоты, «-», если отдает), А –работа (если работа совершается над системой, то значение Авн.сил принимают положительным, если же работу совершает сама система, то значение Агаза принимают отрицательным). | ||
| 16 | | Применение первого закона термодинамики к изотермическому процессу. |
| ∆U – изменение внутренней энергии, Q – количество теплоты, Аг -работа газа. | ||
| 17 | | Применение первого закона термодинамики к изохорному процессу. |
| ∆U – изменение внутренней энергии, Q – количество теплоты, Аг –работа газа, | ||
| 18 | | Применение первого закона термодинамики к изобарному процессу. |
| ∆U – изменение внутренней энергии, Q – количество теплоты, Аг –работа газа, | ||
| 19 | | Применение первого закона термодинамики к адиабатному процессу. |
| ∆U – изменение внутренней энергии, Q – количество теплоты, Авн –работа внешних сил. | ||
| 20 | | КПД теплового двигателя. |
| Аг – работа газа, Q1 – количество теплоты, полученное от нагревателя, Q2 – количество теплоты, отданное холодильнику. | ||
| 21 | | КПД идеальной тепловой машины. Формула Карно. |
| Т1 – температура нагревателя (К), Т2 – температура холодильника |
ЭЛЕКТРОДИНАМИКА (ЭЛЕКТРОМАГНЕТИЗМ)
Электростатика
1.
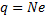
2.
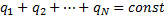
3.
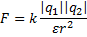
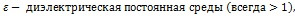 r - расстояние между зарядами
r - расстояние между зарядами 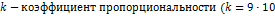 9
9 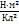 ;
; 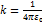 ),
q 1 , q 2 - электрические заряды (Кл),
),
q 1 , q 2 - электрические заряды (Кл), 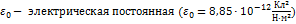
4.
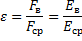
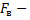 сила взаимодействия точечных зарядов в вакууме (Н),
сила взаимодействия точечных зарядов в вакууме (Н), 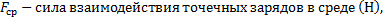
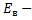 напряженность в вакууме (В/м); Еср - напряженность в среде (В/м).
напряженность в вакууме (В/м); Еср - напряженность в среде (В/м).
5.

 - N –число сил
- N –число сил
6.
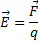
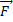 - сила, с которой поле действует на заряд (Н), q – электрический заряд (Кл),
- сила, с которой поле действует на заряд (Н), q – электрический заряд (Кл), 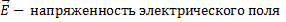 (В/м).
(В/м).
7.
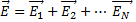
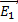 - напряженность
- напряженность 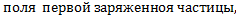
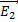 - напряженность
- напряженность 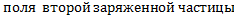
8.
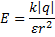
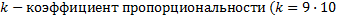 9
9 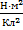 ;
; 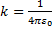 ), q – электрический заряд (Кл),
), q – электрический заряд (Кл), 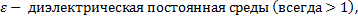 r – расстояние от данной точки до этого заряда (м)
r – расстояние от данной точки до этого заряда (м)
9.
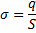
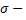 поверхностная плотность заряда (Кл/м2)
поверхностная плотность заряда (Кл/м2)
10.
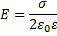
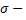 поверхностная плотность заряда (Кл/м2),
поверхностная плотность заряда (Кл/м2), 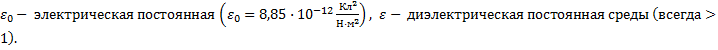
11.
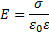
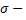 поверхностная плотность заряда (Кл/м2),
поверхностная плотность заряда (Кл/м2), 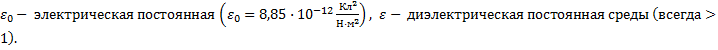
12.
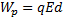
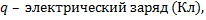
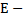 напряженность поля (В/м); d – расстояние (м)
напряженность поля (В/м); d – расстояние (м)
13.
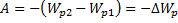
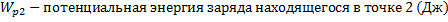
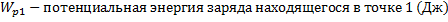
14.
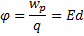
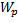 -
- 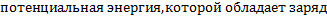
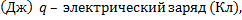
15.
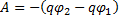
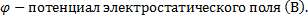
16.
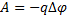
17.
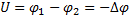
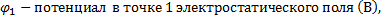 φ2 - потенциал в точке 2 электростатического поля (В) Δφ – изменение потенциала (В)
φ2 - потенциал в точке 2 электростатического поля (В) Δφ – изменение потенциала (В)
18.
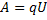
19.
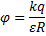
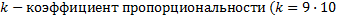 9
9 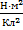 ;
; 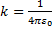 ), q – электрический заряд (Кл),
), q – электрический заряд (Кл), 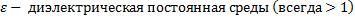
20.
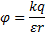
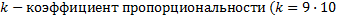 9
9 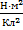 ;
; 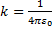 ), q – электрический заряд (Кл),
), q – электрический заряд (Кл), 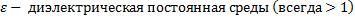 .
.
21.
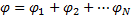
22.
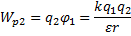
23.
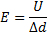
24.
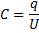
25.
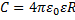
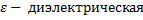 постоянная среды,
постоянная среды, 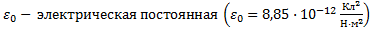 , R – радиус шара (м)
, R – радиус шара (м)
26.
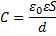
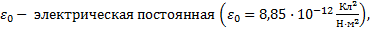
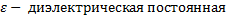 среды, S – площадь каждой пластины, d – расстояние между пластинами
среды, S – площадь каждой пластины, d – расстояние между пластинами
27.

28.
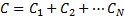
29.
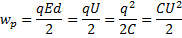
Закон ы постоянного тока
1.
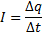
Дата: 2019-02-19, просмотров: 452.
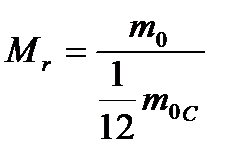
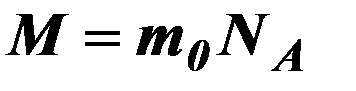
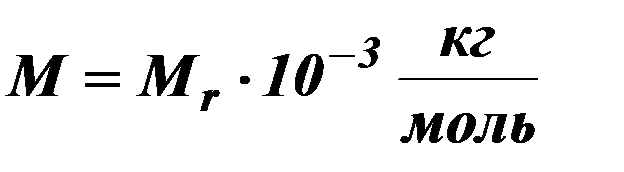
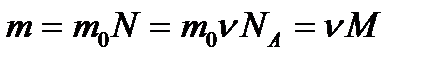
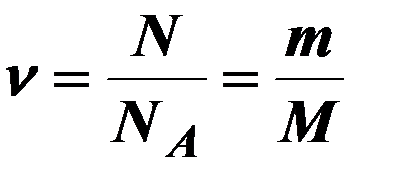

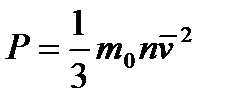
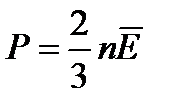
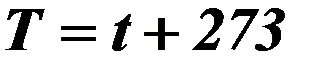
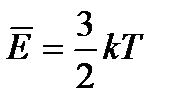
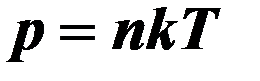
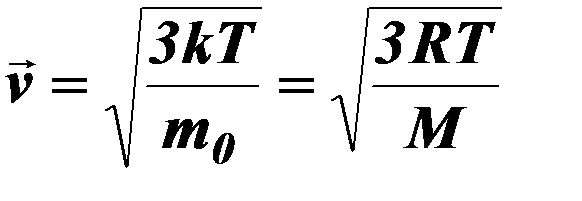
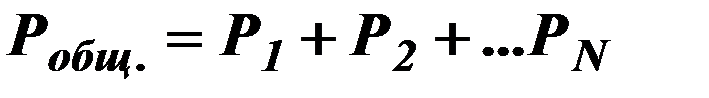
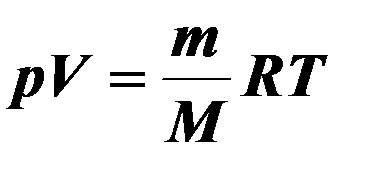
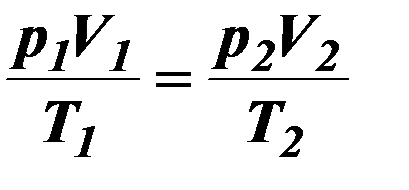
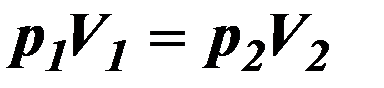
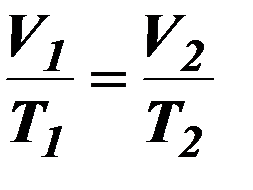
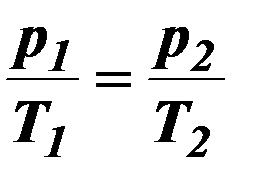
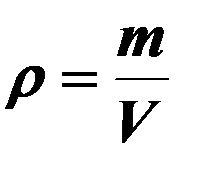
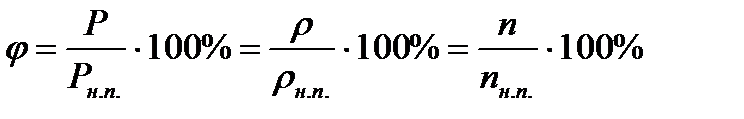
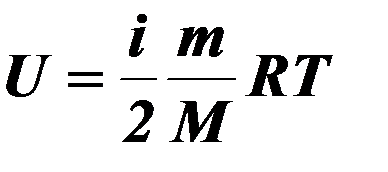
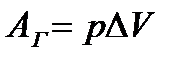
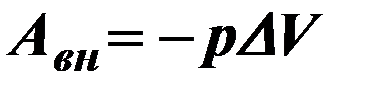
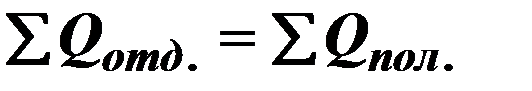
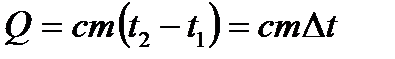
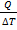 =
= 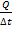 = cm
= cm