Согласно теории электролитической диссоциации Аррениуса, кислотой называется вещество, которое при диссоциации отщепляет свободные ионы водорода Н+, а основанием – вещество, которое при
3
диссоциации отщепляет свободные ионы гидроксида ОН-. Основания, образованные щелочными металлами (Li, Na, K и т.д. ), являются сильными электролитами (a »1) и называются щелочами. Диссоциация кислот и оснований протекает ступенчато: последовательно отщепляется ион Н+ ( или ОН-), т.е. число ступеней зависит от основности кислоты (числа атомов Н в молекуле) или от кислотности основания (числа гидроксидных групп ОН-). Например: диссоциация Н3РО4 протекает в три ступени:
I Н3РО4 ↔ Н+ + Н2РО4- a 1 <1;
II Н2РО4- ↔ Н+ + НРО42-, a 2 < a 1;
III НРО42- ↔ Н+ + РО43-, a 3 < a 2 < a 1;
а Zn(OH)2 в две ступени:
I Zn(OH)2 ↔ ZnOH+ +OH- ; II ZnOH+ ↔ Zn2++ OH-
Процесс диссоциации солей определяется типом соли: средние соли распадаются одноступенчато, диссоциация кислых и основных определяется «остатком» кислоты (или основания) в составе соли. Например, основная соль MgOHCl диссоциирует в 2 ступени:
I. MgOHCl ↔ MgOH+ + Cl-, a =1; II. MgOH+ ↔ Mg2+ + OH- a<1.
Обратимый процесс диссоциации слабых электролитов характеризуется константой диссоциации Кд. Например, для слабой уксусной кислоты, процесс диссоциации которой идет в соответствии с уравнением CH3COOH ⇄ H+ + CH3COO -,
Кд = 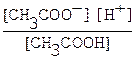
4
В зависимости от величины Кд электролиты подразделяются на сильные ( Кд >10-3) и слабые ( Кд< 10 -3). К д зависит только от природы электролита и температуры и является табличной величиной.
Для слабых электролитов бинарного типа (распадаются на один катион и один анион) взаимосвязь между исходной концентрацией растворенного вещества (молярностью См), концентрациями ионов, нераспавшихся молекул, степенью и константой диссоциации выражается законом разведения (разбавления) Оствальда:
Реакция диссоциации АВ ↔ А+ + В-.
Концентрации ионов в растворе [A+] = [B-] = a C м .
Концентрация нераспавшихся молекул [AB] = (1-a) C м.
Уравнение Оствальда для слабых (ά→0, Кд<10- 4 ) электролитов Кд = a2См
Диссоциация воды. рН - водородный показатель
Вода хотя и весьма незначительно, но все же диссоциирует на ионы:
Н2О ↔ Н+ + ОН-. Следовательно, вода является типичным амфотерным электролитом, т.е. она может действовать в равной степени и как кислота и как основание. Установлено, что константа диссоциации воды равна 

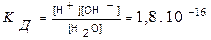 .
.
Судя по значению этой величины, вода является очень слабым электролитом. Произведение концентраций водородных и гидроксид-
ионов, которое при данной температуре является постоянной величиной,
5
называется ионным произведением воды, его обозначают Кw или КН2О. При 250С Кw =[Н+][ОН-]=10-14. Для процесса Н+(р) + ОН- (р) ® Н2О(р) ,
DН0298 = -56кДж/моль; обратный процесс - диссоциация воды является эндотермическим процессом. Отсюда, в соответствие с принципом Ле-Шателье, температура будет оказывать влияние на Кw .
Для характеристики кислотности раствора используют водородный показатель (рН). рН = - lg[H+], где [H+] - концентрация ионов водорода в моль/л. Т.к. Кw ¹ 0, то и не может быть водного раствора, в котором концентрация Н+ или ОН- равнялась бы нулю. Следовательно, в любом водном растворе присутствуют совместно ионы Н+ и ОН-. Для нейтральной среды [Н+] = [ОН-] = 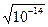 =10-7 моль/л, следовательно рН=7. В кислой среде [Н+]> 10-7 моль/л, т.е. 0< рН <7, в щелочной среде [ОН-] > 10-7моль/л, т.е. 7 < рН £ 14.
=10-7 моль/л, следовательно рН=7. В кислой среде [Н+]> 10-7 моль/л, т.е. 0< рН <7, в щелочной среде [ОН-] > 10-7моль/л, т.е. 7 < рН £ 14.
Шкала рН для ст.усл.:
[Н+], моль/л: 1 10-7 10-14
 |
рН : 0 кислая среда 7 щелочная среда 14
Примеры решения задач
Задача 1 . Рассчитать концентрацию ионов водорода в растворе HCN (См = 10-3 М ), если a = 4,2∙10-3.
Решение: Диссоциация цианистоводородной кислоты протекает по уравнению HCN ↔ H+ + CN-; концентрации ионов [H+] и [CN-] в растворе равны между собой ( т.к. nН+ : nСN- = 1:1, где
6
n - стехиометрические коэффициенты) т.е. [H+] = [CN-] = a Cм, моль/л; Тогда [H+] = [CN-] = 4,2∙10-3∙ 10-3 = 4,2×10-7 моль/л.
Задача 2 . Рассчитать концентрацию ионов водорода и гидроксид-ионов в рстворе NH4OH, концентрацией См= 0,01М, если Кд = 1,8×10-5.
Решение: Гидроксид аммония диссоциирует следующим образом:
NH4OH ↔ NH4+ + OH-, константа диссоциации имеет вид
Кд = 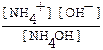 ;
;
концентрации ионов аммония [NН4+] и гидроксида [OH-] совпадают (n (NH4+) :n (OH-) = 1:1), обозначим их за х:
[NH4+] = [OH-] = х моль/л , тогда выражение для Кд примет вид
1,8×10-5 = х2/ 0,01-х. Считая, что х << См, решаем уравнение
1,8×10-5=x2/ 0,01, относительно х: х = 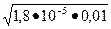 =4,2∙10-4моль/л; [OH-]= 4,2∙10-4 моль/л.
=4,2∙10-4моль/л; [OH-]= 4,2∙10-4 моль/л.
Концентрации ионов водорода и гидроксида связаны через ионное произведение воды Кw= [H+][OH-] =10-14, выразим концентрацию ионов водорода [H+] = Kw/[OH-] и рассчитаем её значение:
[H+]=1×10-14/4,2×10-4 = 2,3×10-11моль/л.
Задача 3 . Определить рН раствора НСl (a=1), если См =2∙10-3 М
Решение: Диссоциация соляной кислоты протекает по уравнению
HCl ® H+ + Cl-, концентрация ионов водорода [H+] = a Cм =1∙2∙10-3 = =2∙10-3 моль/л. Водородный показатель рН = - lg[H+] = - lg2∙10-3 = 2,7.
7
Задача 4 . Определить молярную концентрацию гидроксида аммония, если рН=11, а Кд=1,8∙10-5.
Решение: Концентрация ионов водорода [H+]=10-pH=10-11моль/л. Из ионного произведения воды определяем концентрацию [OH-] = Kw / [H+] = 10-14/10-11=10-3моль/л. Гидроксид аммония - слабое основание и характеризуется уравнением реакции диссоциации
NH4OH ↔ NH4+ + OH-. Выражение для константы диссоциации
Кд=. 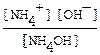
из закона Оствальда следует, что [NH4+ ] = [OH-] = a∙Cм, а Кд = a2См. Объединяя уравнения, получимСм=[OH-]2/Kд = 10-6/ 1.8∙10-5 = 0,056 моль/л
Произведение растворимости
Вещества, в зависимости от своей природы, обладают различной растворимостью в воде, которая колеблется от долей миллиграмма до сотен граммов на литр. Трудно растворимые электролиты образуют насыщенные растворы очень маленьких концентраций, поэтому можно считать, что степень их диссоциации достигает единицы. Таким образом, насыщенный раствор труднорастворимого электролита представляет собой систему, состоящую из собственно раствора, находящегося в равновесии с осадком растворенного вещества. При постоянных внешних условиях скорость растворения осадка равна скорости процесса кристаллизации: КnАm ↔ n К+m + mA-n (1)
осадок раствор
8
Для описания этого гетерогенного равновесного процесса используют константу равновесия, называемую произведением растворимости ПР = [K+ m]n[A-n]m, где [K+ m] и [A- n] – концентрации ионов в насыщенном растворе (моль/л). Например:
AgCl= Ag+ +Cl -, ПР = [Ag+] [Cl-]; здесь n=m=1.
PbI2 = Pb2+ +2I-, ПР =[Pb2+][I-]2; здесь n=1, m=2.
ПР зависит от природы растворенного вещества и температуры. ПР является табличной величиной. Зная ПР, можно вычислить концентрацию насыщенного раствора вещества, а также оценить его растворимость в г на 100 мл воды ( величина s, приводимая в справочной литературе) и определить возможности выпадения вещества в осадок.
Для уравнения (1) взаимосвязь концентрации насыщенного раствора трудно растовримого вещества (См, моль/л) с величиной ПР определяется следующим уравнением: 
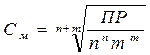 ,
,
где n и m –стехиометричекие коэффициенты в ур. 1.
Задача 5. Концентрация насыщенного раствора (См) Mg(OH)2 равна 1,1•10-4 моль/л. Записать выражение для ПР и вычислить его величину.
Решение: В насыщенном растворе Mg(OH)2 устанавливается равновесие между осадком и раствором Mg(OH)2 ↔ Mg2++2OH-, для которого выражение ПР имеет вид ПР = [Mg2+][OH-]2. Зная концентрации ионов, можно найти его численное значение. Учитывая полную диссоциацию
9
Mg(OH)2, концентрация его насыщенного раствора См = [Mg2+]= 1,1×10-4 моль/л, а [OH-] = 2[Mg2+] = 2,2×10-4 моль/л. Следовательно, ПР= [Mg2+][OH-]2 =1,1. 10-4× (2,2 10-4)2 = 5,3. 10-12.
Задача 6. Вычислить концентрацию насыщенного раствора и ПР хромата серебра, если в 0,5 л воды растворяется 0,011 г соли.
Решение: Для определения молярной концентрации насыщенного раствора Ag2CrO4 воспользуемся формулой CM =  , где m- масса растворенного вещества (г), М- молярная масса ( г/моль), V - объем раствора (л). М( Ag2 CrO4) =332 г/моль. См =
, где m- масса растворенного вещества (г), М- молярная масса ( г/моль), V - объем раствора (л). М( Ag2 CrO4) =332 г/моль. См = 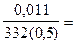 9,48.10-5 моль/л. Растворение хромата серебра (I) сопровождается полной (a=1) диссоциацией соли: Ag2CrO4 ↔ 2Ag++ CrO42-, ПР=[Ag+]2[CrO42-], где [CrO42-] = См = 9,48.10-5 моль/л, а [Ag+] = 2 [CrO42-]=1,896× 10-4.
9,48.10-5 моль/л. Растворение хромата серебра (I) сопровождается полной (a=1) диссоциацией соли: Ag2CrO4 ↔ 2Ag++ CrO42-, ПР=[Ag+]2[CrO42-], где [CrO42-] = См = 9,48.10-5 моль/л, а [Ag+] = 2 [CrO42-]=1,896× 10-4.
Таким образом ПР = (1,896× 10-4)2 (9,48 ×10-5) = 3,4 ×10-12.
Задача 7. Можно ли приготовить растворы соли СаСО3 с концентрациями СаСО3 С1 =10-2 М и С2 = 10-6 М , если ПР СаСО3 = 3,8× 10-9.
Решение: Зная величину ПР, можно рассчитать концентрацию
насыщенного раствора соли и, сравнив ее с предлагаемыми
концентрациями, сделать вывод о возможности или невозможности приготовления растворов. Растворение карбоната кальция протекает по схеме CaCO3 ↔ Ca2+ +CO32- В данном уравнении n = m = 1, тогда
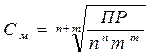 =
= 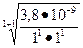 ≈ 6,2•10-5моль/л ,
≈ 6,2•10-5моль/л ,
10
С1> См – раствор приготовить нельзя, так как будет выпадать осадок;
С2< См – раствор приготовить можно.
Реакции ионного обмена
Для растворов электролитов характерны реакции ионного обмена. Обязательным условием протекания таких реакций практически до конца является удаление из раствора тех или иных ионов вследствие:
1 ) образования осадка
FeSO4 + 2 NaOH ® Fe(OH )2¯ + Na2SO4 - молекулярное уравнение (МУ)
Fe2++SO42-+2Na++2OH-®Fe(OH)2¯+2Na++SO42— ионно-молекулярное уравнение (ИМУ).
Fe2+ +2OH- ® Fe(OH)2¯ (ПР Fe(OH)2 = 4,8×10-16) – краткое ионно-молекулярное уравнение образования осадка;
Выделение газа
Na2CO3 + 2H2SO4 ® H2CO3 + 2NaHSO4 (МУ)
2Na+ +CO32- + 2H+ + 2HSO4- ® H2C03 + 2Na+ + 2HSO4- (ИМУ)
2H+ + CO32- ® H2C03 ® H2O + C02 - ионно - молекулярное ур-е
образования летучего соединения.
3) образование слабых электролитов
а) простые вещества:
2KCN + H2SO4 ®2HCN + K2SO4 (МУ)
2K+ + 2CN- + 2H+ +SO42- ® 2HCN + 2K+ +SO42- (ИМУ)
CN- + H+ ® HCN (Кд HCN = 7,8•10-10) –ионно-молекулярное ур-е образования слабого электролита HCN.
11
б) комплексные соединения:
ZnCl2 + 4NH3 ® [Zn (NH3)4]Cl2 (МУ)
Zn2+ + 2Cl- +4NH3 ® [ Zn (NH3)4]2+ + 2Cl- -(ИМУ)
Zn2++4NH3 ® [Zn(NH3)4]2+- краткое ионно-молекулярное уравнение образования комплексного катиона.
Встречаются процессы, при которых слабые электролиты или малорастворимые соединения входят в число исходных веществ и продуктов реакции. Равновесие в этом случае смещается в сторону образования веществ, имеющих наименьшую константу диссоциации или в сторону образования менее растворимого вещества:
А) NH4OH + HCl ® NH4Cl + H2O (МУ)
NH4OH + H+ + Cl- ® NH4+ + Cl- + H2O
NH4OH + H+ ® NH4+ + H2O (ИМУ)
Кд(NH4OH) =1,8× 10-5 > Кд(H2O) =1,8×10-16.
Равновесие сдвинуто в сторону образования молекул воды.
Б) AgCl¯ + NaI ®AgI¯ + NaCl (МУ)
AgCl¯ + Na+ +I- ®AgI¯+ Na+ +Cl-
AgCl¯ + I- ®AgI¯ + Cl- (ИМУ)
ПРAgCl=1,78×10-10 > ПРAgI =8,3×10-17.
Равновесие сдвинуто в сторону образования осадка AgI.
В) Могут встречаться процессы, в уравнениях которых есть и малорастворимое соединение и слабый электролит
MnS¯ + 2HCl ® MnCl2 + H2S (МУ)
MnS¯ + 2H+ +2Cl- ® Mn 2+ + 2Cl- + H2S
MnS¯ + 2 H+ ® Mn2+ + H2S (ИМУ)
12
ПРMnS=2,5×10-10; [S-2]= 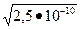 =1,58.10-5 моль/л
=1,58.10-5 моль/л
Kд H2S= K1×K2 = 6×10-22; [S2-] = 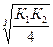 =5,4.10-8 моль/л
=5,4.10-8 моль/л
Связывание ионов S2- в молекулы H2S происходит полнее, чем в MnS, поэтому реакция протекает в прямом направлении, в сторону образования H2S
Гидролиз солей
Гидролиз является результатом поляризационного взаимодействия ионов соли с их гидратной оболочкой. Гидролиз - это обменная реакция в растворе между молекулами воды и ионами соли. В результате гидролиза, благодаря образованию слабого электролита (слабой кислоты или слабого основания), изменяется ионное равновесие Н2О ⇄ Н+ + ОН- из-за связывания Н+ или ОН- и изменяется рН-среды. Гидролизу подвергаются соли, в состав которых входят ионы слабой кислоты или слабого основания. Соли, образованные ионами сильной кислоты и сильного основания, гидролизу не подвергаются (NaCl, Na2SO4). Продуктами гидролиза могут быть слабые электролиты, малодиссоциирующие, труднорастворимые и летучие вещества. Гидролиз - стадийная реакция, в случае многозарядного иона число стадий равно его заряду. Гидролизу по катиону подвергаются соли, образованные анионами сильной кислоты и катионами слабого основания. Например, к слабым основаниям относятся гидроксиды p- и d-металлов (Кд£10-4), а также гидроксид аммония.
13
Хлорид цинка - соль, образованная слабым основанием Zn(OH)2 и сильной кислотой HCl. Катион цинка имеет заряд 2+, поэтому гидролиз будет проходить в две ступени:
Zn2+ + HOH ↔ ZnOH+ + H+ I ступень
ZnOH+ + HOH ↔ Zn(OH)2 + H+ II ступень
В результате этого взаимодействия возникает избыток ионов Н+ ([Н+] > [ОН-]) , раствор подкисляется (рН<7).
Гидролиз по аниону. Данный тип гидролиза характерен для солей, образованных анионами слабой кислоты (Кд £10-3) и катионами сильного основания (Kд>10-3). Рассмотрим гидролиз карбоната калия - соли, образованной слабой угольной кислотой H2CO3 (KдI = 4,5. 10-7) и сильным основанием KOH, карбоксо-анион имеет заряд (2-). Гидролиз протекает в две ступени:
CO32- + H2O ↔ HCO3- + OH- I ступень
HCO3- + H2O ↔ H2CO3 + OH- II ступень
В этом случае высвобождаются ионы ОН- ([Н+] < [ОН-]) - раствор подщелачивается (рН >7).
Необратимый гидролиз. Соли, образованные слабым основанием и слабой кислотой, гидролизуются по катиону и аниону. Результат гидролиза будет зависить от значения Кд основания и кислоты. Рассмотрим гидролиз фторида аммония - соли, образованной слабым
основанием NH4OH (Кд =1,8 . 10-5) и слабой кислотой HF (Кд = 6,8 .10-4):
NH4F + HOH ® NH4OH + HF
В этом случае Кд(NH4OH) < Кд(HF), следовательно, гидролиз (в основном) пойдет по катиону и реакция среды будет слабокислой.
14
ЗАДАЧИ
Реакции ионного обмена
1. Можно ли приготовить раствор, содержащий одновременно следующие пары веществ: а) Cu(NO3)2 и NaCl; б) NaOH и HCl ; в)BaCl2 и H2SO4? Составить молекулярные (МУ) и ионно-молекулярные уравнения возможных реакций (ИМУ).
2. Будут ли протекать реакции между растворами следующих электролитов: а)K2CO3 и HCl ; б) KNO3 и Na2S; в) CdSO4 и NaOH ? Написать молекулярные и ионно-молекулярные уравнения возможных реакций.
3. Написать ионно-молекулярные уравнения реакций между растворами
следующих солей: а) сульфатом меди и хлоридом бария; б)сульфатом натрия и нитратом свинца; в) сульфатом железа (II) и гидроксидом лития; г)нитратом серебра и хлоридом железа (III); д) сульфидом натрия и серной кислотой; е) нитратом свинца (II) и раствором сероводорода.
4. Составьте молекулярные и ионные уравнения следующих реакций и укажите в каждом отдельном случае причину, вызывающую смещение равновесия:
а) Pb(NO3)2 + KI = б) AlBr3 + AgNO3 = в) Cr2(SO4)3 + KOH=
г) Al(OH)3 + KOH = д) CaSO4 + BaCl2 = е) Pb(NO3)2 + H2S =
5. Написать молекулярные уравнения реакций, выраженных следующими молекулярно-ионными уравнениями:
а) Pb2+ + 2Cl- = PbCl2 б) CH3COO- + H+ = CH3COOH. в) Ba2+ + SO42- = BaSO4 г) CN- + H+ = HCN
д) Mn2+ + S2- = MnS е) Sn2+ + 2OH- = Sn(OH)2
15
6. С помощью молекулярных и ионно-молекулярных уравнений ответить на вопросы: а) растворы каких солей надо смешать для получения в осадке карбоната кальция? б) можно ли карбонат кальция перевести в сульфат кальция действием на него сульфата натрия (ПРCaSO 4 = 2,5×10-5; ПРCaCO 3 =3,8 10-9)?
7. Будут ли протекать реакции между растворами следующих электролитов: а)Ba(OH)2 и HNO3; б) (NH4)2SO4 и KOH; в) CuSO4 и NaOH? Написать молекулярные и ионно-молекулярные уравнения возможных реакций.
8. С помощью молекулярных и ионно-молекулярных уравнений ответить
на вопросы: а) растворы каких солей надо смешать для получения
в осадке сульфата бария? б) можно ли сульфат бария перевести в сульфат стронция действием на него хлорида стронция?
ПРBaSO4 = 1,1•10-10; ПР SrSO4=3,2• 10-7.
9. Написать молекулярные и ионно-молекулярные уравнения реакций между растворами следующих электролитов: а) сульфата натрия и серной кислоты; б) хлорида цинка и гидроксида калия; в) карбоната калия и соляной кислоты.
10. Смешивают попарно растворы: а) NaOH и KCl; б) K2SO3 и HCl;
в)CuCl2 и Ba(OH)2; г)H2SO4 и HCl. В каких случаях реакции идут до конца?
11. Написать в ионно-молекулярной форме уравнения реакций образования соединений, менее растворимых, чем исходные:
а) SrSO4 + BaCl2; б)AgCl +K2S; в) CaCl2 + Na3PO4.
16
12. Написать в молекулярной и ионно-молекулярной форме уравнения реакций, приводящих к образованию малодиссоциирующих соединений:
а) Na2S + H2SO4 ; б) NH4Cl + КOH ; в) К2S + HCl.
13. Написать в молекулярной и ионно-молекулярной форме уравнения реакций нейтрализации и указать, какая из них протекает практически до конца. а) H2SO4 + NaOH; б) HCN + KOH; в) NH4OH + H2SO4.
14. Можно ли приготовить раствор, содержащий одновременно следующие пары веществ: а) NaOH и Ca(OH)2; б) Sn(OH)2 и NaOH; в) Sn(OH)2 и HNO3?
15. Написать в молекулярной и ионно-молекулярной форме уравнения реакций, приводящих к образованию малорастворимых соединений или
газов:
а) Pb(NO3)2 + KI ; б) K2CO3 + HCl ; в) NiCl2 + H2S.
16. Можно ли приготовить раствор, содержащий одновременно следующие пары веществ: а) CuSO4 и NaNO3; б) Na2CO3 и HCl ; в) AgNO3 и NaCl? Ответ обосновать с помощью молекулярных и ионных уравнений.
17. Можно ли приготовить раствор, содержащий одновременно следующие пары веществ: а) Zn(OH)2 и KOH; б) Ba(OH)2 и HCl; в) Fe(OH)3 и NaOH Приведите возможные реакции в молекулярном и ионно-молекулярном виде.
18. С помощью молекулярных и ионно-молекулярных уравнений ответить на вопросы: а) растворы каких солей надо смешать для получения в осадке хлорида серебра ?
17
б)можно ли хлорид серебра (I) перевести в сульфат серебра действием на него сульфата натрия (ПРAgCl = 1,79×10-10, ПРAg2SO4 = 1,×10-5). Ответ обосновать.
19. Смешивают попарно растворы следующих электролитов:
а) Cu(NO3)2 и Na2SO4; б) BaCl2 и K2SO4; в) KNO3 и NaCl; г) AgNO3 и KCl. В каких из приведенных случаев реакция практически пойдет до конца? Составьте для этих реакций молекулярные и ионно-молекулярные уравнения.
20. Составьте молекулярные уравнения к каждому из ионно-молекулярных уравнений:
а) Сa2+ + CO32- =CaCO3¯; б) Fe3+ + 3OH- = Fe(OH)3¯.
21. Написать в молекулярной и ионно-молекулярной форме уравнения реакций между: а) сульфидом марганца (II) и серной кислотой; б) гидроксидом свинца (II) и гидроксидом калия; в) гидроксидом магния и раствором хлорида аммония; г) карбонатом кальция и соляной кислотой.
22. Написать молекулярные и ионно-молекуляpные уравнения реакций:
а) растворения карбоната кальция в соляной кислоте; б) взаимодействия растворов нитрата бария и сульфата натрия; в) взаимодействия растворов хлорида железа (III) и гидроксида аммония.
23. К каждому из веществ: AlCl3, H2SO4, Ba(OH)2, FeCl3 прибавили раствор гидроксида калия. В каких случаях произошли реакции? Выразить их молекулярными и ионно-молекулярными уравнениями.
18
24. Написать в молекулярной и ионной формах уравнения реакций между:м: а) уксусной кислотой и гидроксидом натрия; б) сероводородной кислотой и гидроксидом бария; в) фтористоводородной кислотой и гидроксидом натрия; г) азотной кислотой и гидроксидом аммония.
25. Написать в молекулярной и ионной форме уравнения реакций между: а) сульфидом цинка и соляной кислотой; в) сульфатом аммония и гидроксидом калия.
26. К каждому из веществ KHCO3, CH3COOH, BaCl2, Na2S прибавили раствор серной кислоты. В каких случаях произошли реакции? Выразить их молекулярными и ионно-молекулярными уравнениями.
27. К каждому из веществ Na2CO3, Fe(OH)3, NaNO3, KHS прибавили раствор соляной кислоты. В каких случаях произошли реакции? Выразить их молекулярными и ионно-молекулярными уравнениями.
Диссоциация воды. Водородный показатель
28. Вычислить концентрацию ионов водорода [H+] (моль/л) и pH растворов, в которых концентрация ионов гидроксида [OH-] равна:
а) 10-5 моль/л; б) 1,7 10-8 г/л; в) 10-9 моль/л; г) 0,0051 г/л.
29. Вычислить pH и молярность раствора (См) муравьиной кислоты
HCOOH, если концентрация ионов водорода в растворе 10-4 г/л,
а Кд =1,8. 10-4.
30.Вычислить pH следующих растворов (r = 1 г/мл):
а)0,46% HCOOH, a=0,042; б) 0,1M HF, a=0,085.
31. Определить степень диссоциации (α):
a) CH3COOH в 0,1М растворе, если [H+] = 0,00132 моль/л;
19
б) HNO2 в 0,1M растворе, если [H+] = 0,0068моль/л;
в) HCOOH в 0,01М растворе, если [H+] = 0,000134 моль/л.
32.Определить концентрацию ионов водорода [H+] и степень диссоциации (a) в растворах:
a) 0,1н CH3COOH, Kд = 1,8 ∙10-5; б) 0,1M HCN, Kд = 7,9 ∙10-10; в) 0,5M Н2СО3 , Kд1 =4,45 ∙ 10-7; г) 1M H2Sе, Kд1 = 1,7 ∙ 10-4; д) 0,1н H3 ВO3, Kд1 =5,8 ∙ 10-10.
33. Вычислить константу диссоциации угольной кислоты по первой ступени (Kд1), если в 0,1н растворе Н2CO3, степень диссоциации a = 3 ∙10-3
34. Вычислить рН следующих растворов, приняв для них степень диссоциации и плотность равными единице: a) 5,8∙10-3М раствора соляной кислоты; б) 0,1М раствора соляной кислоты; в) 2,5∙10-2М раствора гидроксида натрия; г) 2∙10-2 М раствора азотной кислоты; д) 0,1% раствора азотной кислоты; е) 0,05% раствора гидроксида натрия.
35.Вычислить рН растворов: а) 0,01М раствора уксусной кислоты (a=4,2%); б) 0,1М раствора фтористоводородной кислоты (a = 8,5%);
в) раствора, в 1 литре которого содержится 0,0052 г гидроксид-ионов; г) раствора, в 1 литре которого содержится 0,1г гидроксида натрия (a = 1)
36. Исходя из констант диссоциации слабых электролитов, вычислить рН следующих растворов: а) 0,25М раствора уксусной кислоты; б) 0,01М раствора цианистоводородной кислоты; в) 1,2М раствора азотистой кислоты; г) 5% раствора муравьиной кислоты.
37. Вычислить рН растворов:
а) 0,001М NH4OH, Кд = 1,8 ∙ 10-5;
20
б) в 1 л которого содержится 7 г NH4OH, Кд =1,8 ∙ 10-5;
в) в 0,5 л которого содержится 0,007 г NH4OH, Кд = 1,8 ∙ 10-5.
38. Какое значение рН имеет раствор, если в 1 литре его содержится 0,49 г H2SO4?
39. Определить рН и концентрацию гидроксид ионов (моль/л) в 0,365% растворе HCl (r = 1 г/мл), полностью диссоциирующей на ионы.
40. Определить степень диссоциации раствора уксусной кислоты, рН = 3. Кд= 1,8 ∙ 10-5.
41. Рассчитать рН раствора (a=1), в 100 мл которого содержится 0,4 г NaOH.
42. Как изменится рН чистой воды, если к 1 л ее добавить 1∙10-3 моль NaOH (α = 1)?
43. Определить рН 0,056 % КОН (r=1г/мл, α = 1).
44. Определить рН 1% раствора NH4OH. Kд= 1,8 ∙ 10-5 (r = 1 г/мл).
45. Определить молярность раствора H2SO4 (считая, что диссоциация идет по двум ступеням), если концентрация гидроксид-ионов в нем равна 10-11 моль/л.
46. Какова константа и степень диссоциации уксусной кислоты в 0,1М растворе, если концентрация ионов водорода равна 1,32 ∙ 10-3 моль/л?
47. Вычислить концентрацию ионов водорода и степень диссоциации 1% раствора уксусной кислоты. Кд =1,8 ∙10-5 (r = 1 г/мл).
48. Вычислить константу диссоциации кислоты:
а) HCOOH, если в 0,4М растворе [H+] = 2,68 ∙ 10-3 моль/л;
б) HCN, если в 0,25М растворе [H+]=1∙ 10-5 моль/л;
в) HСOOH, если в 0,0055М растворе [H+]=1∙ 10-3 моль/л.
21
49. Вычислить степень диссоциации следующих растворов:
а) 0,5М СН3СООН, Кд =1,8 ∙ 10-5;
б) 0,001 М HCN, Кд = 7,9 ∙ 10-10;
в) 3,5% NH4OH, Кд = 1,8 ∙ 10-5 (r = 1г/мл).
50. Вычислить молярность растворов следующих кислот, если известно:
а) раствора HCN рН= 5. Кд = 7,9 ∙ 10 -10;
б) концентрация ионов водорода в растворе HCl (a=1) равна 1,5 ∙ 10-3 г/л;
в) концнтрация гидроксид-ионов в растворе НСООН равна 1∙10-10 моль/л, Кд=1,8 ∙ 10-4.
51. Определить рН и концентрацию гидроксид-ионов (моль/л) 0,1М раствора H2S, учитывая только первую ступень дисоциации, для которой Кд1 =1,1∙10-7.
52. Определить рН и молярность раствора HCN, если концентрация гидроксид-ионов в нем равна 10-9 моль/л. Кд = 7,8∙ 10-10.
53. Вычислить степень диссоциации (α) и рН 0,05н раствора HNO2 Кд = 5 ∙ 10-4.
54. Рассчитать рН и концентрацию гидроксид-ионов (моль/л) в растворе, в 100 мл которого содержится 0,63 г HNO3 (a=1).
55. Определить рН и молярность раствора КОН (a=1), в 100 мл которого содержится 0,39 г калия в виде ионов.
56. Рассчитать молярность раствора NH4OH, рН которого равен 11.
57. Рассчитать концентрацию гидроксид - ионов и рН 0,112 % раствора КОН (r=1г/мл, α = 1).
58. Определить молярность и концентрацию гидроксид - ионов (моль/л) раствора HNO2, рН которого равен 4, Кд = 5 ∙10-4.
22
59. Определить концентрацию гидроксид - ионов (моль/л) и рН раствора, в 1 л которого содержится 3,5 г NH4OH.
60. рН раствора H2SO4 равен 6. Рассчитать молярность и концентрацию гидроксид - ионов (моль/л) в данном растворе (a=1).
61. В каком из растворов 0,01М NaOH или 0,01М NH4OH щелочность среды больше? Ответ подтвердить расчетом рН.
62. Сколько граммов КОН находится в состоянии полной диссоциации в 10 л раствора, рН которого равен 11?
63. Сколько граммов НСООН содержится в 0,3 л раствора этой кислоты, имеющей рН = 6? Кд = 1,8∙10-4.
64. Сколько молей уксусной кислоты (Кд=1,8∙10-5) содержится в 1 л раствора, рН которого равен рН 0,1 М раствора угольной кислоты Кд =2,1∙10-4.23
Растворимость труднорастворимых соединений.
Произведение растворимости
65. Записать выражения и вычислить величины ПР, зная концентрацию (моль/л) одного из ионов в насыщенном растворе малорастворимых электролитов:
а) MgCO3, [Mg2+] = 1,41∙10-2; б) SnS , [S2-] = 1∙10-14; в) CaCO3, [CO32-] = 6,6∙10-5; г) PbSO4, [Pb2+] = 1,26∙10-4.
66. По произведению растворимости вычислить молярную концентрацию насыщенного раствора: а) сульфида цинка, ПР = 1,6∙10-24; б) гидроксида кобальта (II), ПР = 1,6∙10-18;
23
в) иодида свинца (II), ПР = 1,1∙10-9; г) карбоната кальция, ПР = 3,8∙10 -9; д) гидроксида железа (III), ПР =6,3∙10-38; е) сульфата стронция, ПР = 3,2∙10-7; ж) сульфида меди (I) , ПР = 2,5∙10-48; з) карбоната цинка, ПР = 1,45∙10-11.
67. Во сколько раз растворимость (См,моль/л) Fe(OH)2 в воде больше растворимости Fe(OH)3, если ПР Fe(OH)2=4,8∙10-16, ПРFe(OH)3= 3,8∙10-38?
68. Исходя из произведения растворимости карбоната кальция найти его массу, содержащуюся в 100 мл насыщенного раствора.
69. Вычислить концентрации насыщенных растворов (моль/л и г/л) следующих соединений на основании значений ПР (см. справочные материалы): а) сульфат бария; б) гидроксида кадмия; в) сульфида железа (II); г) карбоната кобальта (II).
70. Сколько граммов PbSO4 можно растворить в 1 л воды при комнатной температуре, если его ПР составляет 1,6∙10-8?
71. Можно ли приготовить растворы карбоната кальция с концентрациями 0,01М и 5∙10-4 М, если ПР = 3,8∙10-9?
72. Каково содержание ионов кальция в 1 мл насыщенных растворов следующих солей: а) карбоната, ПРCaCO3 = 3,8∙10-9; б) хромата, ПРCaCrO4 = 7,1∙10-4; в) фторида, ПРCaF2 = 4∙10-11, г) сульфида, ПРCaS= 1,3∙10-8, д) сульфата, ПРCaSO4 = 6,1∙10-5.
73. В 3 л насыщенного раствора PbSO4 содержится 0,115 г соли. Рассчитать концентрацию насыщенного раствора (См ) и произведение растворимости этой соли.
74. Определить концентрацию насыщенного раствора (См ) в моль/л и г/л сульфата бария, если его ПР = 1,08∙10-10.
24
75. Рассчитать концентрацию насыщенного раствора (См ) в моль/л, г/л иодида свинца, если его ПР =8,7∙10-9.
76. Рассчитать концентрацию насыщенного раствора (См, моль/л) хлорида свинца и концентрацию его ионов в насыщенном растворе, если ПР = 1,7×10-5.
77. Произведение растворимости фторида кальция равно 4×10-11. Во сколько раз изменится концентрация ионов кальция в насыщенном растворе CaF2, если увеличить концентрацию ионов фтора [F-] в 10 раз?
78. Можно ли растворить 0,01 г PbCl2 в 0,5 л воды, если его ПР= 1,7×10-5?
79. Можно ли растворить 0,01 г CaCO3 в 1 л воды, если его ПР =4,8×10-9?
80. Вычислить концентрацию насыщенного раствора (См, моль/л) и ПРAg2CrO4, если в 500 мл воды растворяется 0,0166 г этой соли.
81. Определить молярность и нормальность насыщенного раствора PbI2, если ПР PbI2 = 8,7∙10-9.
82. Во сколько раз концентрация насыщенного раствора (См ) AgCl (ПР =1,78∙10-10) больше концентрации насыщенного раствора Ag2S
( ПР =2,0∙10-50)? Рассчитать концентрацию [Ag+] в этих растворах.
83. Какая из солей более растворима : MgCO3 (ПР = 2,1∙10-5) или MgF2
(ПР=6,5∙10-9)? Чему равна концентрация ионов магния (моль/л) в насыщенных растворах этих солей?
84. Сколько литров воды потребуется для растворения сульфидов следующих элементов:
а) серебра (I), ПР = 2,0∙10-50; б) ртути (II), ПР = 4∙10-53; в) кадмия (II), ПР = 1,2∙10-28; г) железа (II), ПР = 5,0∙10-18.
25
Гидролиз солей
85. Составьте молекулярные и ионно-молекулярные уравнения гидролиза солей, укажите реакцию среды (кислотность) их водных растворов: а) Na2SO3; б)K2S; в) K2CO3; г) SnCl2; д) Li2S; е) K3PO4; ж) BaS; з); CrCl3; и) Cr(NO3) 3; к) AlCl3.
86. Составьте молекулярные и ионно-молекулярные уравнения гидролиза солей, определите реакцию их водных растворов:
а) ZnCl2; б) NaNO2; в) FeSO4; г) K2CO3; д) AlCl3; е) Ca(CN)2.
87. Cоставьте молекулярные и ионно-молекулярные уравнения гидролиза солей, укажите реакцию среды (кислотность) их водных растворов:
а) (NH4)2S; б) (NH4)2SO3; в) (NH4)3PO4; г) (NH4)2HPO4.
88. Составьте молекулярные и ионные уравнения гидролиза солей:
а) MgCl2; Fe(NO3)3; Na2Se; б) CuCl2; Na3PO4; Al(CH3COO)3;
в) Mn(NO3)2; Na2S; FeCl2; г) Ca(ClO)2; SbCl3; MnSO4;
д) Zn(NO3)2; NaCN; FeCl3; е) Ca(CH3COO)2; MnSO4; SnCl2;
ж) Al2(SO4)3; Li2CO3; Ni(NO3)3; з) Al(NO3)3; ZnSO4; CaS;
и) KCN; Mg(NO3)2; AlCl3; к) Ba(CN)2; Cr2(SO4)3; NaClO;
л) Pb(NO3)2; MnCl2; Ca(CN)2; м) ZnCl2; NH4CN; Na2CO3 .
89. Объясните, почему по обменным реакциям в водном растворе невозможно получить:
а) Fe2(CO3)3 по реакции Fe2(SO4)3 + Na2CO3 ®;
б) Al2S3 по реакции AlCl3 + Na2S ®;
в) Cr2S3 по реакции Cr2(SO4)3 + Na2S ®;
г) Al(CH3COO)3 по реакции AlCl3 + CH3COONa ®;
д) СuCO3 по реакции CuSO4 + Na2CO3 ®;
26
90. При смешении растворов Al2(SO4)3 и K2S в осадок выпадает Al(OH)3. Укажите причину этого и составьте соответствующие молекулярные и ионо-молекулярные уравнения.
91. Какие из солей железа гидролизуются сильнее FeCl2 или FeCl3 и почему? Составьте уравнения гидролиза.
92. У какого раствора рН больше: SnCl2 или SnCl4 (при одинаковых концентрациях)?
Лабораторные работы
Электролитическая диссоциация воды
Дата: 2019-02-25, просмотров: 313.