Химиотерапевтические препараты – это лекарственные вещества, используемые для подавления жизнедеятельности и уничтожения микроорганизмов в тканях и средах больного, обладающие избирательным, этиотропным (действующим на причину) действием.
По направленности действия химиотерапевтические препараты делят на:
1) противопротозойные;
2) противогрибковые;
3) противовирусные;
4) антибактериальные.
По химическому строению выделяют несколько групп химиотерапевтических препаратов:
1) сульфаниламидные препараты (сульфаниламиды) – производные сульфаниловой кислоты. Они нарушают процесс получения микробами необходимых для их жизни и развития ростовых факторов – фолиевой кислоты и других веществ. К этой группе относят стрептоцид, норсульфазол, сульфаметизол, сульфометаксазол и др.;
2) производные нитрофурана. Механизм действия состоит в блокировании нескольких ферментных систем микробной клетки. К ним относят фурацилин, фурагин, фуразолидон, нитрофуразон и др.;
3) хинолоны. Нарушают различные этапы синтеза ДНК микробной клетки. К ним относят налидиксовую кислоту, циноксацин, норфлоксацин, ципрофлоксацин;
4) азолы – производные имидазола. Обладают противогрибковой активностью. Ингибируют биосинтез стероидов, что приводит к повреждению наружной клеточной мембраны грибов и повышению ее проницаемости. К ним относят клотримазол, кетоконазол, флуконазол и др.;
5) диаминопиримидины. Нарушают метаболизм микробной клетки. К ним относят триметоприм, пириметамин;
6) антибиотики – это группа соединений природного происхождения или их синтетических аналогов.
химиотерапевтический индекс - показатель широты терапевтического действия химиотерапевтического средства, представляющий собой отношение его минимальной эффективной дозы к максимальной переносимой.
Химиотерапевтический индекс (chemotherapeutic index) [греч. chemeia — химия и therapeia — забота, уход, лечение; лат. index — указатель, показатель] — величина, выражающая отношение максимально переносимой (толерантной) или 50 % дозы химиотерапевтического средства к его минимальной (или 50 %) лечебной или ингибирующей (микробоцидной, микробостатической) дозе, или наоборот. В первом варианте величина Х.и. должна быть больше 3. Постулируется (с рядом оговорок), что чем выше Х.и., тем эффективнее действие препарата. Напр., высокий Х.и. присущ пенициллинам, которые нетоксичны даже при больших концентрациях.
70. Антибиотики. Классификация антибиотиков по источникам получения и спектру действия. Механизм действия антибиотиков. Побочные действия антибиотиков на организм. Методы определения чувствительности микробов к антибиотикам.
Для определения чувствительности бактерий к антибиотикам (антибиотикограммы) обычно применяют:
• Метод диффузии в агар. На агаризованную питательную среду засевают исследуемый микроб, а затем вносят антибиотики. Обычно препараты вносят или в специальные лунки в агаре, или на поверхности посева раскладывают диски с антибиотиками («метод дисков»). Учет результатов проводят через сутки по наличию или отсутствию роста микробов вокруг лунок (дисков). Метод дисков — качественный и позволяет оценить, чувствителен или устойчив микроб к препарату.
• Методы определения минимальных ингибирующих и бактерицидных концентраций, т. е. минимального уровня антибиотика, который позволяет in vitro предотвратить видимый рост микробов в питательной среде или полностью ее стерилизует. Это количественные методы, которые позволяют рассчитать дозу препарата, так как концентрация антибиотика в крови должна быть значительно выше минимальной ингибирующей концентрации для возбудителя инфекции. Введение адекватных доз препарата необходимо для эффективного лечения и профилактики формирования устойчивых микробов.
Есть ускоренные способы, с применением автоматических анализаторов.
Определение чувствительности бактерий к антибиотикам методом дисков. Исследуемую бактериальную культуру засевают газоном на питательный агар или среду АГВ в чашке Петри.
Среда АГВ: сухой питательный рыбный бульон, агар-агар, натрий фосфат двузамещенный. Среду готовят из сухого порошка в соответствии с инструкцией.
На засеянную поверхность пинцетом помещают на одинаковом расстоянии друг от друга бумажные диски, содержащие определенные дозы разных антибиотиков. Посевы инкубируют при 37 °С до следующего дня. По диаметру зон задержки роста исследуемой культуры бактерий судят о ее чувствительности к антибиотикам.
Для получения достоверных результатов необходимо применять стандартные диски и питательные среды, для контроля которых используются эталонные штаммы соответствующих микроорганизмов. Метод дисков не дает надежных данных при определении чувствительности микроорганизмов к плохо диффундирующим в агар полипептидным антибиотикам (например, полимиксин, ристомицин). Если эти антибиотики предполагается использовать для лечения, рекомендуется определять чувствительность микроорганизмов методом серийных разведений.
Определение чувствительности бактерий к антибиотикам методом серийных разведений. Данным методом определяют минимальную концентрацию антибиотика, ингибирующую рост исследуемой культуры бактерий. Вначале готовят основной раствор, содержащий определенную концентрацию антибиотика (мкг/мл или ЕД/мл) в специальном растворителе или буферном растворе. Из него готовят все последующие разведения в бульоне (в объеме 1 мл), после чего к каждому разведению добавляют 0,1 мл исследуемой бактериальной суспензии, содержащей 106—107 бактериальных клеток в 1 мл. В последнюю пробирку вносят 1 мл бульона и 0,1 мл суспензии бактерий (контроль культуры). Посевы инкубируют при 37 °С до следующего дня, после чего отмечают результаты опыта по помутнению питательной среды, сравнивая с контролем культуры. Последняя пробирка с прозрачной питательной средой указывает на задержку роста исследуемой культуры бактерий под влиянием содержащейся в ней минимальной ингибирующей концентрации (МИК) антибиотика.
Оценку результатов определения чувствительности микроорганизмов к антибиотикам проводят по специальной готовой таблице, которая содержит пограничные значения диаметров зон задержки роста для устойчивых, умеренно устойчивых и чувствительных штаммов, а также значения МИК антибиотиков для устойчивых и чувствительных штаммов.
К чувствительным относятся штаммы микроорганизмов, рост которых подавляется при концентрациях препарата, обнаруживаемых в сыворотке крови больного при использовании обычных доз антибиотиков. К умеренно устойчивым относятся штаммы, для подавления роста которых требуются концентрации, создающиеся в сыворотке крови при введении максимальных доз препарата. Устойчивыми являются микроорганизмы, рост которых не подавляется препаратом в концентрациях, создаваемых в организме при использовании максимально допустимых доз.
Определение антибиотика в крови, моче и других жидкостях организма человека. В штатив устанавливают два ряда пробирок. В одном из них готовят разведения эталонного антибиотика, в другом — исследуемой жидкости. Затем в каждую пробирку вносят взвесь тест-бактерий, приготовленную в среде Гисса с глюкозой. При определении в исследуемой жидкости пенициллина, тетрациклинов, эритромицина в качестве тест-бактерий используют стандартный штамм S. aureus, а при определении стрептомицина — Е. coli. После инкубирования посевов при 37 °С в течение 18—20 ч отмечают результаты опыта по помутнению среды и ее окрашиванию индикатором вследствие расщепления глюкозы тест-бактериями. Концентрация антибиотика определяется умножением наибольшего разведения исследуемой жидкости, задерживающей рост тест-бактерий, на минимальную концентрацию эталонного антибиотика, задерживающего рост тех же тест-бактерий. Например, если максимальное разведение исследуемой жидкости, задерживающее рост тест-бактерий, равно 1 :1024, а минимальная концентрация эталонного антибиотика, задерживающего рост тех же тест-бактерий, 0,313 мкг/мл, то произведение 1024- 0,313=320 мкг/мл составляет концентрацию антибиотика в 1 мл.
Определение способности S . aureus продуцировать бета-лактамазу. В колбу с 0,5 мл суточной бульонной культуры стандартного штамма стафилококка, чувствительного к пенициллину, вносят 20 мл расплавленного и охлажденного до 45 °С питательного агара, перемешивают и выливают в чашку Петри. После застывания агара в центр чашки на поверхность среды помещают диск, содержащий пенициллин. По радиусам диска петлей засевают исследуемые культуры. Посевы инкубируют при 37 °С до следующего дня, после чего отмечают результаты опыта. О способности исследуемых бактерий продуцировать бета-лакта-мазу судят по наличию роста стандартного штамма стафилококка вокруг той или другой исследуемой культуры (вокруг диска).
Как и всякие лекарственные средства, практически каждая группа антимикробных химиопрепаратов может оказывать побочное действие, причем и на макроорганизм, и на микробы, и на другие лекарственные средства.
Осложнения со стороны макроорганизма
Наиболее частыми осложнениями антимикробной химиотерапии являются:
Токсическое действие препаратов. Как правило, развитие этого осложнения зависит от свойств самого препарата, его дозы, способа введения, состояния больного и проявляется только при длительном и систематическом применении антимикробных химиотерапевтических препаратов, когда создаются условия для их накопления в организме. Особенно часто такие осложнения бывают, когда мишенью действия препарата являются процессы или структуры, близкие по составу или строению к аналогичным структурам клеток макроорганизма. Токсическому действию антимикробных препаратов особенно подвержены дети, беременные, а также пациенты с нарушением функций печени, почек.
Побочное токсическое влияние может проявляться как нейротоксическое (например, гликопептиды и аминогликозиды оказывают ототоксическое действие, вплоть до полной потери слуха за счет воздействия на слуховой нерв); нефротоксическое (полиены, полипептиды, аминогликозиды, макролиды, гликопептиды, сульфаниламиды); общетоксическое (противогрибковые препараты — полиены, имидазолы); угнетение кроветворения (тетрациклины, сульфаниламиды, левомицетин/хлорамфеникол, который содержит нитробензен — супрессор функции костного мозга); тератогенное [аминогликозиды, тетрациклины нарушают развитие костей, хрящей у плода и детей, формирование зубной эмали (коричневая окраска зубов), левомицетин/хлорамфеникол токсичен для новорожденных, у которых ферменты печени не полностью сформированы («синдром серого ребенка»), хинолоны — действуют на развивающуюся хрящевую и соединительную ткани].
Предупреждение осложнений состоит в отказе от противопоказанных данному пациенту препаратов, контроле за состоянием функций печени, почек и т. п.
Дисбиоз (дисбактериоз). Антимикробные химиопрепараты, особенно широкого спектра, могут воздействовать не только на возбудителей инфекций, но и на чувствительные микроорганизмы нормальной микрофлоры. В результате формируется дисбиоз, поэтому нарушаются функции ЖКТ, возникает авитаминоз и может развиться вторичная инфекция (в том числе эндогенная, например кандидоз, псевдомембранозный колит). Предупреждение последствий такого рода осложнений состоит в назначении, по возможности, препаратов узкого спектра действия, сочетании лечения основного заболевания с противогрибковой терапией (например, назначением нистатина), витаминотерапей, применением эубиотиков и т. п.
Отрицательное воздействие на иммунную систему. К этой группе осложнений относят прежде всего аллергические реакции. Причинами развития гиперчувствительности может быть сам препарат, продукты его распада, а также комплекс препарата с сывороточными белками. Возникновение такого рода осложнений зависит от свойств самого препарата, от способа и кратности его введения, индивидуальной чувствительности пациента к препарату. Аллергические реакции развиваются примерно в 10 % случаев и проявляются в виде сыпи, зуда, крапивницы, отека Квинке. Относительно редко встречается такая тяжелая форма проявления аллергии, как анафилактический шок. Такое осложнение чаще дают бета-лактамы (пенициллины), рифамицины. Сульфаниламиды могут вызвать гиперчувствительность замедленного типа. Предупреждение осложнений состоит в тщательном сборе аллергоанамнеза и назначении препаратов в соответствии с индивидуальной чувствительностью пациента. Кроме того, антибиотики обладают некоторым иммунодепрессивным действием и могут способствовать развитию вторичного иммунодефицита и ослаблению напряженности иммунитета.
Эндотоксический шок (терапевтический). Это явление, которое возникает при лечении инфекций, вызванных грамотрицательными бактериями. Введение антибиотиков вызывает гибель и разрушение клеток и высвобождение больших количеств эндотоксина. Это закономерное явление, которое сопровождается временным ухудшением клинического состояния больного.
Взаимодействие с другими препаратами. Антибиотики могут способствовать потенцированию действия или инактивации других препаратов (например, эритромицин стимулирует выработку ферментов печени, которые начинают ускоренно метаболизировать лекарственные средства разного назначения).
Побочное воздействие на микроорганизмы.
Применение антимикробных химиопрепа-ратов оказывает на микробы не только прямое угнетающее или губительное воздействие, но также может привести к формированию атипичных форм микробов (например, к образованию L-форм бактерий или изменению других свойств микробов, что значительно затрудняет диагностику инфекционных заболеваний) и персистирующих форм микробов. Широкое использование антимикробных лекарственных средств ведет также к формированию антибиотикозависимости (редко) и лекарственной устойчивости — антибиотикорезистентности (достаточно часто).
Антибиотики — химиотерапевтические вещества, продуцируемые микроорганизмами, животными клетками, растениями, а также их производные и синтетические продукты, которые обладают избирательной способностью угнетать и задерживать рост микроорганизмов, а также подавлять развитие злокачественных новообразований.
За тот период, который прошел со времени открытия П.Эрлиха, было получено более 10 000 различных антибиотиков, поэтому важной проблемой являлась систематизация этих препаратов. В настоящее время существуют различные классификации антибиотиков, однако ни одна из них не является общепринятой.
В основу главной классификации антибиотиков положено их химическое строение.
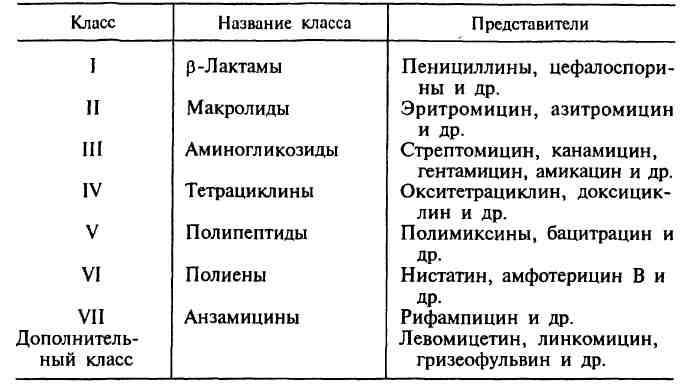
Наиболее важными классами синтетических антибиотиков являются хинолоны и фторхинолоны (например, ципрофлоксацин), сульфаниламиды (сульфадиметоксин), имидазолы (метронидазол), нитрофураны (фурадонин, фурагин).
По спектру действия антибиотики делят на пять групп в зависимости от того, на какие микроорганизмы они оказывают воздействие. Кроме того, существуют противоопухолевые антибиотики, продуцентами которых также являются актиномицеты. Каждая из этих групп включает две подгруппы: антибиотики широкого и узкого спектра действия.
Антибактериальные антибиотики составляют самую многочисленную группу препаратов. Преобладают в ней антибиотики широкого спектра действия, оказывающие влияние на представителей всех трех отделов бактерий. К антибиотикам широкого спектра действия относятся аминогликозиды, тетрациклины и др. Антибиотики узкого спектра действия эффективны в отношении небольшого круга бактерий, например полет-миксины действуют на грациликутные, ванкомицин влияет на грамположительные бактерии.
В отдельные группы выделяют противотуберкулезные, противолепрозные, противосифилитические препараты.
Противогрибковые антибиотики включают значительно меньшее число препаратов. Широким спектром действия обладает, например, амфотерицин В, эффективный при кандидозах, бластомикозах, аспергиллезах; в то же время нистатин, действующий на грибы рода Candida, является антибиотиком узкого спектра действия.
Антипротозойные и антивирусные антибиотики насчитывают небольшое число препаратов.
Противоопухолевые антибиотики представлены препаратами, обладающими цитотоксическим действием. Большинство из них применяют при многих видах опухолей, например митоми-цин С.
Действие антибиотиков на микроорганизмы связано с их способностью подавлять те или иные биохимические реакции, происходящие в микробной клетке.
В зависимости от механизма действия различают пять групп антибиотиков:
1. антибиотики, нарушающие синтез клеточной стенки. К этой группе относятся, например, β-лактамы. Препараты этой группы характеризуются самой высокой избирательностью действия: они убивают бактерии и не оказывают влияния на клетки микроорганизма, так как последние не имеют главного компонента клеточной стенки бактерий — пептидогликана. В связи с этим β -лактамные антибиотики являются наименее токсичными для макроорганизма;
2. антибиотики, нарушающие молекулярную организацию и синтез клеточных мембран. Примерами подобных препаратов являются полимиксины, полиены;
3. антибиотики, нарушающие синтез белка; это наиболее многочисленная группа препаратов. Представителями этой группы являются аминогликозиды, тетрациклины, макроли-ды, левомицетин, вызывающие нарушение синтеза белка на разных уровнях;
4. антибиотики — ингибиторы синтеза нуклеиновых кислот. Например, хинолоны нарушают синтез ДНК, рифампицин — синтез РНК;
5. антибиотики, подавляющие синтез пуринов и аминокислот. К этой группе относятся, например, сульфаниламиды.
Источники антибиотиков.
Основными продуцентами природных антибиотиков являются микроорганизмы, которые, находясь в своей естественной среде (в основном, в почве), синтезируют антибиотики в качестве средства выживания в борьбе за существование. Животные и растительные клетки также могут вырабатывать некоторые вещества с селективным антимикробным действием (например, фитонциды), однако широкого применения в медицине в качестве продуцентов антибиотиков они не получили.
Таким образом, основными источниками получения природных и полусинтетических антибиотиков стали:
• Актиномицеты (особенно стрептомицеты) — ветвящиеся бактерии. Они синтезируют большинство природных антибиотиков (80 %).
• Плесневые грибы — синтезируют природные бета-лактамы (грибы рода Cephalosporium и Penicillium ) H фузидиевую кислоту.
• Типичные бактерии — например, эубактерии, бациллы, псевдомонады — продуцируют бацитрацин, полимиксины и другие вещества, обладающие антибактериальным действием.
Способы получения.
Существует три основных способа получения антибиотиков:
• биологический синтез (так получают природные антибиотики — натуральные продукты ферментации, когда в оптимальных условиях культивируют микробы-продуценты, которые выделяют антибиотики в процессе своей жизнедеятельности);
• биосинтез с последующими химическими модификациями (так создают полусинтетические антибиотики). Сначала путем биосинтеза получают природный антибиотик, а затем его первоначальную молекулу видоизменяют путем химических модификаций, например присоединяют определенные радикалы, в результате чего улучшаются противомикробные и фармакологические характеристики препарата;
• химический синтез (так получают синтетические аналоги природных антибиотиков, например хлорамфеникол/левомицетин). Это вещества, которые имеют такую же структуру,
Дата: 2019-02-25, просмотров: 507.