А.эндотермическая реакция
3. Укажите тип реакции:2SO2+O2v2o5→2SO3
А.каталитическая реакция
4. Экзотермическая реакция:
А. Cu(OH)2+H2SO4→CuSO4+2H2O+Q
5. Основатель квантовой меаникик (процесс названный в его честь):
А. В.Паули
6. Дайте определение катализаторам:
А. вещества, ускоряющие химические реакции, но вконце остающиеся химическими неизмененными
7. Ингибиторы – это
А. вещества, замедляющие химические реакции
8. Каталитическая реакция
А. реакции, протекающие с помощью катализаторов
9. В организме роль катализаторов играют:
А. ферменты, гармоны, витамины
10. Ученый, который исследовал кинетические реакции:
А. Вант-Гофф
11. Основатель учения термохимии:
А. А.Лавуазье
12. C6H5OH+7O2→продукты, образующиеся в результате реакции:
А. 6CO2+3H2O+Q
13. 3C6H5OH+FeCl3→продукты, образующиеся в результате реакции:
А. (C6H5O)3Fe+3HCl
14. Эндотермическая реакция?
А. 2HgO=2Hg+O2-Q
15. Типы химических реакции (по составу и количеству реагентов и продуктов):
А. разложение, соединение, обмен, замещение
16. Не вступают в реакцию обмена:
А. простые вещества
17. Тип реакции Fe+CuCl2=FeCl2+Cu
А. замещение
18. Тип реакции: HNO3+KOH=KNO3+H2O
А. обмен
19.Определите тип реакции: сульфат меди+железо:
А. замещение
20. Определите тип реакции: аммиак+кислота
А. соединение
21. Химическая реакция:
А. горение полиэтилена
22. Определите тип реакции: В хлорид ртути поместили кусочек меди
А. замещение
23. Типы химических реакции (по составу и количеству реагентов и продуктов):
А. 4
24. Термохимическая реакция:
А. реакция, протекающая с выделением или поглощением теплового эффекта
25. Реакция, протекающая с выделением энергии (тепла)
А. экзотермическая
26. Вещества, которые замедляют скорость химических реакции:
А. ингибиторы
27. Процесс катализа, где катализатор и реагирующие вещества являются в одном агрегатном состоянии:
А. гомогенная
28. Процесс катализа, где катализатор и реагирующие вещества являются в разных агрегатных состояниях:
А. гетерогенные
29. Прибор, измеряющий интенсивность цвета в какой-либо цветовой модели:
А. колориметр
30. Виды термохимических реакции:
А. 2
31. Растворы состоят:
А. из растворителя и растворенного вещества
32. Общая формула определения массовой доли раствора:
А. W= 
33. Виды растворов:
А. тонкодисперсные и грубодисперсные
34. Ионы образовавщиеся в результате диссоциации MgCl2
A. Mg2++2Cl-
35. Ученый, открывший закон пропорциональной зависимости объема газа от абсолютной температуры при постоянном давлении:
А. Гей-Люссак
36. В результате диссоциации какого вещества образуется ион SO42-
А. (NH4)2SO4
37. В результате диссоциации какого вещества образуется ион NO3-
A. NaNO3
38. Осмос это:
А. процесс односторонней диффузии через полупроницаемую мембрану молекул растворителя в сторону большей концентраци растворенного вещества из объема с меньшей концентрацией растворенного вещества
39. Ученый, изучивший выделение и поглошение теплоты при образовании растворов:
А. М.Ломоносов
40. Растворы состоят:
А. из растворителя и растворенного вещества
41. Элемент который придает красный цвет крови:
А. гемы которые имеют атомы ІІ валентного железа в гемоглобине
42. Химический символ кальция
А. Са
43. Формула оксида кальция:
А. СаО
44. Оксид с элементом валентностью VI:
А. CrO3
45. Элемент с переменной валентностью:
А. Cr
46. Э→ЭО→ЭО2 ряд который соответствует схеме:
А. С→СО→СО2
47. Неправильное название соли:
А. Fe(NO3)2-нитрит железа (ІІ)
48. 5Н2 что означает:
А. пять молекула водорода
49. Биогенные элементы:
А. элементы, входящие в состав живого организма
50. Виды биогенных элементов:
А. макро, микро, ультрамикро элементы
51. О, С, N, H – это:
А. макроэлементы
52. Роль Na и K в организме человека:
А. регулирует обмен веществ
53. Сели у человека вес 70кг, то в организме масса Na и K:
А. Na 60г – К 160г
54. Недостаток Na в организме приводит:
А. к нарушению нервной системы
55. Недостаток йода в организме приводит к болезни:
А. щитовидной железы
56. Биогенный элемент (металл) присутствует в костях и зубах:
А. кальций
57. Металл который придает крови красный цвет:
А. железо
58. Жизненоважный элемент, который входит в состав морской капусты, а также ламинарии:
А. йод
59. Недостатке какого элемента приводит к кариесу:
А. фтор
60. Метал VIIIB группы который распространен в природе, в наибольшем количетсве:
А. железо
61. Какой орбиталью заканчивается биогенные элементы:
А. S, P, d
62. Валентность биогенного элемента углерода «С»
А. ІІ, ІV
63. Виды биогенных элементов:
А. І
65. Недостаток натрия в организме:
А. А.Вернер
67. Комплексные соединения:
А. хлорид аммония
69. Название формулы: K[Pt(NH3)Cl3]
А. комплексообразователь
71. Внешняя сфера: Na[Al(OH)4]
А. Na
72. Название лиганды: [Cu(H2O)4]SO4•H2O
A. H2O
73. Название комплексного соединения: K[Pt(NH3)Cl3]
А. внешняя сфера
75. Название комплексного соединения: K2[Al(C2O4)3]
А. лиганда
79. Название лиганд которые встречаются в виде ионов:
А. хлоро, циано, сулбфито
80. Комплексное соединение с лигандой: NH3
А. [Cu(NH3)4]SO4
81. Комплексообразователь: Na[Al(OH)4]
A. Na
82. Координационное число: [Cu(H2O)4]SO4 H2O
А. 4
83. Элемент внешней сферы: K[Pt(NH3)Cl3]
А. калий
84. Название формулы: K3[Al(C2O4)3]
А. Ф.Кекуле
87. Реакция ОВР: ?
А. С0+О2→С+4О2-2
88. Металл у которого в соединениях степень окисления +3:
А. алюминий
89. Чему равна степень оксиления, если атом не принимает и не отдает электроны:
А. 0
90. К чему равна степень окисления у щелочных металлов (Na, Li, K, Rb, Cs)
А. +1
91. К чему степень окисления у щелочноземельных металлов (Be, Mg, Ca, Sr, Ba, Ra)
А. +2
92. Чему равна степень окисления бора и алюминия:
А. +3
93. Чему равна степень окисления кислорода в пероксидах. H2O2 Na2O2 BaO2
А. -1
94. Степень окисления серы в соединениях: Al2(SO4)3
А. +6
95. Назовите реакцию в которых частицы (атомы, молекулы, ионы) одних реагентов проявляют окислительные, других-восстановительные свойства:
А. окисление
99. S0+2e-=S2- название процесса:
А. восстановление
100. Назовите вещества, атомы или ионы которых присоединяют электроны:
А. восстановитель
101. Самая низкая степень окисления Cl-
А. -1
102. Общая сумма коэффициентов в схеме ОВР: H2O2+KJ+H2SO4→J2+K2SO4+H2O
А. 8
103. Степень окисления фтора NaF
А. -1
104. Степень окисления хрома: K2Cr2O7
А. +6
105. Вещества, атомы или ионы которых присоединяют электроны называются – восстановителями, а как называются вещества атомы или ионы отдают электроны:
А. окислитель
106. Ученый, который открыд теорию окислительно-восстановительных реакции:
А. 0
109. Степень окисления алюминия:
А. +3
110. Чему равна степень окисления кислорода в пероксидах: H2O2 Na2O2 BaO2
А. -1
111. Степень окисления серы в соединениях: Al2(SO4)3
А. +6
112. Назовите реакцию в которых частицы (атомы, молекулы, ионы) одних реагентов проявляют окислительные, других-восстановительные свойства:
А. адсорбция
114. Процесс синерезис:
А. выделение воды от геля
115. Пример синерезиса:
А. сыворотка с маслом
116. Лекарственное вещество употребляемое в медицине:
А. активированный уголь
117. 1 грамм активированного угля может адсорбировать сколько м2:
А. 300-1000
118. Процесс поглошение поверхностным слоем:
А. десорбция
119. Граница адсорбции:
А. Б
120. Ученый, который предложил применять активированный уголь от ядовитых газов:
А. Н.Д.Зелинский
121. Ученый, определивший адсорбирующее свойтсво уголя и применивший для очистки этилового спирта:
А. Т.Е.Ловиц
122. В результате использования активированного уголя придкмали:
А. противогаз
123. Приведите примеры на вид растворов «эмульсия»:
А. вода и соль
125. Приведите примеры на вид растворов «коллоидные»:
А. яичный белок
126. Назовите процесс.
А. явление осмоса
127. Истинные растворы.
А. навыподает в осадок
128. Характерные свойтсва коллоидных растворов:
А. прзрачность
129. Назовите вещество в коллоидной химии с дисперсной системой с жидкой или газообразной дисперсной системой:
А. гель
130. Уменьшение поверхностного натяжения возможно за счет притяжения к поверхности молекул из окружающей среды. Стремление к сокращению площади поверхности коллоидных частиц выражается в самопроизводном слипании мелких частиц в более крупные. Это явление называется:
А. коагуляция
131. Пример геля:
А. мармелад
132. Диаметр истинных растворов:
А. меньше 1 нм-ра
133. Размеры частиц в коллоидных растворах:
А. 1-100 нм
134. Оптический эффект, рассеивание света при прохождении светового пучка через оптически неоднородную среду. Обычно наблюдается в виде светящегося конуса, видимого на темном фоне:
А. эффект тиндаля
135. Реакция для получения ВМС:
А. полипропилен
138. (-СН2-Сн2-)n полимер который состоит из этого мономера:
А. полиэтилен
139. Полиэтилен применяется:
А. в качестве электроизоляционного материала, изготовление пленок в качестве упаковочного материала, изготовление легкой небьющейся посуды, шлангов и трубопроводов для химической промышленности:
140. Назовите группу атомов чередующихся в цепи с определенной периодичностью:
А. чередующися звено
141. Число, которое показывает сколько мономера входит в макромолекулу:
А. n степень полимеризации
142. Виды высокомолекулярных соединении (ВМС)
А. целлюлоза
144. Вид пластмассы (легкий, теплосохраняемый, звукоизолирующий материал):
А. капрон
147. Ученый, который впервые синтезировал синтетическую каучук:
А. С.В.Лебедев
148. Полимеры –
А. сложные вещества с большими молекулярными массами, молекулы которых состоят из большого числа регулярно или нерегулярно повторяющихся структурных единиц одного или нескольких типов.
149. По структуре макромолекулы полимеров могут быть:
А. С.В.Лебедев
ІІ-ой семестр
А. А.М.Бутлеров
7. Валентность углерода в органических соединениях:
А. IV
8. Химические формулы, в которых отображен порядок соединения атомов в молекулах:
А. структурнаяформула
9. -С-С-С-С-тип цепи:
А. прямая
10.Какое вещество соответствует названию: 2 - хлор-3-метилпентан:
А. С –С(Cl) – С(CH3) – С – С
11.Вещества, сходные по строению, а следовательно, и по химическим свойствам и отличающиеся друг от друга по составу на одну или несколько групп – СН2, называются:
А. гомологами
12. Вещества, имеющие одинаковый состав, но различное химическое строение и обладающие потому разными свойствами, называются:
А. изомерами
13. Этанол и диметиловый эфир относятся какому виду изомерии:
А. межклассовая
14.Первый представитель алканов:
А. метан
15. Если в молекуле нет циклической цепи атомов углерода:
А. ациклические
16.Если в молекуле имеется циклическая углеродная цепь:
А. карбоциклические
17. Если гетероатомы расположены в циклической цепи, то соединение называется:
А. гетероциклическим
18. К ациклическим углеводородам относятся:
А.предельные и непредельные
19. Карбоциклическим углеводородам относятся:
А. алициклические и ароматические
20. Предельные и непредельные углеводороды относятся:
А. ациклическим
21. К насыщенным углеводородам относятся:
А. алканы
22. Связь между атомами углерода в насыщенных углеводородах:
А. одинарные
23.Какие углеводороды называются алканами?
А. Предельные УВ с общей формулой СnH2n+2
24.Какие вещества называются гомологами?
А.Олефины
26.Реакция присоединения водорода называется:
А. Гидрированием
27.Частицы с одним неспаренным электроном, обладающие высоким запасом энергии, называются:
А. Радикалами
28. Формула этана:
А. С2Н6
29. Формула пропана:
А. С3Н8
30.Суффикс алканов:
А. -ан
31.Суффикс алкилов:
А.-ил
32.Символ радикала:
А. R
33.пента это:
А. «пять»
34.гекса это:
А. «шесть»
35. Алканам свойственна реакция:
А. замещение
36.Гидрирование:
А. + Н2
37. Гидратация:
А.+Н2О
38. Горение:
А.+ О2
39. Галогенирование:
А.+СІ2
40.УВ с замкнутой цепью:
А. Циклоалканы
41. Общая формула циклоалканов:
А.СnH2n
42.СnH2n эта формула:
А. циклоалканов
43. Формула циклопропана:
А. С3Н6
44.Алкены это-
А. Соединения, в молекулах которых имеется одна двойная связь между атомами углерода;
45.Первый член гомологического ряда:
А.этен или этилен
46. Формула этена:
А. С2Н4
Реакционная способность спиртов и фенолов.
47. Какой радикал у одноатомных спиртов?
А. OH
48. Какой суффикс у одноатомных спиртов?
А. ол
49. Химическая формула метанола.
А. CH3OH
50. Общая формула одноатомных спиртов.
А. CnH 2n+1 OH
Реакционная способность тиолов и аминов.
51.С этиламином реагирует
А. Н2О
52.Анилин не используется для получения
А. Полиэтилена
53.При взаимодействии анилина с избытком бромной воды образуется
А. 2,4,6-триброманилин
54. На схеме изображено строение:
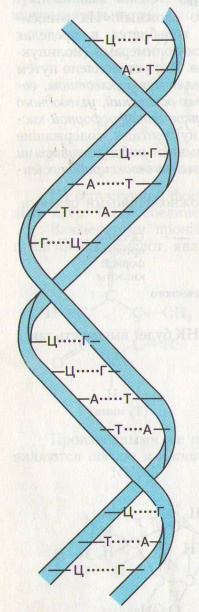
А. Схема строения ДНК.
55. Реакцию восстановления нитробензола в 1842 году открыл:
А. Н. Н. Зинин.
56. Амины обладают:
А. основными свойствами.
57. Аминокислоты реагируют со спиртами с образованием
А. сложных эфиров.
58.Формула анилина
А. C6H5NH2
59.Кроме углекислого газа при горении метиламина образуется
А. азот и вода
60.Наиболее выражены основные свойства
А. (CH3)2NH
61.Если общая формула органических веществ 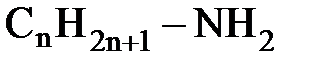 , то это класс
, то это класс
А. аминов
62.Формула диметилэтиламина
А. CH 3 - N - CH 3
I
C 2 H 5
63.Не относится к аминам
O
//
А. CH 3 - C
\
NH 2
64.Функциональная группа первичных аминов
А. –NH2
65. При восстановлении нитросоединения образуется
А. амин
66.При взаимодействии солей аминов со щелочами образуются
А. амины
67.Формула амина
А. C3H7NH2
68.Промышленный способ получения анилина
А. Реакция Зинина
69.Для анилина характерна реакция
А. C6H5NH2+ HCl→
70.Амин - это
А. Азотсодержащее органическое соединение
71.Название вещества CH3─CH─CH2─CH3
│
NH2
А. 2-аминобутан
72. Анилин образует соль с
А. HCl
73.При полном сгорании метиламина на воздухе образуется
А. N2,H2O,CO2
74.С этиламином реагирует
А. HNO3
75.Аминокислоты не могут реагировать:
А. С предельными углеводородами.
76.Органические вещества с общей формулой R-CH-COOH относятся к
|
NH2
А. Аминокислотам.
77.Аминокислоты не взаимодействуют с
А. Циклоалканами.
78.Формула аминокислоты:
А . HOOC – CH2 –CH – COOH
|
NH 2
79. На рисунке изображена структурная формула молекулы какого вещества?
А. 5
81.Биполярный ион аминокислоты образуется при:
А. Внутренней нейтрализации
82.Аминокислоты – амфотерные соединения, так как:
А.амины
86. Путем добавления какого окончания к названию радикалов образуется названия аминов:
А.–амин
87. Промышленный способ получения анилина основан на реакции
А.восстановления (реакция Зинина)
88. Анилин взаимодействует с веществами:
А.Br2
89. В отличиHYPERLINK https://testing.mc.tarazinfo.kz/mc/testcreator/forms/edit_test_html?id_subject=103&id_unit=1424&id_theme=4517&id_quest=117862е HYPERLINK "https://testing.mc.tarazinfo.kz/mc/testcreator/forms/edit_test_html?id_subject=103&id_unit=1424&id_theme=4517&id_quest=117862"от других органических соединений при возгорании аминов выделяется:
А. азот
90. В зависимости от того, сколько атомов водорода замещено аминогруппой различают амины:
А.первичные, вторичные, третичные
91. Как называется группа –NH2-?
А.аминогруппа
92. Физические свойства анилина?
А.все ответы верны
93. Амины - производные аммиака, в котором атомы водорода замещены на
А. углеводородные радикалы.
94. Формула анилина
А. C6H5NH2
95. Физические свойства аминокислот
А.амфотерные.
97. Какую аминокислоту применяют при нервных заболеваниях:
А.глицин
Альдегиды и кетоны.
98. Укажите окончание альдегидов
А. аль
99. Среди приведенных соединений выберите альдегиды.
А. СH3COH
100. Карбонильной называется группа
А. COH
101. Какие радикалы содержат альдегиды.
А.Органические
102. С какого альдегида начинается гомологический ряд.
А. метаналь
103. Сколько радикалов входит в состав кетонов.
А. 2
104. Как называется функциональная группа альдегидов:
А.карбонил
Карбоновые и дикарбоновые кислоты и их свойства.
105. Формула муравьиной кислоты.
А. HCOOH
106.В схеме изображено:
А. COOH
108. При кислотном гидролизе этилацетата образуются
А.карбоксил
114.Назовите карбоновую кислоту со следующей схематической формулой:
О
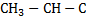
І \
С2Н5 ОН
А. карбоксил
Гетерофункциональные органические соединения. Гетерофункциональные производные карбоновых кислот.
117. Пептидная группа атомов:
А. - С - N -О Н.
118. Связь между атомами углерода и азота:
А.пептидная,
119. Гетероциклическими называются такие соединения, в циклах которых наряду с атомами углерода содержатся и
А. атомы другие элементов.
120. В состав гемоглобина и хлорофилла входят:
А. производные пиррола.
121. Ядро пиридина содержится в молекулах витамина
A.PP.
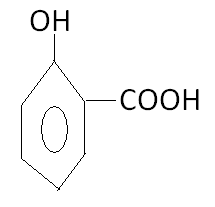
122. Название вещества
А. салициловая кислота
123. Формула аспирина
| а. |
124. Ацетилсалициловая кислота применяется в медицине в качестве
А.окси-уксусная кислоты
126. Кальциевая соль щавелевой кислоты применяется в медицине для количественного определения…
А.Са в организме
127. Гетерофункциональные органические вещества
А. Аминокислоты.
132.Вторичная структура белка обусловлена связью:
А. Водородной.
133. Белки никогда не содержат в своем составе элемент
А. РЬ
134.Группа атомов – CO – NH – входит в состав
А. Белков
135.В результате полного гидролиза белков образуются
А. Аминокислоты.
136.При нагревании белков в растворах кислот и щелочей происходит:
А. Денатурация.
137.Карбоксил и аминогруппа в белках связаны
А.Пептидной связью.
138.Вторичная структура белковой молекулы образуется благодаря
А.Водородным связям
139.Наличие белков в пищевых продуктах можно определить с помощью:
А. HNO3
140.Желтое окрашивание возникает при действии на белок:
А. HNO3
141. Биуретовая реакция
А. Белок + CuSO4 + NaOH
142.Цистеиновая раекция
А.Белок + Pb(CH3COO)2 + NaOH
143. На рисунке изображена структурная формула молекулы, какого молекулярного вещества.
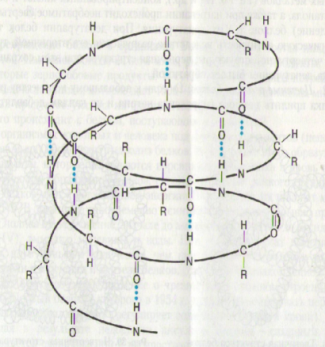
А.водородным связям
Углеводы. Моносахариды, дисахариды. Полисахариды и их химические свойства.
147.Моносахаридом является:
А. Фруктоза
148. Классификация углеводов по составу и строениям:
А. 3
149. Образующие вещества в результате фотосинтеза:
А. глюкоза +кислород
150. Глюкоза относится к какому виду:
А. моносахариды
151. Формула глюкозы
А. С6Н12О6
152. Глюкоза как спирт реагирует:
А. с Cu(OH)2
153. Цвет глюкозы:
А.бесцветное
154. Изомер глюкозы
А. фруктоза
155. Дисахарид:
А. Сахарозам
156. Изомер сахарозы
А. Лактоза
193. В результате гидролиза сахароза образует
А. глюкоза+фруктоза
157. Крахмал – это
А.природный полимер
158. В Таразе сахарный завод был открыт:
А.1936 г
159. Структура молекулы крахмала:
А. Разветвленная
160. Окончание углеводов:
А. – оза
А.эндотермическая реакция
3. Укажите тип реакции:2SO2+O2v2o5→2SO3
А.каталитическая реакция
4. Экзотермическая реакция:
А. Cu(OH)2+H2SO4→CuSO4+2H2O+Q
5. Основатель квантовой меаникик (процесс названный в его честь):
А. В.Паули
6. Дайте определение катализаторам:
А. вещества, ускоряющие химические реакции, но вконце остающиеся химическими неизмененными
7. Ингибиторы – это
Дата: 2019-02-25, просмотров: 356.