Тепловой эффект химической реакции взаимодействия горючего вещества с кислородом с образованием продуктов полного окисления называется теплотой сгорания. Теплота сгорания играет большую роль при оценке пожарной опасности веществ. Теплоту сгорания можно рассчитать, используя следствие из закона Гесса:
тепловой эффект реакции равен разности между суммой теплот образования продуктов реакции и суммой теплот образования реагентов с учётом их стехиометрических коэффициентов.
В практике пожарного дела под продуктами реакции следует понимать продукты горения, а под реагентами - горючее вещество и окислитель. Следовательно:
D 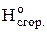 = S(ni ×
= S(ni × 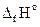 )пг- S(nj ×
)пг- S(nj × 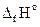 )гв , кДж/моль,
)гв , кДж/моль,
где
ni и nj – стехиометрические коэффициенты в уравнении реакции горения;
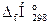 - стандартные теплоты образования веществ, кДж/моль (Приложение 2 табл. 3).
- стандартные теплоты образования веществ, кДж/моль (Приложение 2 табл. 3).
Теплота образования простых веществ (например, С, S, N2, O2) равна нулю.
Теплота сгорания – теплота, выделяемая при полном сгорании единицы массы, 1 моль или 1 м3 вещества, выраженная в кДж/кг, кДж/моль, кДж/м3. Теплота сгорания численно равна энтальпии сгорания (тепловому эффекту реакции горения), но имеет обратный знак.
Различают низшую и высшую теплоту сгорания. При расчёте низшей теплоты сгорания (Qн) считают, что образующаяся в качестве продуктов горения вода выделяется из зоны реакции в парообразном состоянии. При расчёте высшей теплоты сгорания (Qв), учитывают теплоту фазового перехода пар - вода. Следовательно, высшая теплота сгорания отличается от низшей на величину теплоты конденсации паров воды (Qконд).
Qв= Qн + Qконд
Поскольку в условиях пожара продукты горения имеют температуру, превышающую температуру кипения воды, то в дальнейшем будут приведены методики расчёта низшей теплоты сгорания.
Тепловой эффект реакции, вычисляемый по следствию из закона Гесса, не учитывает теплоту конденсации паров воды, поэтому в этом случае рассчитывается низшая теплота сгорания индивидуальных веществ.
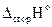 = Qн = S(ni ×
= Qн = S(ni × 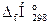 )пг - S(nj ×
)пг - S(nj × 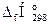 )гв, кДж/моль
)гв, кДж/моль
Методика расчёта низшей теплоты сгорания зависит от химического строения и агрегатного состояния вещества.
Для сложных веществ переменного состава, находящихся в твёрдом и жидком агрегатных состояниях, а также сложных веществ постоянного состава, для которых отсутствует справочное значение теплоты образования, теплоту сгорания рассчитывают по формуле Д.И. Менделеева. В этом случае вычисления проводят с использованием массовых долей (%) элементов в горючем веществе:
Qн = 339,4×w(С) + 1257×w(Н) – 108,9[w(О) + w(N) – w(S)] – 25,1[9×w(Н) + w(W)], кДж/кг
где
w (W) - массовая доля влаги в горючем веществе, %.
w(С), w(Н), w(O), w(S), w(N) - содержание в горючем веществе углерода, водорода, кислорода, серы, азота, масс. %;
Для смеси газов низшая теплота сгорания рассчитывается по формуле:
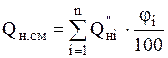 , кДж/м3
, кДж/м3
где
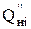 - низшая теплота сгорания i-ого компонента газовой смеси, кДж/м3;
- низшая теплота сгорания i-ого компонента газовой смеси, кДж/м3;
ji – объёмное содержание i-ого компонента газовой смеси, %;
n - число горючих компонентов газовой смеси.
Расчёт адиабатической и действительной температур горения основан на решении уравнения теплового баланса процесса горения.
Qп.г= 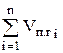 ×
× 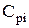 ×Тг
×Тг
где
Qп.г - количество тепла, затраченное на нагрев продуктов горения, кДж/моль, кДж/кг, кДж/м3;
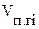 - объём i-го компонента продуктов горения, кмоль/кмоль, м3/кг, м3/м3;
- объём i-го компонента продуктов горения, кмоль/кмоль, м3/кг, м3/м3;
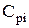 - удельная теплоёмкость i-го компонента продуктов горения при постоянном давлении, кДж/(кмоль×К), кДж/(м3×К)
- удельная теплоёмкость i-го компонента продуктов горения при постоянном давлении, кДж/(кмоль×К), кДж/(м3×К)
Тг - температура горения, К.
Считается, что на практике горение происходит при постоянном давлении, поэтому термин «теплосодержание» можно заменить на термин «энтальпия»:
D 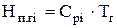 , следовательно,
, следовательно,
Qп.г= 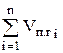 ×D
×D 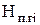
Данное уравнение решается методом последовательных приближений.
Методика расчета низшей теплоты сгорания веществ
по следствию из закона Гесса
1. Составляем уравнение реакции горения вещества в воздухе. По уравнению реакции горения определяем число моль горючего вещества и образовавшихся продуктов горения.
2. По табл. 3 приложения 2 определяем значения теплот образования ( 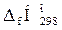 ) горючего вещества и продуктов горения. Теплоты образования простых веществ (например, N2, О2) равны 0.
) горючего вещества и продуктов горения. Теплоты образования простых веществ (например, N2, О2) равны 0.
3. Рассчитываем низшую теплоту сгорания вещества, используя следствие закона Гесса.
Qн = S(ni× 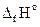 )пг - S(nj×
)пг - S(nj× 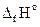 )гв , кДж/моль
)гв , кДж/моль
4. Переводим низшую теплоту сгорания заданного вещества в кДж/кг по формуле:
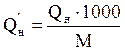 , кДж/кг
, кДж/кг
где
М – молярная масса вещества, г/моль.
5. Переводим низшую теплоту сгорания заданного вещества в кДж/м3 по формуле:
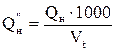 ,кДж/м3
,кДж/м3
где
Vt – объем 1 кмоль газа при заданных условиях, м3/моль
Методика расчета низшей теплоты сгорания веществ
по формуле Д.И. Менделеева
А) Для сложного вещества переменного состава.
Для сложных веществ переменного состава, находящихся в твёрдом и жидком агрегатных состояниях, а также химических соединений, для которых отсутствует справочное значение теплоты образования, теплоту сгорания рассчитывают по формуле Д. И. Менделеева. В этом случае вычисления проводят с использованием массовых долей элементов в горючем веществе:
Qн = 339,4×wС + 1257×wН – 108,9(wО + wN – wS)– 25,1(9×wН + wW), кДж/кг
где
wW - массовая доля влаги в горючем веществе, %.
wС, wН, wO, wS, wN - содержание в горючем веществе углерода, водорода, кислорода, серы, азота, масс. %;
Б) Для индивидуального химического соединения.
1. Рассчитываем молярную массу горючего вещества.
2. Рассчитываем массовую долю элементов в соединении по формуле
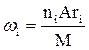 .
.
где
ni и Ari – число атомов и относительная атомная масса i-элемента в молекуле горючего вещества,
М - молярная масса горючего вещества.
3. Подставляем полученные значения в формулу Д.И. Менделеева
Методика расчета адиабатической температуры горения
1. Составляем уравнение реакции горения вещества в воздухе (см. правила составления реакции горения в разделе 2).
По уравнению реакции находим число моль исходного вещества и выделяющихся продуктов реакции горения.
2. Определяем по табл. 3 приложения 2 значения стандартных теплот образования горючего вещества и продуктов горения. Теплоты образования простых веществ (N2, О2) равны нулю.
3. Используя следствие закона Гесса, рассчитываем низшую теплоту сгорания вещества
Qн = S(ni× 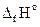 )пг- S(nj×
)пг- S(nj× 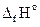 )г.в, кДж/моль.
)г.в, кДж/моль.
4. Рассчитываем количество вещества избытка воздуха по формуле:
nв,изб= 4,76 × b × (a - 1), моль.
5. Рассчитываем общее количество вещества продуктов горения:
Snпг = 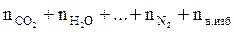 , моль.
, моль.
6. Рассчитываем среднее значение энтальпии 1 моль продуктов горения по формуле:
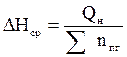 , кДж/моль
, кДж/моль
7.Определяем в первом приближении температуру горения, используя данные табл. 4 приложения 2, используя следующие суждения.
В продуктах горения наибольшее количество составляет азот, поэтому принимаем, что именно ему соответствует расчётное среднее значение энтальпии (∆Нср). По табл. 4 в колонке азота находим ближайшую к ∆Нср величину и выписываем соответствующее ей значение температуры. В продуктах горения кроме азота присутствуют СО2 и Н2О, что понижает температуру (~ на 100 К). Уменьшаем выбранную температуру на 100 К. Это будет первое приближение температуры горения, при которой ведём расчёт энтальпии продуктов горения. Для этого последовательно находим в табл. 4 мольную энтальпию каждого из продуктов горения и умножаем ее на число моль соответствующего продукта горения. Затем суммируем полученные энтальпии всех продуктов реакции горения.
Сравниваем полученное значение с низшей теплотой сгорания вещества. Если суммарное значение энтальпии продуктов горения превышает значение низшей теплоты сгорания вещества, то выбираем второе приближение температуры горения, понижая первую выбранную температуру на 100 К, и повторяем расчёт.
Снова сравниваем полученное значение с низшей теплотой сгорания вещества.
Таким образом, необходимо найти два значения энтальпии продуктов горения вещества, одно из которых больше значения низшей теплоты сгорания, а другое – меньше. Разница между соответствующими этим энтальпиям температурами не должна превышать 100 К.
Температуру горения находим методом линейной интерполяции.
Задача 5 . Рассчитать по следствию закона Гесса низшую теплоту сгорания и адиабатическую температуру горения диэтилового эфира, если коэффициент избытка воздуха составляет 1,3.
Дано:
С4Н10О – диэтиловый эфир
a=1,3
Найти: Qн, Тг?
Решение:
1. Составляем уравнение реакции горения диэтилового эфира в воздухе (см. правила составления реакции горения из раздела 2).
С4Н10О + 6(О2 + 3,76N2) ® 4СО2 + 5Н2О + 6×3,76N2 b = 6
Таким образом, по уравнению реакции находим, что при сгорании 1 моль диэтилового эфира выделяется 4 моль углекислого газа и 5 моль воды:
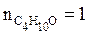 ,
, 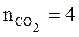 ,
, 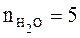
2. По табл. 3 приложения 2 определяем значения стандартных теплот образования горючего вещества и продуктов горения:
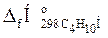 = 273,31 кДж/моль;
= 273,31 кДж/моль;
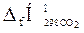 = -393,51 кДж/моль;
= -393,51 кДж/моль;
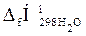 = -241,84 кДж/моль
= -241,84 кДж/моль
3. Используя следствие закона Гесса, рассчитываем низшую теплоту сгорания диэтилового эфира,
∆Н0сгор.= S(n× 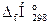 )п.г- S(n×
)п.г- S(n× 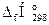 )г.в, кДж/моль;
)г.в, кДж/моль;
∆Н0сгор.= 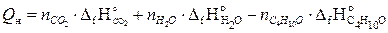 , кДж/моль;
, кДж/моль;
∆Н0сгор.= = 4 × (-393,51) + (5 × -241,84) – 1 ∙ 273,2 = - 2510,95 (кДж/моль);
Qн = -∆Н0сгор.= 2510,95кДж/моль
4. Рассчитываем количество моль избытка воздуха.
nв.изб= 4,76 × b × (a - 1) = 4,76 × 6 × (1,3 - 1) = 8,57 (моль)
5. Рассчитываем общее количество вещества продуктов горения.
Snпг = 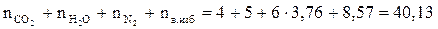 (моль)
(моль)
6. Рассчитываем среднее значение энтальпии 1 моль продуктов горения.
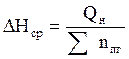 , кДж/моль;
, кДж/моль;
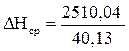 = 62,55 (кДж/моль)
= 62,55 (кДж/моль)
7. Рассчитываем температуру горения, используя данные табл. 4 приложения 2.
В продуктах горения наибольшее количество составляет N2 (6∙3,76 = 22,56 моль), поэтому принимаем, что именно ему соответствует расчётное среднее значение энтальпии (62,55 кДж/моль). По таблице в колонке азота находим ближайшее к 62,55 кДж/моль значение, равное 63,143 кДж/моль. Ему соответствует температура горения 2173 К. Так как в продуктах горения кроме азота присутствуют СО2 и Н2О, то понижаем температуру ~ на 100 К и выбираем температуру 2073 К, при которой ведём расчёт. Находим в табл. 4 приложения 2 мольные энтальпии каждого продукта горения и умножаем их на соответствующее количество вещества.
Тг,1 = 2073 К
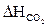 = 4 × 96,58 = 386,32 (кДж/моль)
= 4 × 96,58 = 386,32 (кДж/моль)
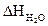 = 5 × 77,6 = 388 (кДж/моль)
= 5 × 77,6 = 388 (кДж/моль)
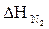 = 22,56 × 59,54 = 1343,22 (кДж/моль)
= 22,56 × 59,54 = 1343,22 (кДж/моль)
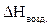 = 8,57 × 60 = 514,2 (кДж/моль)
= 8,57 × 60 = 514,2 (кДж/моль)
S 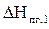 = 2631,74 кДж/моль
= 2631,74 кДж/моль
Сравниваем полученное значение с низшей теплотой сгорания диэтилового эфира:
Qн = 2510,04 кДж/моль < S 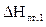 = 2631,74 кДж/моль.
= 2631,74 кДж/моль.
В процессе горения суммарное значение энтальпии продуктов горения не может превышать значение низшей теплоты сгорания диэтилового эфира. Поэтому понижаем температуру еще на 100 К и повторяем расчёт:
Тг,2 = 1973 К
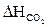 = 4 × 90,55 = 362,2 (кДж/моль)
= 4 × 90,55 = 362,2 (кДж/моль)
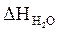 = 5 × 72,45 = 362,3 (кДж/моль)
= 5 × 72,45 = 362,3 (кДж/моль)
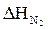 = 22,56 × 55,94 = 1262,01 (кДж/моль)
= 22,56 × 55,94 = 1262,01 (кДж/моль)
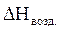 = 8,57 × 56,4 = 483,35 (кДж/моль)
= 8,57 × 56,4 = 483,35 (кДж/моль)
S 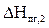 = 2469,86 кДж/моль
= 2469,86 кДж/моль
Снова сравниваем полученное значение с низшей теплотой сгорания диэтилового эфира:
Qн = 2510,04 кДж/моль > S 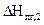 = 2469,86 кДж/моль.
= 2469,86 кДж/моль.
Таким образом, мы нашли два значения энтальпии продуктов горения диэтилового эфира, одно из которых больше значения низшей теплоты сгорания, а другое – меньше. Разница между соответствующими температурами не превышает 100 К.
Температуру горения диэтилового эфира находим методом линейной интерполяции.
(1) 2631,74 кДж/моль ____ 2073 К
(2) 2510,04 кДж/моль ____ Тг
(3) 2469,86 кДж/моль ____ 1973 К
(1 - 3) 161,88 кДж/моль ____ 100 К
(2 - 3) 40,18 кДж/моль ____ DТ
DТ = 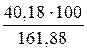 = 24,82 (К)
= 24,82 (К)
Тг = 1973 + 24,82 = 1997,82 (К)
В аналитическом виде уравнение линейной интерполяции выглядит следующим образом:
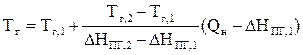
Подставляя в последнюю формулу полученные в первом и втором приближениях значения энтальпий продуктов горения и температур, получаем искомую температуру горения.

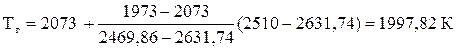
Ответ: расчётное значение низшей теплоты сгорания диэтилового эфира равно 2510,04 кДж/моль, адиабатическая температура горения равна 1997,82 К.
Задача 6 . Рассчитать низшую теплоту сгорания и действительную температуру горения каменного угля состава, масс. %: углерод - 75; водород - 4,5; кислород - 3,5; азот - 2; сера - 4,5; влага - 3; зола - 7,5. Горение протекает при нормальных условиях с коэффициентом избытка воздуха 1,3. Недожог составляет 5 %, а потери тепла излучением – 10 % от низшей теплоты сгорания.
Дано: каменный уголь состава:
wС = 75 %; wН = 4,5 %; wО = 3,5 %; wN = 2 %; wS = 4,5 %; wW = 3 %; wA =7,5%;
Нормальные условия.
a = 1,3%;
недожог 5%;
потери тепла излучением 10%
Найти: Тг, Qн?
Решение:
1. Определяем количество тепла, затраченного на нагрев продуктов горения.
а) По формуле Д.И.Менделеева находим низшую теплоту сгорания каменного угля.
Qн= 339,4 × wС + 1257 × wН - 108,9(wО + wN - wS) - 25,1(9×wН + wW) =
= 339,4 × 75 + 1257 × 4,5 - 108,9(3,5 + 2 - 4,5) - 25,1(9 × 4,5 + 3) = 29910,75 кДж/кг
б) Если принять значение низшей теплоты сгорания за 100%, то на нагрев продуктов горения 1 кг каменного угля, с учетом потерь тепла излучением и недожога, будет затрачено: 100% - 5% - 10% = 85% от значения низшей теплоты сгорания:
0,85 × Qн, кДж/кг
Qпг= 0,85 × 29910,75 = 25424,14 (кДж/кг)
2. Рассчитываем объём продуктов горения 1кг каменного угля при нормальных условиях.
а) Рассчитываем объемы компонентов продуктов горения. Для этого можно воспользоваться табл.1 приложения 2, как в примере 3 раздела 3, или применить ниже приведенные формулы.
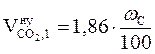 , м3/кг;
, м3/кг; 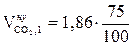 = 1,39 (м3/кг)
= 1,39 (м3/кг) 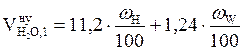 ,м3/кг;
,м3/кг; 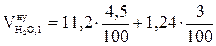 = 0,54 (м3/кг)
= 0,54 (м3/кг)
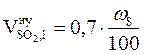 , м3/кг;
, м3/кг; 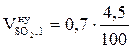 = 0,03 (м3/кг)
= 0,03 (м3/кг)
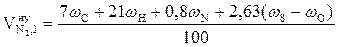 , м3/кг;
, м3/кг;
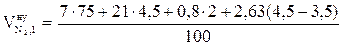 = 6,25 (м3/кг)
= 6,25 (м3/кг)
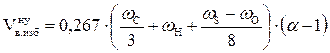 , м3/кг;
, м3/кг;
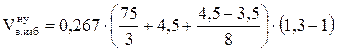 = 2,37 (м3/кг)
= 2,37 (м3/кг)
б) Рассчитываем общий объем продуктов горения 1 кг каменного угля.
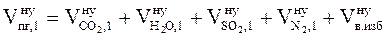 , м3/кг;
, м3/кг;
Vп.г = 1,39 + 0,54 + 0,03 + 6,25 + 2,37 = 10,58 (м3/кг)
3. Рассчитываем среднюю энтальпию единицы объёма продуктов горения:
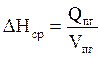 , кДж/м3;
, кДж/м3; 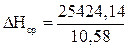 = 2403,04 (кДж/м3)
= 2403,04 (кДж/м3)
4.Рассчитываем температуру горения каменного угля, используя табл. 5 приложения 2. В продуктах горения наибольшее количество составляет N2, поэтому принимаем, что именно ему соответствует расчётное значение средней энтальпии (2403,04 кДж/м3). По таблице находим ближайшее значение (2335,5 кДж/м3), которому соответствует температура горения 1873 К. Наличие в продуктах горения СО2, SO2, H2O понижает температуру горения (приблизительно на 100 К). Таким образом, выбираем температуру 1773 К, при которой ведем расчёт:
Тг,1 = 1773 К
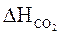 = 1,39 × 3505,7 = 4872,92 (кДж/м3)
= 1,39 × 3505,7 = 4872,92 (кДж/м3)
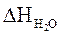 = 0,54 × 2781,3 = 1501,9 (кДж/м3)
= 0,54 × 2781,3 = 1501,9 (кДж/м3)
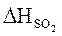 = 0,03 × 3488,2 = 104,65 (кДж/м3)
= 0,03 × 3488,2 = 104,65 (кДж/м3)
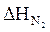 = 6,25 × 2176,7 = 13604,35 (кДж/м3)
= 6,25 × 2176,7 = 13604,35 (кДж/м3)
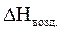 = 2,37 × 2194,7 = 5201,44 (кДж/м3)
= 2,37 × 2194,7 = 5201,44 (кДж/м3)
S∆Нпг,1 = 25285,26 кДж/м3
Сумма энтальпий продуктов горения при температуре 1773 К равна 25285,26 кДж/м3 , что меньше значения Qпг (25424,14 кДж/м3). Поэтому повышаем температуру на 100 К и повторяем расчёт при Тг,2 = 1873 К
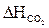 = 1,39 × 3771,4 = 5242,25 (кДж/м3)
= 1,39 × 3771,4 = 5242,25 (кДж/м3)
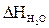 = 0,54 × 3004,2 = 1622,27 (кДж/м3)
= 0,54 × 3004,2 = 1622,27 (кДж/м3)
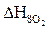 = 0,03 × 3747,5 = 112,43 (кДж/м3)
= 0,03 × 3747,5 = 112,43 (кДж/м3)
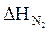 = 6,25 × 2335,5 = 14596,87 (кДж/м3)
= 6,25 × 2335,5 = 14596,87 (кДж/м3)
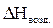 = 2,37 × 2355,2 = 5581,82 (кДж/м3)
= 2,37 × 2355,2 = 5581,82 (кДж/м3)
S∆Нпг,2 = 27155,64 кДж/м3
Сумма энтальпий продуктов горения при температуре 1873 К равна 27155,64 кДж/м3 ,что больше значения Qп.г. (25424,14 кДж/м3).
Таким образом, мы нашли два значения энтальпии продуктов горения каменного угля, одно из которых больше значения теплоты продуктов горения, а другое – меньше. При этом разность соответствующих температур составляет 100К.
Температуру горения каменного угля находим методом линейной интерполяции.
(1) 27155,64 кДж/м3 ¾ 1873 К
(2) 25424,14 кДж/м3 ¾ Тг
(3) 25285,26 кДж/м3 ¾ 1773 К
(1 - 3) 1870,38 кДж/м3 ¾ 100 К
(2 - 3) 138,88 кДж/м3 ¾ D Т
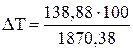 = 7,42 (К);
= 7,42 (К);
Тг = 1773 + 7,42 = 1780,42 (К)
Или по формуле
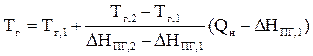
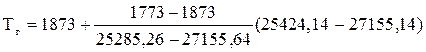 = 1780,42 (К)
= 1780,42 (К)
Ответ: действительная температура каменного угля в заданных условиях составляет 1780,42 К, низшая теплота сгорания 29910,75 кДж/кг.
Дата: 2019-02-24, просмотров: 363.