МЕТОДИЧЕСКИЕ УКАЗАНИЯ
к выполнению индивидуального задания
по дисциплине
«Теория горения и взрыва»
(для студентов, обучающихся по направлению подготовки
20.03.01 «Техносферная безопасность»
и по специальности 20.05.01 «Пожарная безопасность»)
Рассмотрено на заседании кафедры
естественнонаучных дисциплин
Протокол № от г.
Утверждено на заседании учебно-издательского совета ГОУВПО «Академия гражданской защиты» МЧС ДНР
Протокол № от г.
Донецк
2017
содержание
| Стр. | ||
| ВВЕДЕНИЕ | 4 | |
| 1. | Общие указания по выполнению контрольной работы. | 6 |
| 2. | Правила составления уравнения реакции горения. | 8 |
| 3. | Примеры решения типовых задач | 15 |
| 4. | Тип 1. Расчет материального баланса процесса горения. | 15 |
| 5. | Тип 2. Расчет теплового баланса процесса горения. | 31 |
| 6. | Тип 3. Расчёт концентрационных пределов распространения пламени. | 42 |
| 7. | Тип 4. Расчет температуры вспышки и температурных пределов распространения пламени. | 47 |
| 8. | Тип 5. Расчетное определение температуры самовоспламенения. | 50 |
| 9. | Тип 6. Расчет параметров взрыва парогазовых смесей. | 56 |
| 10. | Варианты Заданий для самостоятельного решения | 59 |
| 11. | ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ | 59 |
| 12. | ЗАДАЧИ | 61 |
| 13. | Список рекомендуемой литературы | 85 |
| 14. | Приложения | 86 |
Введение
Предметом изучения дисциплины «Теория горения и взрыва» являются физические и химические процессы и явления, связанные с горением на стадии его возникновения, развития и прекращения.
Использование знаний о механизмах протекания горения дает возможность управлять горением на пожаре, организовывать профилактические меры против возникновения самовоспламенения, самовозгорания, воспламенения, меры по снижению интенсивности горения на пожаре, его локализации и тушению. Глубокое понимание явления горения обеспечивает успешную борьбу с пожарами.
Цель дисциплины «Теория горения и взрыва» состоит в изучении теории возникновения горения и взрыва, приобретении умений и навыков по практическому применению теоретических знаний.
Задачами дисциплины являются:
- изучение теории теплового и цепного взрыва, зажигания и распространения пламени, детонации и ударных волн;
- изучение условий возникновения и распространения горения, условий перехода горения во взрыв, параметров горения газов, жидкостей и твердых горючих материалов;
- изучение методов расчета объема и состава продуктов горения, теплоты и температуры горения, основных показателей пожарной опасности.
Знание химической и физической сути горения необходимо для успешно работы инженера пожарной безопасности в любой области его деятельности.
Методические рекомендации по выполнению контрольной работы по дисциплине «Теория горения и взрыва» предназначены для использования слушателями факультета заочного обучения и соответствуют:
- федеральному образовательному стандарту высшего профессионального образования третьего поколения;
- современному уровню развития знаний с точки зрения методов исследования, теорий, гипотез, фактов.
Методические рекомендации ориентируют обучающегося на самостоятельное использование научных методов при решении задач теории и практики; содержат методический аппарат, развивающий их творческие способности и организующий самостоятельную работу.
Издание включает все основные типы задач по дисциплине "Теория горения и взрыва". В нем приведены подробные алгоритмы решения типовых задач, даны методические рекомендации по выполнению контрольной работы.
В издании соблюдена Международная система единиц (СИ).
1. Общие указания по выполнению контрольной работы
Контрольная работа является важной формой контроля знаний, развития умений и навыков по дисциплине «Теория горения и взрыва» слушателей факультета заочного обучения. В соответствии с учебным планом слушатели факультета заочного обучения обязаны выполнить одну контрольную работу по дисциплине "Теория горения и взрыва".
Контрольная работа выполняется с целью изучения теоретических вопросов основных разделов курса и освоения методики решения задач, используемых в практической деятельности работников пожарной охраны.
Основные задачи контрольной работы:
- систематизация и закрепление теоретических знаний по основным разделам дисциплины;
- развитие навыков самостоятельной работы;
- совершенствование практических навыков расчета объема и состава продуктов горения, теплоты сгорания и температуры горения;
- совершенствование методов оценки основных показателей пожарной опасности веществ и материалов.
Контрольная работа выполняется слушателем самостоятельно.
В результате выполнения контрольной работы слушатели должны закрепить полученные знания, умения и навыки:
- о физико-химической природе явлений горения и взрыва;
- условий самовоспламенения, самовозгорания и зажигания;
- условий распространения пламени и природы пределов его распространения;
- условий перехода нормального горения во взрыв;
- проведения анализа изменения параметров горения в зависимости от различных факторов.
Контрольная работа выполняется по индивидуальному заданию.
Вариант задания выбирается по двум последним цифрам номера зачётной книжки (Приложение 1 табл. 1).
Контрольная работа выполняется в ученической тетради с полями, содержащей не менее 18 листов. На титульном листе тетради должны быть указаны звание, фамилия, имя, отчество, номер зачётной книжки и домашний адрес слушателя. Работа выполняется аккуратно, разборчивым почерком через строчку. В задании должны быть представлены номер и полный текст вопросов.
Ответы на теоретические вопросы должны быть конкретными, развернутыми, полными. Все рисунки, схемы должны быть выполнены карандашом по линейке, пронумерованы и названы. Задачи должны быть оформлены в соответствии со следующей схемой: номер задачи, формулировка задачи, дано, найти, решение, ответ.
В ответах на вопросы и решении задач даются ссылки на использованные справочные данные и соответствующий литературный источник. Литература, используемая слушателем в процессе выполнения задания, приводится в конце работы. Список литературы составляется с учетом правил оформления библиографии (Приложение 1).
Подробно правила оформления контрольных работ изложены в методических рекомендациях [6].
Выполненная и правильно оформленная контрольная работа представляется преподавателю на рецензию.
Контрольная работа зачитывается, если ответы на вопросы и решение всех задач даны принципиально правильно и отвечают перечисленным выше требованиям. В случае, если работа не зачтена преподавателем, слушатель, после рецензии преподавателя, выполняет работу над ошибками в той же тетради и представляет работу на повторное рецензирование.
Примеры решения типовых задач
Тип 1. Расчёт материального баланса процесса горения
Методика расчета объема воздуха, необходимого для сгорания простых
веществ, химических соединений, объема и состава продуктов их горения
А) Твердые вещества (расчет по массе)
1. Составляем уравнение реакции горения вещества в воздухе.
2. Рассчитываем объём, занимаемый 1 кмоль газа при заданных условиях.
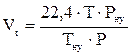 , м3/кмоль;
, м3/кмоль;
где
22,4 м3/кмоль - объем, занимаемый 1 кмоль газа при нормальных условиях.
Рну - атмосферное давление при нормальных условиях, равное 101325 Па.
Тну – температура при нормальных условиях, равная 273К.
Т - заданная температура, К.
Р - заданное давление, Па.
3. Определяем молярную массу горючего вещества (М).
4. Рассчитываем объем воздуха, необходимый для сгорания горючего вещества.
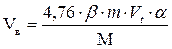 , м3;
, м3;
где
4,76 - число кмоль воздуха (1 кмоль О2 + 3,76 кмоль N2);
β - стехиометрический коэффициент, стоящий перед кислородом в уравнении реакции горения.
m – масса горючего вещества, кг;
Vt – объем, занимаемый 1 кмоль воздуха при заданных условиях, м3/кмоль;
М - молярная масса горючего вещества, кг/кмоль;
a - коэффициент избытка воздуха.
5. Определяем число кмоль кислорода и азота в избытке воздуха.
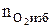 = b(a - 1), кмоль;
= b(a - 1), кмоль;
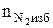 =3,76 × b(a - 1), кмоль.
=3,76 × b(a - 1), кмоль.
6. Рассчитываем общее количество вещества продуктов горения
 , кмоль;
, кмоль;
7. Находим объем продуктов горения по формуле:
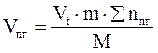 , м3
, м3
где
Vt – объем, занимаемый 1 кмоль продуктов горения при заданных условиях, м3/кмоль;
m - масса горючего вещества, кг;
М - молярная масса горючего вещества, кг/кмоль;
Snпг - количество вещества продуктов горения, кмоль.
8. Рассчитываем объёмы компонентов продуктов горения по формуле:
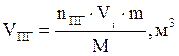
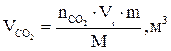
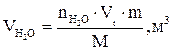
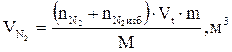
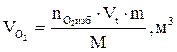 и т.д.
и т.д.
9. Рассчитываем мольный процентный состав продуктов горения, принимая общее число кмоль продуктов горения за 100 %.
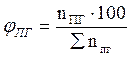 , мол. %;
, мол. %;
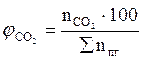 , мол. %;
, мол. %; 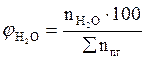 , мол. %;
, мол. %;
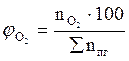 , мол. %;
, мол. %; 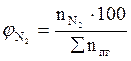 , мол. % и т.д.
, мол. % и т.д.
Аналогично рассчитывается объемный процентный состав продуктов горения. Численное значение объемных процентов при этом будет совпадать с мольным процентным составом продуктов горения.
Б) Газообразные вещества (расчет по объему):
1. Составляем уравнение реакции горения вещества в воздухе.
2. Рассчитываем объем воздуха, необходимого для сгорания вещества.
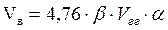 , м3,
, м3,
где
Vв - теоретический объем воздуха необходимый для сгорания вещества, м3.
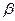 - стехиометрический коэффициент при кислороде в уравнении реакции горения.
- стехиометрический коэффициент при кислороде в уравнении реакции горения.
a - коэффициент избытка воздуха.
Vгг - заданный объем горючего газа, м3.
3. Определяем число кмоль кислорода и азота в избытке воздуха.
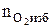 = b(a - 1), кмоль;
= b(a - 1), кмоль;
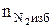 =3,76 × b(a - 1), кмоль.
=3,76 × b(a - 1), кмоль.
4. Рассчитываем общее количество вещества продуктов горения
 , кмоль.
, кмоль.
5. Находим общий объем продуктов горения по формуле:
Vпг = Vгг × ånпг, м3
где
Vгг - заданный объем горючего газа, м3;
ånпг- общее количество вещества продуктов горения, кмоль.
6. Рассчитываем объём компонентов продуктов горения по формуле:
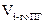 = Vгг×
= Vгг× 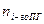 , м3;
, м3;
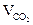 = Vгг×
= Vгг× 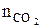 , м3;
, м3; 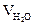 = Vгг×
= Vгг× 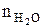 , м3;
, м3;
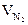 = Vгг×
= Vгг× 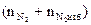 , м3
, м3 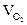 = Vгг×
= Vгг× 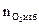 , м3 и т.д.
, м3 и т.д.
7. Рассчитываем мольный процентный состав продуктов горения, исходя из общего числа кмоль продуктов горения.
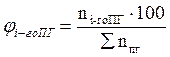 , мол. %;
, мол. %;
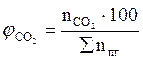 , мол. %;
, мол. %; 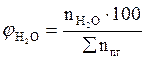 , мол. %;
, мол. %;
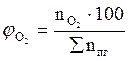 , мол. %;
, мол. %; 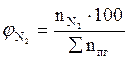 , мол. % и т.д.
, мол. % и т.д.
Методика расчёта объёма воздуха, необходимого для горения сложных веществ переменного состава, расчет объема и состава продуктов их горения
А) Твёрдые и жидкие вещества (расчет по массе).
1. Рассчитываем объём воздуха, необходимый для сгорания заданной массы вещества при нормальных условиях.
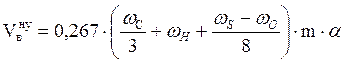 , м3
, м3
где
wС, wН, wS, wO - массовые доли углерода, водорода, серы и кислорода в горючем веществе, %;
m – масса горючего вещества, кг;
a - коэффициент избытка воздуха.
2. Определяем объём воздуха при заданных условиях:
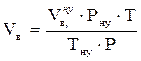 , м3,
, м3,
где
Рну - атмосферное давление при нормальных условиях, Па;
Тну - температура при нормальных условиях, К;
Р - заданное давление, Па;
Т - заданная температура, К.
3. Рассчитываем объём избытка воздуха, находящегося в зоне горения, при нормальных условиях.
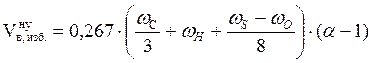 , м3
, м3
4. Используя коэффициенты, указанные в табл. 1 приложения 2, определяем объёмы компонентов продуктов горения (оксида углерода (IV), водяного пара, оксида серы (IV), оксида фосфора (V), азота и кислорода), образующиеся при сгорании 1 кг горючего вещества при нормальных условиях ( 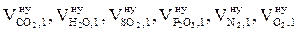 , м3).
, м3).
5. Определяем общий объём продуктов горения, выделяющихся при сгорании 1 кг вещества в нормальных условиях, суммируя объёмы компонентов продуктов горения:
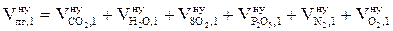 , м3.
, м3.
6. Пересчитываем общий объём продуктов горения при нормальных условиях на заданное количество вещества
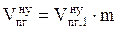 , м3
, м3
где
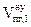 - общий объём продуктов горения, выделяющихся при сгорании 1 кг горючего вещества в нормальных условиях, м3;
- общий объём продуктов горения, выделяющихся при сгорании 1 кг горючего вещества в нормальных условиях, м3;
m - масса горючего вещества, кг.
7. Находим объём продуктов горения при заданных условиях.
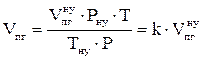 , м3,
, м3,
где
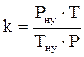 .
.
8. Находим объём компонентов продуктов горения при заданных условиях по формулам:
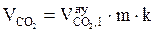 , м3;
, м3; 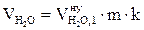 , м3;
, м3; 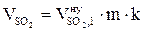 , м3;
, м3;
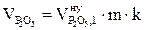 , м3;
, м3; 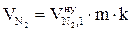 , м3;
, м3; 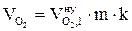 , м3.
, м3.
9. Объемный процентный состав компонентов продуктов горения определяется из следующих соотношений, принимая их общий объём 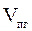 за 100 %.
за 100 %.
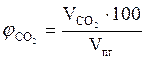 ,об. %;
,об. %; 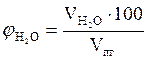 , об. %;
, об. %;
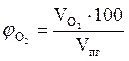 , об. %;
, об. %; 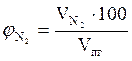 , об. % и т.д.
, об. % и т.д.
Б) Смесь газов (расчет по объему).
1. Составляем уравнения реакций горения горючих компонентов газовой смеси в воздухе и определяем стехиометрические коэффициенты b.
2. Определяем объём воздуха, необходимый для сгорания заданного объёма газовой смеси по формуле:
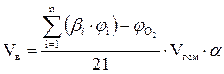 , м3;
, м3;
где
bi- стехиометрический коэффициент перед кислородом i-ого горючего компонента смеси;
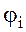 - концентрация i-ого горючего компонента смеси, об. %;
- концентрация i-ого горючего компонента смеси, об. %;
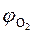 - концентрация кислорода в газовой смеси, об. %;
- концентрация кислорода в газовой смеси, об. %;
Vгсм- заданный объём газовой смеси, м3.
a - коэффициент избытка воздуха.
3. Если заданный коэффициент избытка воздуха α > 1, то определяется объём избытка воздуха при сгорании 1 м3 газовой смеси
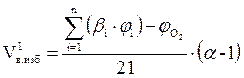 , м3.
, м3.
4. Используя коэффициенты, указанные в табл. 2 приложения 2, находим объём компонентов продуктов горения, образующихся при сгорании 1 м3 смеси ( 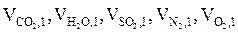 ).
).
5. Рассчитываем общий объём продуктов, выделяющихся при сгорании 1 м3 горючей смеси, суммируя полученные значения объёмов компонентов продуктов горения:
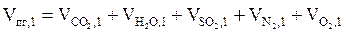 , м3.
, м3.
6. Пересчитываем полученное значение на заданный объём горючей смеси:
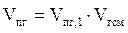 , м3.
, м3.
7. Находим объём каждого из компонентов продуктов горения:
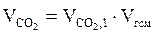 , м3;
, м3;
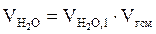 , м3;
, м3;
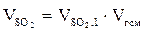 , м3 и т.д.
, м3 и т.д.
8. Рассчитываем объемный состав компонентов продуктов горения по формулам:
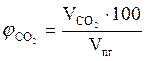 ,об. %, мол. %;
,об. %, мол. %; 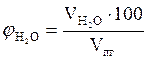 , об. %, мол. %;
, об. %, мол. %;
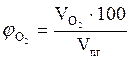 , об. %, мол. %;
, об. %, мол. %; 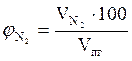 , об. %, мол. % и т.д.
, об. %, мол. % и т.д.
Задача 1. Рассчитать объём воздуха, необходимый для полного сгорания 5 кг хлорбензола; общий объём образовавшихся продуктов горения и их объемный процентный состав, при температуре 12 0С и давлении 101250 Па, если избыток воздуха составляет 15 %.
Дано:
C6H5Cl – хлорбензол;
m = 5 кг;
t = 120С;
Р = 101250 Па;
избыток воздуха = 15%.
Найти: Vв, Vпг, jпг ?
Решение:
1. Используя правила, изложенные в разделе 2 настоящего пособия, составляем уравнение реакции горения хлорбензола в воздухе и определяем коэффициент b (стехиометрический коэффициент перед кислородом).
C6H5Cl + 7(О2 + 3,76N2) ® 6СО2 + 2Н2О + НCl + 7×3,76N2
b = 7
2. Рассчитываем объём, занимаемый 1 кмоль воздуха при заданных условиях.
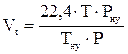 , м3/кмоль;
, м3/кмоль;
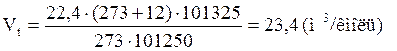
3. Рассчитываем молярную массу хлорбензола.
М (C6H5Cl) = 12 × 6 + 1 × 5 + 35,5 × 1 = 112,5 кг/кмоль
4. Рассчитываем объём воздуха, необходимый для полного сгорания заданной массы хлорбензола.
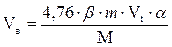 , м3;
, м3;
По условию задачи избыток воздуха составляет 15 %. В этом случае коэффициент избытка воздуха (a) на 0,15 больше единицы. Следовательно, a = 1,15.
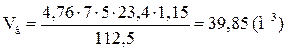
5. Определяем избыточное количество вещества кислорода и азота.
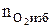 = b(a - 1), кмоль;
= b(a - 1), кмоль; 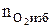 = 7(1,15 - 1) = 1,05 (кмоль)
= 7(1,15 - 1) = 1,05 (кмоль)
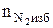 =3,76 × b(a - 1), кмоль;
=3,76 × b(a - 1), кмоль; 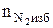 =3,76 × 7(1,15 - 1) = 3,95 (кмоль)
=3,76 × 7(1,15 - 1) = 3,95 (кмоль)
6. Рассчитываем общее количество вещества продуктов горения.
ånп.г= 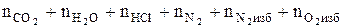 , кмоль;
, кмоль;
ånп.г= 6 + 2 + 1 + 26,32 + 3,95 + 1,05 = 40,32 (кмоль)
7. Определяем общий объём образующихся продуктов горения.
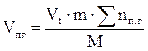 , м3;
, м3;
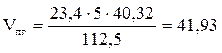 (м3)
(м3)
8. Рассчитываем объём компонентов продуктов горения.
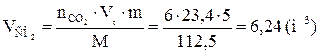
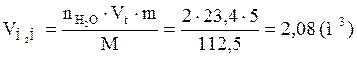
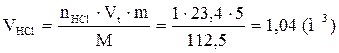
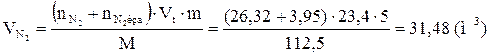
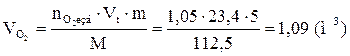
9. Определяем объемный состав компонентов продуктов горения. Принимаем общее количество вещества продуктов горения за 100 %.
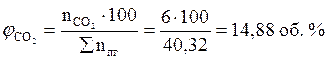
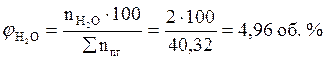
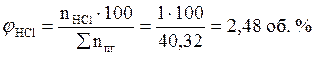
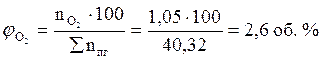
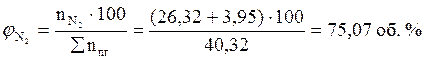
Ответ: для полного сгорания 5 кг хлорбензола в заданных условиях необходимо 39,85 м3 воздуха, при этом выделяется 41,93 м3 продуктов горения состава: оксид углерод (IV) - 6,24 м3 (14,88 %), вода - 2,08 м3 (4,96 %), хлороводород - 1,04 м3 (2,48 %), кислород - 1,09 м3 (2,6 %), азот - 31,48 м3 (75,07 %).
Задача 2. Рассчитать объём воздуха, необходимый для сгорания 17 м3 ацетилена, объём и объемный состав продуктов горения, если коэффициент избытка воздуха составляет 1,5.
Дано:
С2Н2 – ацетилен;
Vг.г. = 17 м3;
a = 1,5.
Найти: Vв, Vп.г., jп.г. ?
Решение:
1. Составляем уравнение реакции горения ацетилена в воздухе и определяем коэффициент b (см. правила составления реакции горения в разделе 2).
C2H2 + (2,5О2 + 3,76N2) ® 2СО2 + Н2О + 2,5×3,76N2
b = 2,5
2. Рассчитываем объём воздуха, необходимый для полного сгорания заданного объёма ацетилена.
Vв = 4,76 × b × Vгг × a, м3;
Vв = 4,76 × 2,5 × 17 × 1,5 = 303,45 (м3)
3. Определяем количество вещества кислорода и азота в избытке воздуха.
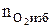 = b× (a - 1) = 2,5× (1,5 - 1) = 1,25 (кмоль)
= b× (a - 1) = 2,5× (1,5 - 1) = 1,25 (кмоль)
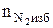 = 3,76×b× (a - 1) =3,76×2,5× (1,5 - 1)= 4,7 (кмоль)
= 3,76×b× (a - 1) =3,76×2,5× (1,5 - 1)= 4,7 (кмоль)
4. Рассчитываем общее количество вещества продуктов горения.
ånпг = 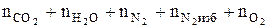 , кмоль;
, кмоль;
ånпг = 2 + 1 + 9,4 + 4,7 + 1,25 = 18,35 (кмоль)
5. Определяем общий объём образующихся продуктов горения.
Vпг = Vгг × Snпг = 17 × 18,35 = 311,95 (м3)
6. Рассчитываем объём компонентов продуктов горения.
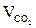 = Vгг ×
= Vгг × 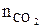 , м3;
, м3; 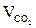 = 17 × 2 = 34 (м3)
= 17 × 2 = 34 (м3)
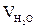 = Vгг ×
= Vгг × 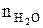 , м3;
, м3; 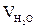 = 17 × 1 = 17 (м3)
= 17 × 1 = 17 (м3)
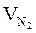 = Vгг ×
= Vгг × 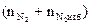 , м3
, м3 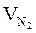 = 17 × (9,4 + 4,7) = 239,7 (м3)
= 17 × (9,4 + 4,7) = 239,7 (м3)
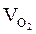 = Vгг ×
= Vгг × 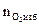 , м3
, м3 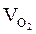 = 17 × 1,25 = 21,25 (м3)
= 17 × 1,25 = 21,25 (м3)
7. Рассчитываем объемный состав продуктов горения, исходя из общего числа кмоль продуктов горения.
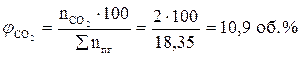 ;
;
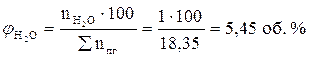 ;
;
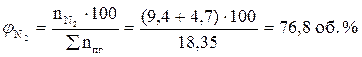 ;
;
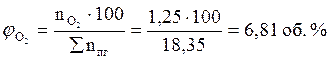 .
.
Ответ: для полного сгорания 17 м3 ацетилена в заданных условиях необходимо 303,45 м3 воздуха, при этом выделяется 311,95 м3 продуктов горения, состава: оксид углерод (IV) – 34 м3 (10,9%), вода – 17 м3 (5,45%), азот - 239,7 м3 (76,8%), кислород - 21,25 м3 (6,81%).
Задача 3. Рассчитать объём воздуха, необходимый для сгорания 2 кг каменного угля, имеющего состав в %: углерод - 79,81; водород - 5,63; кислород - 10,12; сера - 2,71; зола - 1,73. Если температура окружающей среды 17 оС, давление 100658 Па, коэффициент избытка воздуха 1,5. Определить объём и процентный состав продуктов горения.
Дано: каменный уголь состава:
w(С) - 79,81%; w(Н) - 5,63%; w(О) - 10,12%; w(S) - 2,71%; w(зола) - 1,73% .
m = 2 кг;
a = 1,5;
t = 17 оС;
Р = 100658 Па.
Найти: 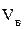 ;
; 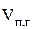 ; j(п.г.)?
; j(п.г.)?
Решение:
1. Рассчитываем объём воздуха, необходимый для сгорания заданной массы каменного угля при нормальных условиях.
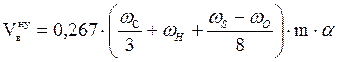 , м3;
, м3;
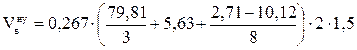 = 25,07 (м3)
= 25,07 (м3)
2. Рассчитываем объём воздуха, необходимый для сгорания каменного угля, при заданных условиях.
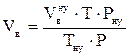 , м3;
, м3;
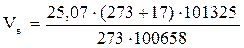 = 26,81 (м3)
= 26,81 (м3)
3. Рассчитываем объём избытка воздуха, находящегося в зоне горения.
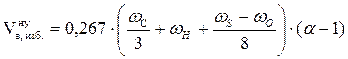 , м3
, м3
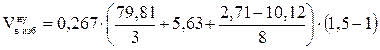 = 4,17 (м3)
= 4,17 (м3)
4. Определяем объём и состав продуктов горения 1 кг каменного угля при нормальных условиях, используя табл.1 приложения 2.
| № п/п | Элементный состав вещества на 1 кг | 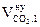 ,
м3 ,
м3
| 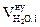 ,
м3 ,
м3
| 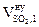 ,
м3 ,
м3
| 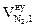 ,
м3 ,
м3
| 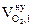 ,
м3 ,
м3
|
| 1 | mC = 0,7981 кг | 1,87 × 0,7981 = 1,492 | ____ | ____ | 7,02 × 0,7981 = 5,603 | ____ |
| 2 | mH = 0,0563 кг | ____ | 11,2 × 0,0563 = 0,6306 | ____ | 21,06 × 0,0563 = 1,186 | ____ |
| 3 | mO = 0,1012 кг | ____ | ____ | ____ | -2,63 × 0,1012 = - 0,266 | ____ |
| 4 | mS = 0,0271 кг | ____ | ____ | 0,7 × 0,0271 = 0,019 | 2,63 × 0,0271 = 0,071 | ____ |
| 5 | Избыток воздуха | ____ | ____ | ____ | 4,17 × 0,79 = 3,29 | 4,17 × 0,21 = 0,88 |
| 6 | Всего | 1,492 | 0,630 | 0,019 | 9,884 | 0,88 |
Примечание: при заполнении графы "элементный состав вещества на 1 кг" следует перевести массовую долю каждого элемента в доли единицы (wС = 79,81 %, что соответствует массе углерода mC = 0,7981 кг); жирным выделены постоянные коэффициенты, которые взяты из таблицы 2 приложения 2.
5. Определяем объём компонентов продуктов горения 1 кг каменного угля при нормальных условиях.
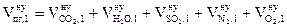 , м3;
, м3;
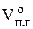 = 1,4924 + 0,6306 + 0,019 + 9,8835 + 0,88 = 12,91 (м3)
= 1,4924 + 0,6306 + 0,019 + 9,8835 + 0,88 = 12,91 (м3)
6. Рассчитываем общий объём продуктов горения, выделившихся при сгорании 2 кг каменного угля при нормальных условиях.
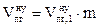 , м3 ;
, м3 ; 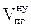 = 12,91 × 2 = 25,81 (м3)
= 12,91 × 2 = 25,81 (м3)
7. Определяем общий объём продуктов горения каменного угля, образующихся при заданных условиях.
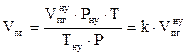 , м3;
, м3; 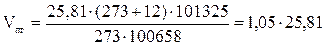 =27,6 (м3)
=27,6 (м3)
8. Рассчитываем объём компонентов продуктов горения каменного угля при заданных условиях.
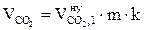 = 1,492 2 1,05 = 3,19 (м3);
= 1,492 2 1,05 = 3,19 (м3);
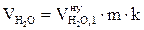 = 0,6306 2 1,05 = 1,35 (м3);
= 0,6306 2 1,05 = 1,35 (м3);
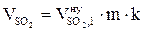 = 0,019 2 1,05 = 0,04 (м3);
= 0,019 2 1,05 = 0,04 (м3);
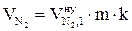 = 9,8835 2 1,05 = 21,14 (м3);
= 9,8835 2 1,05 = 21,14 (м3);
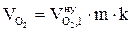 = 0,88 2 1,05 = 1,88 (м3);
= 0,88 2 1,05 = 1,88 (м3);
где
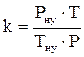 .
.
9. Находим объемный процентный состав компонентов продуктов горения.
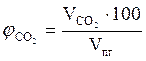 , %;
, %; 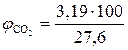 = 11,56 %
= 11,56 %
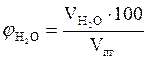 , %;
, %; 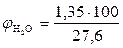 = 4,89 %
= 4,89 %
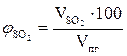 , %;
, %; 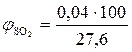 = 0,14 %
= 0,14 %
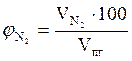 , % ;
, % ; 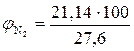 = 76,59 %
= 76,59 %
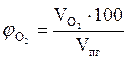 , %
, % 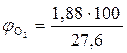 = 6,81 %
= 6,81 %
Ответ. Для полного сгорания 2 кг каменного угля в заданных условиях необходимо 26,81 м3 воздуха, при этом выделяется 27,6 м3 продуктов горения, состава: оксид углерода (IV) - 3,19 м3 (11,56 %), вода - 1,35 м3 (4,89 %), оксид серы (IV) - 0,04 м3 (0,14 %), азот - 21,14 м3 (76,59 %), кислород - 1,88 м3 (6,81 %).
Задача 4. Рассчитать объём воздуха, необходимый для сгорания 23 м3 смеси газов состава в % (об.): метан – 89 %; этан - 4,7 %; пропан – 3,7 %; оксид углерода (IV) - 2,4 %; азот - 0,2 %. Определить объём и процентный состав продуктов горения, если коэффициент избытка воздуха равен 1,5.
Дано: смесь газов следующего состава:
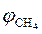 = 89 %;
= 89 %; 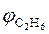 = 4,7 %;
= 4,7 %; 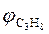 = 3,7 %;
= 3,7 %; 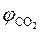 = 2,4 %;
= 2,4 %; 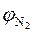 = 0,2 %.
= 0,2 %.
Vгсм = 23 м3,
a = 1,5.
Найти: Vв, Vпг, jпг ?
Решение:
1. Составляем уравнения реакции горения горючих компонентов газовой смеси в воздухе и определяем стехиометрические коэффициенты b. Среди газов, входящих в состав смеси, гореть способны метан СН4 (обозначим его цифрой 1), этан С2Н6 (2) и пропан С3Н8 (3). Азот до 2000 0С в реакцию горения не вступает, углекислый газ также не горит.
СН4 + 2(О2 + 3,76 N2) ® СО2 + 2Н2О + 7.52 N2 b1 = 2
С2Н6 + 3,5(О2+ 3,76 N2) ® 2СО2 + 3Н2О + 3,16 N2 b2= 3,5
С3Н8 + 5(О2 + 3,76 N2) ® 3СО2 + 4Н2О + 18.80 N2 b3= 5
2. Определяем объём воздуха, необходимый для сгорания заданного объёма газовой смеси.
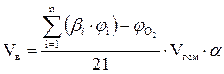 , м3;
, м3;
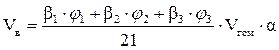 =
= 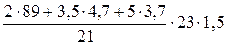 = 349,85 (м3)
= 349,85 (м3)
3. Рассчитываем объём избытка воздуха, находящегося в зоне горения, при сгорании 1 м3 газовой смеси.
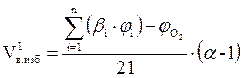 , м3;
, м3;
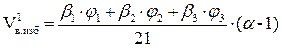 =
= 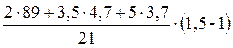 = 5,07 (м3)
= 5,07 (м3)
4. Определяем объём и состав продуктов горения 1 м3 газовой смеси, используя табл. 2 приложения 2. Для этого заполним таблицу:
| № п/п | Состав 1 м3 газовой смеси | 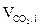 , м3 , м3
| 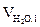 , м3 , м3
| 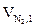 , м3 , м3
| 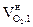 , м3 , м3
|
| 1 | 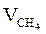 = 0,89 м3 = 0,89 м3
| 1×0,89=0,89 | 2×0,89=1,79 | 7,52×0,89=6,69 | ____ |
| 2 | 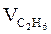 = 0,047м3 = 0,047м3
| 2×0,047=0,09 | 3×0,047=0,14 | 13,16×0,047=0,62 | ____ |
| 3 | 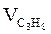 = 0,037м3 = 0,037м3
| 3×0,037=0,11 | 4×0,037=0,15 | 16,8×0,037=0,62 | ____ |
| 4 | 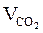 = 0,024 м3 = 0,024 м3
| 1×0,024=0,02 | ____ | ____ | ____ |
| 5 | 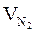 = 0,002 м3 = 0,002 м3
| ____ | ____ | 1×0,002=0,002 | ____ |
| 6 | Избыток воздуха | ____ | ____ | 5,07×0,79=4,01 | 5,07×0,21=1,06 |
| 7 | Всего | 1,11 | 2,08 | 11,94 | 1,06 |
5. Определяем объём продуктов горения 1 м3 смеси газов.
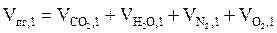 = 1,11 + 2,08 + 11,94 + 1,06 = 16,19 (м3)
= 1,11 + 2,08 + 11,94 + 1,06 = 16,19 (м3)
6. Рассчитываем объём продуктов горения 23 м3 природного газа.
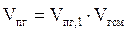 = 16,19 ×23 = 372,37 (м3)
= 16,19 ×23 = 372,37 (м3)
7. Рассчитываем объём каждого из компонентов продуктов горения.
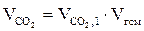 = 1,11 × 23 = 25,53 (м3);
= 1,11 × 23 = 25,53 (м3);
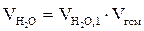 =2,08 × 23 = 47,84 (м3);
=2,08 × 23 = 47,84 (м3);
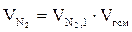 = 11,94 × 23 = 274,62 (м3);
= 11,94 × 23 = 274,62 (м3);
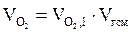 = 1,06 × 23 = 24,38 (м3).
= 1,06 × 23 = 24,38 (м3).
8. Определяем объемный состав компонентов продуктов горения.
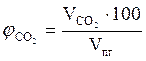 =
= 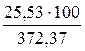 = 6,85 %
= 6,85 %
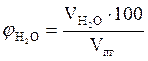 =
= 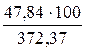 = 12,85 %.
= 12,85 %.
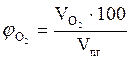 =
= 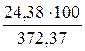 = 6,55 %
= 6,55 %
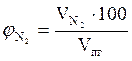 =
= 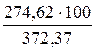 = 73,75 %
= 73,75 %
Ответ. Для полного сгорания 23 м3 газовой смеси в заданных условиях необходимо 349,85 м3 воздуха, при этом выделяется 372,37 м3 продуктов горения, состава: оксид углерода (IV) - 25,53 м3 (6,85 %), вода - 47,84 м3 (12,85 %), азот - 274,62 м3 (73,75 %), кислород - 24,38 м3 (6,55 %).
ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ
1. Исторические этапы установления сущности горения. Вклад отечественных ученых в науку о горении.
2. Механизм химического взаимодействия при горении и взрыве. Энергия активации. Условия, необходимые для возникновения горения.
3. Дайте развернутую характеристику различных режимов горения: кинетического и диффузионного, гомогенного и гетерогенного, ламинарного и турбулентного, детонационного и дефлаграционного.
4. Что называют полным и неполным горением? Факторы, влияющие на полноту сгорания. Дым, опасные факторы дыма.
5. Пламя, процессы, происходящие в пламени, причины свечения пламени. Способы передачи тепла от пламени к горючему веществу.
6. Стационарное и нестационарное пламя. Понятие видимой скорости распространения пламени, ее отличие от нормальной.
7. Взрыв. Классификация химических взрывов. Классификация физических взрывов.
8. Понятие горючести. Классификация веществ и материалов по способности гореть. Методы оценки горючести веществ и материалов. Методы определения группы горючести.
9. Теплота сгорания, ее виды. Методы определения теплоты сгорания.
10. Экзотермические и эндотермические химические реакции. Закон Гесса, следствие из закона Гесса.
11. Температура горения, ее виды, методы определения.
12. Концентрационные пределы распространения пламени (КПР). Расчетные и экспериментальные методы определения КПР. Практическое значение.
13. Факторы, влияющие на концентрационные пределы распространения пламени.
14. Минимальное взрывоопасное содержание кислорода, минимальная флегматизирующая концентрация флегматизатора. Механизм действия флегматизатора на концентрационные пределы распространения пламени.
15. Процессы, происходящие с жидкостью при нагревании. Механизм горения паро-воздушной смеси.
16. Скорости горения жидкостей. Факторы, влияющие на скорость распространения пламени по поверхности жидкости.
17. Температура вспышки и воспламенения. Классификация жидкостей по температуре вспышки. Методы определения температуры вспышки.
18. Температурные пределы распространения пламени, их взаимосвязь с концентрационными пределами распространения пламени. Практическое значение.
19. Механизм образования и горения пылевоздушной смеси. Классификация пыли по пожаровзрывоопасности.
20. Влияние условий горения на скорость распространения пламени по пылевоздушной смеси.
21. Механизм цепного самовоспламенения.
22. Механизм теплового самовоспламенения.
23. Температура самовоспламенения, условия, на неё влияющие. Практическое значение.
24. Методы определения температуры самовоспламенения.
25. Понятие самовозгорания веществ и материалов. Виды самовозгорания.
26. Самовозгорание растительных, минеральных масел, жиров. Условия самовозгорания промасленных материалов. Методы определения их склонности к самовозгоранию. Меры противопожарной профилактики.
27. Причины и условия самовозгорания ископаемых углей. Меры противопожарной профилактики.
28. Самовозгорание торфа. Меры противопожарной профилактики.
29. Механизм микробиологического самовозгорания. Меры профилактики самовозгорания растительных продуктов.
30. Самовозгорание веществ при контакте с кислородом воздуха. Меры противопожарной профилактики.
31. Самовозгорание веществ при контакте с водой. Меры противопожарной профилактики.
32. Самовозгорание веществ при контакте с галогенами, кислотами, пероксидом натрия и перманганатом калия. Меры противопожарной профилактики.
33. Общие и отличительные особенности процессов самовоспламенения и самовозгорания.
34. Общие и отличительные особенности процессов самовоспламенения и вынужденного воспламенения (зажигания).
35. Источники зажигания, механизмы вынужденного воспламенения.
36. Элементы тепловой теории распространения пламени по газовой смеси.
37. Кинетическое горение газов. Структура кинетического пламени.
38. Нормальная скорость горения, факторы, влияющие на неё. Методы определения нормальной скорости распространения пламени.
39. Диффузионное горение газов. Структура диффузионного пламени.
40. Высота диффузионного пламени, его зависимость от различных факторов.
41. Механизм воспламенения и горения древесины. Стадии медленного термического разложения древесины. Гомогенный и гетерогенный режимы горения древесины.
42. Факторы, влияющие на скорость распространения пламени по поверхности твердых горючих материалов.
43. Механизм воспламенения и горения металлов.
44. Классификация взрывов по плотности вещества и типам химических реакций.
45. Понятие детонации. Отличительные особенности детонационного режима горения от дефлаграционного. Условия, благоприятствующие переходу горения во взрыв.
46. Энергия и мощность взрыва, тротиловый эквивалент.
47. Основные показатели пожарной опасности газов, область их применения.
48. Основные показатели пожарной опасности жидкостей, область их применения.
49. Основные показатели пожарной опасности пыли, область их применения.
50. Основные показатели пожарной опасности твердых веществ, область их применения.
ЗАДАЧИ
Номера
Теоретических вопросов
Номера задач
Продолжение табл. 1
| 29 | 29 | 43 | 29 | 79 | 129 | 189 | 229 | 293 |
| 30 | 30 | 44 | 30 | 80 | 130 | 190 | 230 | 294 |
| 31 | 31 | 45 | 31 | 81 | 131 | 191 | 231 | 295 |
| 32 | 32 | 46 | 32 | 82 | 132 | 192 | 232 | 296 |
| 33 | 33 | 47 | 33 | 83 | 133 | 193 | 233 | 297 |
| 34 | 34 | 48 | 34 | 84 | 134 | 194 | 234 | 298 |
| 35 | 35 | 49 | 35 | 85 | 135 | 195 | 235 | 299 |
| 36 | 36 | 50 | 36 | 86 | 136 | 196 | 236 | 300 |
| 37 | 37 | 1 | 37 | 87 | 137 | 197 | 237 | 251 |
| 38 | 38 | 2 | 38 | 88 | 138 | 198 | 238 | 252 |
| 39 | 39 | 3 | 39 | 89 | 139 | 199 | 239 | 253 |
| 40 | 40 | 4 | 40 | 90 | 140 | 200 | 240 | 254 |
| 41 | 41 | 5 | 41 | 91 | 141 | 151 | 241 | 255 |
| 42 | 42 | 6 | 42 | 92 | 142 | 152 | 242 | 256 |
| 43 | 43 | 7 | 43 | 93 | 143 | 153 | 243 | 257 |
| 44 | 44 | 8 | 44 | 94 | 144 | 154 | 244 | 258 |
| 45 | 45 | 9 | 45 | 95 | 145 | 155 | 245 | 259 |
| 46 | 46 | 10 | 46 | 96 | 146 | 156 | 246 | 260 |
| 47 | 47 | 11 | 47 | 97 | 147 | 157 | 247 | 261 |
| 48 | 48 | 12 | 48 | 98 | 148 | 158 | 248 | 262 |
| 49 | 49 | 13 | 49 | 99 | 149 | 159 | 249 | 263 |
| 50 | 50 | 14 | 50 | 100 | 150 | 160 | 250 | 264 |
| 51 | 1 | 20 | 5 | 76 | 101 | 155 | 211 | 270 |
| 52 | 2 | 21 | 6 | 77 | 102 | 156 | 212 | 271 |
| 53 | 3 | 22 | 7 | 78 | 103 | 157 | 213 | 272 |
| 54 | 4 | 23 | 8 | 79 | 104 | 158 | 214 | 273 |
| 55 | 5 | 24 | 9 | 80 | 105 | 159 | 215 | 274 |
| 56 | 6 | 25 | 10 | 81 | 106 | 160 | 216 | 275 |
| 57 | 7 | 26 | 11 | 82 | 107 | 161 | 217 | 276 |
| 58 | 8 | 27 | 12 | 83 | 108 | 162 | 218 | 277 |
| 59 | 9 | 28 | 13 | 84 | 109 | 163 | 219 | 278 |
| 60 | 10 | 29 | 14 | 85 | 110 | 164 | 220 | 279 |
| 61 | 11 | 30 | 15 | 86 | 111 | 165 | 221 | 280 |
| 62 | 12 | 31 | 16 | 87 | 112 | 166 | 222 | 281 |
| 63 | 13 | 32 | 17 | 88 | 113 | 167 | 223 | 282 |
| 64 | 14 | 33 | 18 | 89 | 114 | 168 | 224 | 283 |
| 65 | 15 | 34 | 19 | 90 | 115 | 169 | 225 | 284 |
Окончание табл. 1
| 66 | 16 | 35 | 20 | 91 | 116 | 170 | 226 | 285 |
| 67 | 17 | 36 | 21 | 92 | 117 | 171 | 227 | 286 |
| 68 | 18 | 37 | 22 | 93 | 118 | 172 | 228 | 287 |
| 69 | 19 | 38 | 23 | 94 | 119 | 173 | 229 | 288 |
| 70 | 20 | 39 | 24 | 95 | 120 | 174 | 230 | 289 |
| 71 | 21 | 40 | 25 | 96 | 121 | 175 | 231 | 290 |
| 72 | 22 | 41 | 26 | 97 | 122 | 176 | 232 | 291 |
| 73 | 23 | 42 | 27 | 98 | 123 | 177 | 233 | 292 |
| 74 | 24 | 43 | 28 | 99 | 124 | 178 | 234 | 293 |
| 75 | 25 | 44 | 29 | 100 | 125 | 179 | 235 | 294 |
| 76 | 26 | 45 | 30 | 51 | 126 | 180 | 236 | 295 |
| 77 | 27 | 46 | 31 | 52 | 127 | 181 | 237 | 296 |
| 78 | 28 | 47 | 32 | 53 | 128 | 182 | 238 | 297 |
| 79 | 29 | 48 | 33 | 54 | 129 | 183 | 239 | 298 |
| 80 | 30 | 49 | 34 | 55 | 130 | 184 | 240 | 299 |
| 81 | 31 | 50 | 35 | 56 | 131 | 185 | 241 | 300 |
| 82 | 32 | 1 | 36 | 57 | 132 | 186 | 242 | 251 |
| 83 | 33 | 2 | 37 | 58 | 133 | 187 | 243 | 252 |
| 84 | 34 | 3 | 38 | 59 | 134 | 188 | 244 | 253 |
| 85 | 35 | 4 | 39 | 60 | 135 | 189 | 245 | 254 |
| 86 | 36 | 5 | 40 | 61 | 136 | 190 | 246 | 255 |
| 87 | 37 | 6 | 41 | 62 | 137 | 191 | 247 | 256 |
| 88 | 38 | 7 | 42 | 63 | 138 | 192 | 248 | 257 |
| 89 | 39 | 8 | 43 | 64 | 139 | 193 | 249 | 258 |
| 90 | 40 | 9 | 44 | 65 | 140 | 194 | 250 | 259 |
| 91 | 41 | 10 | 45 | 66 | 141 | 195 | 201 | 260 |
| 92 | 42 | 11 | 46 | 67 | 142 | 196 | 202 | 261 |
| 93 | 43 | 12 | 47 | 68 | 143 | 197 | 203 | 262 |
| 94 | 44 | 13 | 48 | 69 | 144 | 198 | 204 | 263 |
| 95 | 45 | 14 | 49 | 70 | 145 | 199 | 205 | 264 |
| 96 | 46 | 15 | 50 | 71 | 146 | 200 | 206 | 265 |
| 97 | 47 | 16 | 1 | 72 | 147 | 151 | 207 | 266 |
| 98 | 48 | 17 | 2 | 73 | 148 | 152 | 208 | 267 |
| 99 | 49 | 18 | 3 | 74 | 149 | 153 | 209 | 268 |
| 100 | 50 | 19 | 4 | 75 | 150 | 154 | 210 | 269 |
Правила оформления библиографического списка
Список литературы дается с заголовком «Библиографический список» (без кавычек). Оформление библиографического списка производится согласно ГОСТ 7.1–2003 «Библиографическая запись. Библиографическое описание. Общие требования и правила составления», Оформление библиографического списка производится либо в виде сносок (ГОСТ Р 7.0.5-2008 «Библиографическая ссылка. Общие требования и правила составления»), либо в виде списка в конце работы. Библиографический список составляется либо в алфавитном порядке, либо в порядке использования источников (первой ссылки на них) по следующим основным правилам.
1. Фамилия и через запятую инициалы первого автора. После названия книги и расшифровки вида издания через косую черту – слеш (/) – имена всех авторов, но инициалы каждого автора должны быть впереди его фамилии. Если авторов более четырех, указываются первые три автора, а далее вместо остальных пишется «и др.».
2. Название источника приводится без кавычек. Сокращений не допускается.
3. Если есть подзаголовок (расшифровка издания), он пишется с маленькой буквы после основного и отделяется двоеточием. После названия ставятся точка и тире.
4. Если имеется редактор, указываются его инициалы и фамилия после точки с запятой в виде: ;под ред. <инициалы и фамилия редактора>. Аналогично редактор указывается в библиографическом списке, если источник переводной: / пер. с англ. <инициалы и фамилия переводчика>; под ред. <инициалы и фамилия редактора>. Библиографическое описание отдельных книг, создаваемых коллективом авторов, могут начинаться с названия, а не с фамилий. В этом случае фамилии авторов указываются после названия через слэш / <инициалы и фамилии авторов>.
5. Место издания (город, перед которым ставятся точка и тире) пишется с большой буквы полностью, после названия города ставится двоеточие. Допускаются только сокращения М., Л., СПб., Ростов н/Д.
6. Название издательства пишется с большой буквы без кавычек. Если в название издательства входит слово «Издательство», его пишут сокращенно «Изд-во» без кавычек, а само название может быть в кавычках (как в оригинале). После издательства ставится запятая.
7. Год издания. Слово «год» не пишется. После указания года выпуска в виде четырехзначного числа ставятся точка и тире.
8. Следующий элемент – после тире указывается объем источника (книги) в виде числа с буквой «с.» (страниц).
9. При ссылке на статьи и журналы указываются: фамилия и инициалы автора. Название статьи // Название журнала. – Год выпуска. – Номер журнала. – Номера страниц, занимаемых статьей (например, С. 40–45).
10. Библиографические ссылки. На все литературные источники, приведенные в библиографическом списке, в тексте издания должны быть сделаны ссылки.
Ссылки делаются либо в виде сносок (см. ранее), либо указывается порядковый номер его в библиографическом списке, заключенный в квадратные скобки. Если в одной ссылке необходимо указать несколько источников, то их номера указываются в одних скобках в порядке возрастания через запятую или тире (например, [2, 6, 11] или [3–5]). Если в ссылке необходимо указать дополнительные сведения, то она оформляется следующим образом: [3, c. 16] или [2, c. 76; 5, c. 145–147] или [8, прил. 2].
Примеры библиографического оформления
Отдельный том
Савельев, И. В. Курс общей физики: учеб. пособие для студентов вузов. – 2-е изд., перераб. – М.: Наука, 1982. – Т.3. – 412 с.
Сборник научных трудов
Государственная и местная власть: Сб. науч. тр. – Воронеж: Изд-во Воронеж. гос. ун-та, 2000. – 312 с.
Глава из книги
Ремизов, К. С. Нормирование труда // Гурьянов С. Х., Поляков И. А., Ремизов К. С. Справочник экономиста по труду. – 5-е изд., доп. и перераб. – М., 1982. – Гл. 1. – С. 5–58.
Статья из сборника
Астафьев, Ю.В. Судебная власть: федеральный и региональный уровни / Ю.В. Астафьев, В.А. Панюшкин // Государственная и местная власть: Правовые проблемы: сб. науч. тр. – Воронеж: Лингва, 2000. – С. 75–92.
Статья из журнала
Кряжков, В. Административные суды: какими им быть? / В. Кряжков, Ю. Старилов // Рос. юстиция. – 2001. – №1. – С. 18 – 20.
К вопросу о новом понимании административной юстиции / Ю.Н. Старилов, В.Ю. Шпак, В.В. Макеев, А.А. Паршина // Правоведение. – 2000. – №2. – С. 101–114.
Диссертация
Луус, Р. А. Исследование оборудования с пневмовакуумным приводом для захвата, перемещения и фиксации при обработке пористых и легкоповреждаемых строительных изделий: (На примере силикатобетонных изделий): дисс. … канд. техн. наук. – М., 1982. – 212 с.
Законодательные материалы
Конституция Российской Федерации. – М.: Приор, 2001. – 32 с.
Российская Федерация. Законы. О воинской обязанности и военной службе: ФЗ от 28.03.98 №53–ФЗ. – М.: Ось-89, 2001. – 46 с.
Гражданский процессуальный кодекс РСФСР: [принят третьей сес. Верхов. Совета РСФСР шестого созыва 11 июня 1964 г.]: офиц. текст: по состоянию на 15 нояб. 2001 г. / М-во юстиции Рос. Федерации. – М.: Маркетинг, 2001. – 159 с.
О государственной судебно-экспертной деятельности в Российской Федерации: Федер. закон от 31.05.2001 №73–ФЗ // Ведомости Федер. Собр. Рос. Федерации. – 2001. – №17. – Ст. 940. – С. 11–28.
Нормативные акты и правила
Нормы технологического проектирования угольных и сланцевых шахт. Разд. «Главный участковый водоотлив»: ВНТП 24–81/ Минуглепром СССР: Введ. 01.01.82: Взамен разд. 37.00 ОН и НТП изд. 1973 г. – М., 1981. – 25 с.
Правила безопасности при обслуживании гидротехнических сооружений и гидромеханического оборудования энергоснабжающих организаций: РД 153-34.0-03.205–2001: утв. М-вом энергетики Рос. Федерации 13.04.01: Ввод. в действие с 01.11.01. – М.: ЭНАС, 2001. – 158 с.
Правила устройства и безопасной эксплуатации подъемников (вышек): ПБ 10-256-98: утв. Гостехнадзором России 24.11.98: Обязат. для всех м-в, ведомств, предприятий и орг., независимо от их орг.-правовой формы и формы собственности, а также для индивидуал. предпринимателей. – СПб.: ДЕАН, 2001. – 110 с.
Правила учета электрической энергии: Сб. основных норматив.-техн. док., действующих в обл. учета электроэнергии. – М.: Госэнергонадзор России; Энергосервис, 2002. – 366 с.
СНиП 2.04.08–87. Газоснабжение / Госстрой СССР. – М.: ЦИТП Госстроя СССР, 1988. – 64 с.
Отдельно изданный стандарт
ГОСТ Р 517721–2001. Аппаратура радиоэлектронная бытовая. Входные и выходные параметры и типы соединений. Технические требования. – Введ. 2002–01–01. – М.: Изд-во стандартов, 2001. – 27 с.
ГОСТ 7. 53–2001. Издания. Международная стандартная нумерация книг. – Взамен ГОСТ 7.53–86; введ. 2002–07–01. – Минск: Межгос. совет по стандартизации, метрологии и сертификации. М.: Изд-во стандартов, 2002. – 3 с. – (Система стандартов по информации, библиотечному и издательскому делу).
ГОСТ 11326.5-79. Кабель радиочастотный марки РК 50-7-12. Технические условия. – Взамен ОСТ 11326-71; Введ. 01.01.81 до 01.01.89 // Кабели радиочастотные: Сборник: [ГОСТ 26.0–78 и др.]. – М., 1982. – С. 63–68.
Информационное обеспечение программ комплексной стандартизации продукции. Общие требования. ГОСТ 7.58–90. – Утв. 1990. – М.: Издательство стандартов, 1991. – 9 с.
Представление численных данных о свойствах веществ и материалов в научно-технических документах. Общие требования. ГОСТ 7.54–88. – Взамен ГОСТ 7.33–81, ГОСТ 7.46–84. – Утв. 1988. – М.: Издательство стандартов, 1990. – 8 с.
Сборник стандартов
Кабели радиочастотные: [Сборник]: ГОСТ 11326.0–78, ГОСТ 11326.1–79, ГОСТ 11326.92–79. – М.: Изд-во стандартов, 1982. – 447 с.
Система стандартов безопасности труда: [Сборник]. – М.: Изд-во стандартов, 2002. – 102 с. – (Межгосударственные стандарты).
ГОСТ 10749.1-80 и др. Спирт этиловый технический. Методы анализа: [Сборник]. – Взамен ГОСТ 10749–72; Введ. 01.01.82 до 01.01.87. – М.: Изд-во стандартов, 1981. – 47 с.
Таблица 3
Теплота образования (D  ) и низшая теплота сгорания (Qн) веществ
) и низшая теплота сгорания (Qн) веществ
При температуре 298,15 К
| № п/п | Вещество (агрегатное состояние) | Теплота образования вещества из элементов (D  ),
кДж/моль,
при Т=298 К ),
кДж/моль,
при Т=298 К
| Qн, кДж/моль |
| 1 | СН 4 (г) – метан | -74,85 | 802,32 |
| 2 | С2Н2 (г) – этин (ацетилен) | 226,83 | 1255,61 |
| 3 | С2Н4 (г) – этен (этилен) | 52,30 | 1322,98 |
| 4 | С2Н6 (г) – этан | -84,67 | 1427,87 |
| 5 | С3Н6 (г) – пропен (пропилен) | 20,42 | 1926,46 |
| 6 | С3Н8 (г) – пропан | -103,88 | 2043,99 |
| 7 | С4Н10 (г) – н-бутан | -126,19 | 2658,54 |
| 8 | С5Н12 (г) – пентан | -146,49 | 3272,19 |
| 9 | С6Н6 (г) – бензол | 82,96 | 3302,69 |
| 10 | С6Н12 (г) – циклогексан | -123,18 | 3689 |
| 11 | С7Н8 (г) – толуол | 50,02 | 3949,35 |
| 12 | СО(г) – оксид углерода (II) | -110,56 | - |
| 13 | СО 2 (г) – оксид углерода (IV) | -393,65 | - |
| 14 | СН4 О (г) – метанол | -201,24 | 715,3 |
| 15 | СН2 О (г) – метаналь (формальдегид) | -115,94 | 561,28 |
| 16 | С2Н4О (г) – этаналь (ацетальдегид) | -436,55 | 1104,7 |
| 17 | С2Н6О (г) – этанол | -235,39 | 1371,17 |
| 18 | С3Н6О (г) – ацетон | -216,47 | 1786,37 |
| 19 | С4Н10О (ж) – диэтиловый эфир | 273,31 | 27,27,69 |
| 20 | Н2О (г) – вода | -241,91 | - |
| 21 | HCl (г) – хлороводород | -92,34 | - |
| 22 | СН3Cl (ж) – хлорметан | -82,0 | 645,65 |
| 23 | С6Н5Cl (ж) – хлорбензол | -10,65 | 3431,37 |
| 24 | SO2 (г) – оксид серы (IV) | -297 | - |
| 25 | CS2 (г) – сероуглерод | 237,9 | 1075,11 |
| 26 | СН4ОN2(тв) – мочевина | -333,3 | 544,09 |
| 27 | С5Н5N(г) – пиридин | 140,75 | 2712,35 |
Таблица 4
Таблица 5
Теория горения и взрыва
Задания и методические указания по выполнению
контрольной работы №1 для слушателей факультета заочного обучения
(для всех специальностей)
Редактор: Шмелева Ю.В.
| Формат 60х84 1/16 Тираж 100 экз. | Подписано в печать 30.03.2012 | Бумага писчая Заказ № 4 |
Отделение организации научных исследований экспертно-консалтингового отдела
Ивановского института ГПС МЧС России
153040 г. Иваново, пр. Строителей, 33.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
к выполнению индивидуального задания
по дисциплине
«Теория горения и взрыва»
(для студентов, обучающихся по направлению подготовки
20.03.01 «Техносферная безопасность»
и по специальности 20.05.01 «Пожарная безопасность»)
Рассмотрено на заседании кафедры
естественнонаучных дисциплин
Протокол № от г.
Утверждено на заседании учебно-издательского совета ГОУВПО «Академия гражданской защиты» МЧС ДНР
Протокол № от г.
Донецк
2017
содержание
| Стр. | ||
| ВВЕДЕНИЕ | 4 | |
| 1. | Общие указания по выполнению контрольной работы. | 6 |
| 2. | Правила составления уравнения реакции горения. | 8 |
| 3. | Примеры решения типовых задач | 15 |
| 4. | Тип 1. Расчет материального баланса процесса горения. | 15 |
| 5. | Тип 2. Расчет теплового баланса процесса горения. | 31 |
| 6. | Тип 3. Расчёт концентрационных пределов распространения пламени. | 42 |
| 7. | Тип 4. Расчет температуры вспышки и температурных пределов распространения пламени. | 47 |
| 8. | Тип 5. Расчетное определение температуры самовоспламенения. | 50 |
| 9. | Тип 6. Расчет параметров взрыва парогазовых смесей. | 56 |
| 10. | Варианты Заданий для самостоятельного решения | 59 |
| 11. | ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ | 59 |
| 12. | ЗАДАЧИ | 61 |
| 13. | Список рекомендуемой литературы | 85 |
| 14. | Приложения | 86 |
Введение
Предметом изучения дисциплины «Теория горения и взрыва» являются физические и химические процессы и явления, связанные с горением на стадии его возникновения, развития и прекращения.
Использование знаний о механизмах протекания горения дает возможность управлять горением на пожаре, организовывать профилактические меры против возникновения самовоспламенения, самовозгорания, воспламенения, меры по снижению интенсивности горения на пожаре, его локализации и тушению. Глубокое понимание явления горения обеспечивает успешную борьбу с пожарами.
Цель дисциплины «Теория горения и взрыва» состоит в изучении теории возникновения горения и взрыва, приобретении умений и навыков по практическому применению теоретических знаний.
Задачами дисциплины являются:
- изучение теории теплового и цепного взрыва, зажигания и распространения пламени, детонации и ударных волн;
- изучение условий возникновения и распространения горения, условий перехода горения во взрыв, параметров горения газов, жидкостей и твердых горючих материалов;
- изучение методов расчета объема и состава продуктов горения, теплоты и температуры горения, основных показателей пожарной опасности.
Знание химической и физической сути горения необходимо для успешно работы инженера пожарной безопасности в любой области его деятельности.
Методические рекомендации по выполнению контрольной работы по дисциплине «Теория горения и взрыва» предназначены для использования слушателями факультета заочного обучения и соответствуют:
- федеральному образовательному стандарту высшего профессионального образования третьего поколения;
- современному уровню развития знаний с точки зрения методов исследования, теорий, гипотез, фактов.
Методические рекомендации ориентируют обучающегося на самостоятельное использование научных методов при решении задач теории и практики; содержат методический аппарат, развивающий их творческие способности и организующий самостоятельную работу.
Издание включает все основные типы задач по дисциплине "Теория горения и взрыва". В нем приведены подробные алгоритмы решения типовых задач, даны методические рекомендации по выполнению контрольной работы.
В издании соблюдена Международная система единиц (СИ).
1. Общие указания по выполнению контрольной работы
Контрольная работа является важной формой контроля знаний, развития умений и навыков по дисциплине «Теория горения и взрыва» слушателей факультета заочного обучения. В соответствии с учебным планом слушатели факультета заочного обучения обязаны выполнить одну контрольную работу по дисциплине "Теория горения и взрыва".
Контрольная работа выполняется с целью изучения теоретических вопросов основных разделов курса и освоения методики решения задач, используемых в практической деятельности работников пожарной охраны.
Основные задачи контрольной работы:
- систематизация и закрепление теоретических знаний по основным разделам дисциплины;
- развитие навыков самостоятельной работы;
- совершенствование практических навыков расчета объема и состава продуктов горения, теплоты сгорания и температуры горения;
- совершенствование методов оценки основных показателей пожарной опасности веществ и материалов.
Контрольная работа выполняется слушателем самостоятельно.
В результате выполнения контрольной работы слушатели должны закрепить полученные знания, умения и навыки:
- о физико-химической природе явлений горения и взрыва;
- условий самовоспламенения, самовозгорания и зажигания;
- условий распространения пламени и природы пределов его распространения;
- условий перехода нормального горения во взрыв;
- проведения анализа изменения параметров горения в зависимости от различных факторов.
Контрольная работа выполняется по индивидуальному заданию.
Вариант задания выбирается по двум последним цифрам номера зачётной книжки (Приложение 1 табл. 1).
Контрольная работа выполняется в ученической тетради с полями, содержащей не менее 18 листов. На титульном листе тетради должны быть указаны звание, фамилия, имя, отчество, номер зачётной книжки и домашний адрес слушателя. Работа выполняется аккуратно, разборчивым почерком через строчку. В задании должны быть представлены номер и полный текст вопросов.
Ответы на теоретические вопросы должны быть конкретными, развернутыми, полными. Все рисунки, схемы должны быть выполнены карандашом по линейке, пронумерованы и названы. Задачи должны быть оформлены в соответствии со следующей схемой: номер задачи, формулировка задачи, дано, найти, решение, ответ.
В ответах на вопросы и решении задач даются ссылки на использованные справочные данные и соответствующий литературный источник. Литература, используемая слушателем в процессе выполнения задания, приводится в конце работы. Список литературы составляется с учетом правил оформления библиографии (Приложение 1).
Подробно правила оформления контрольных работ изложены в методических рекомендациях [6].
Выполненная и правильно оформленная контрольная работа представляется преподавателю на рецензию.
Контрольная работа зачитывается, если ответы на вопросы и решение всех задач даны принципиально правильно и отвечают перечисленным выше требованиям. В случае, если работа не зачтена преподавателем, слушатель, после рецензии преподавателя, выполняет работу над ошибками в той же тетради и представляет работу на повторное рецензирование.
Правила составления уравнения реакции горения
При решении практически всех задач по дисциплине «Теория горения и взрыва» необходимо составить уравнение реакции горения. Поэтому очень важно научиться делать это правильно. Изучите изложенные ниже правила составления уравнений реакции горения, разберите примеры.
Правило № 1. В левой части уравнения записываем горючее вещество и окислитель [воздух в виде (O2 + 3,76N2)].
Правило № 2. В правой части уравнения записываем продукты реакции горения, учитывая, что:
углерод (С), содержащийся в горючем веществе, превращается в CO 2,
сера (S), содержащаяся в горючем веществе, превращается в SO 2,
фосфор (Р), содержащийся в горючем веществе, превращается в P 2 O 5,
водород (Н), содержащийся в горючем веществе, превращается в H 2 O,
хлор (Cl), содержащийся в горючем веществе, превращается в HCl,
фтор (F), содержащийся в горючем веществе, превращается в HF,
бром (Br), содержащийся в горючем веществе, превращается в HBr,
йод (I), содержащийся в горючем веществе, превращается в HI,
кислород (О), содержащийся в горючем веществе, входит в состав образующихся оксидов (CO2, SO2, H2O), как и кислород воздуха.
азот (N) при температуре горения ниже 2000 оС не вступает в реакцию. Поскольку в условиях реального пожара температура не превышает значения 1500 – 1600 оС, то принимают, что азот выделяется в свободном виде (N 2). Следовательно, 3,76 моль N2 из воздуха переходят в неизменном виде в продукты горения.
Если горючее вещество содержит другие элементы, то они переходят в высшие оксиды, как указанные выше углерод, водород и фосфор.
Правило № 3. Атомы кислорода, входящие в состав молекул горючего вещества (например, C2H6OS - 2-тиолэтанол), участвуют в реакции горения в качестве окислителя, как кислород воздуха.
Правило № 4. Расставляем коэффициенты в схеме реакции горения для того, чтобы в исходных веществах (левая часть уравнения) и получившихся из них продуктах реакции (правая часть уравнения) содержалось одинаковое количество атомов данного вида. При подсчете количества атомов данного вида стехиометрические коэффициенты и индексы, указывающие количество атомов в молекуле, перемножаются.
Рекомендуется придерживаться следующей последовательности действий.
а) Перед формулой горючего вещества всегда ставится коэффициент 1, так как все расчеты ведут на 1 моль горючего вещества.
б) Перед формулой углекислого газа ставится коэффициент, равный количеству атомов углерода в молекуле горючего вещества.
в) Уравниваем число атомов элементов в правой части уравнения, входящих в состав молекул горючего вещества, за исключением Н, О и N.
г) Уравниваем число атомов водорода, учитывая их содержание в молекулах галогеноуглеводородов и воды.
д) Уравниваем число атомов кислорода, рассчитав их количество в правой части уравнения и учитывая атомы кислорода, содержащиеся в молекуле горючего вещества.
е) Коэффициент, поставленный перед молекулой кислорода, переносим в правую часть уравнения и ставим перед 3,76N2. Уравниваем число атомов азота, содержащихся в молекуле горючего вещества.
Пример 1. Составить уравнение реакции горения С6Н4N2О4 в воздухе.
Решение.
1. В левой части уравнения записываем формулу горючего вещества плюс воздух:
С6Н4 N 2 О4 + (О2 + 3,76 N 2 )
2. В правой части уравнения записываем продукты реакции горения, основываясь на составе молекулы горючего вещества (правило 2):
С6Н4N2О4 + (О2 + 3,76 N2) → СО2 + Н2О + N 2 + 3,76 N 2
Таким образом, углерод (С), содержащийся в горючем веществе, перешел в СО2, водород превратился в воду, кислород вошел в состав воды и углекислого газа, азот выделился в свободном виде - N2. Азот, содержащийся в воздухе, также не участвует в реакции горения и выделяется в неизменном виде – 3,76 N2.
3. Расставляем коэффициенты в схеме реакции горения.
а) Перед формулой горючего вещества всегда ставится коэффициент 1:
1С6Н4N2О4 + (О2 + 3,76 N2) → СО2 + Н2О + N2 + 3,76 N2
б) Перед формулой углекислого газа ставим коэффициент 6, равный количеству атомов углерода в молекуле горючего вещества:
1С6Н4N2О4 + (О2 + 3,76 N2) → 6СО2 + Н2О + N2 + 3,76 N2
в) Уравниваем число атомов элементов, входящих в состав молекулы горючего вещества, за исключением Н и О. В данном случае уравниваем число атомов азота. В состав горючего вещества входят два атома азота. В составе выделившейся молекулы азота тоже два атома, поэтому перед молекулой азота в продуктах реакции ставим коэффициент 1:
1С6Н4N2О4 + (О2 + 3,76 N2) → 6СО2 + Н2О + 1N2 + 3,76 N2
г) Уравниваем число атомов водорода. В составе молекулы горючего вещества четыре атома водорода. В состав молекулы воды входит только два атома. Следовательно, перед формулой воды ставим коэффициент 2:
1С6Н4N2О4 + (О2 + 3,76 N2) → 6СО2 + 2Н2О + 1N2 + 3,76 N2
д) Уравниваем число атомов кислорода. Для этого рассчитываем число атомов кислорода в правой части уравнения:
в составе шести молекул углекислого газа: 6 ∙ 2 = 12;
в составе двух молекул воды: 2 ∙ 1 = 2;
итого: 12 + 2 = 14 атомов кислорода.
Рассчитываем число атомов кислорода в левой части уравнения. В составе молекулы горючего вещества имеется 4 атома кислорода. Вычитаем это число из количества атомов кислорода в правой части уравнения (14 – 4 = 10). Затем делим полученное число на 2 (количество атомов водорода в Н2О) (10/2 = 5) и ставим полученный коэффициент перед воздухом:
1С6Н4N2О4 + 5(О2 + 3,76 N2) → 6СО2 + 2Н2О + 1N2 + 3,76 N2
е) коэффициент 5, поставленный перед воздухом, ставим перед 3,76N2 в правой части уравнения:
1С6Н4N2О4 + 5(О2 + 3,76 N2) = 6СО2 + 2Н2О + 1N2 + 5 ∙ 3,76 N2
Чтобы убедиться в правильности составленного уравнения реакции горения, рассчитаем количество атомов одних и тех же элементов в его правой и левой частях:
С – слева 6, справа 6 ∙ 1 = 6;
Н – слева 4, справа 2 ∙ 2 = 4;
N – слева: в горючем веществе 2, в воздухе 5∙ 3,76 = 18,8, итого 20,8;
справа 2 + 5∙ 3,76 = 20,8;
О - слева: в горючем веществе 4, в воздухе 5 ∙ 2 = 10, итого 14;
справа: в углекислом газе 6 ∙ 2 = 12, в воде 2 ∙ 1 = 2, итого 14.
Вывод: уравнение реакции горения составлено верно.
Пример 2. Составить уравнение реакции горения п-дихлорбензола С4Н4Сl2 в воздухе.
Решение.
1. В левой части уравнения записываем формулу горючего вещества плюс воздух:
С4Н4С l 2 + (О2 + 3,76 N 2 )
2. В правой части уравнения записываем продукты реакции горения, основываясь на составе молекулы горючего вещества (правило 2):
С4Н4Сl2 + (О2 + 3,76 N2) → СО2 + Н2О + HCl + 3,76 N 2
Таким образом, углерод (С), содержащийся в горючем веществе, перешел в СО2, водород превратился в воду, хлор превратился в хлороводород. Азот, содержащийся в воздухе, не участвует в реакции горения и выделяется в неизменном виде – 3,76 N2.
3. Расставляем коэффициенты в схеме реакции горения.
а) Перед формулой горючего вещества всегда ставится коэффициент 1:
1 С4Н4Сl2 + (О2 + 3,76 N2) → СО2 + Н2О + HCl + 3,76 N2
б) Перед формулой углекислого газа ставим коэффициент 4, равный количеству атомов углерода в молекуле горючего вещества:
1С4Н4Сl2 + (О2 + 3,76 N2) → 4СО2 + Н2О + HCl + 3,76 N2
в) Уравниваем число атомов элементов, входящих в состав горючего вещества, за исключением Н, О, N. В данном случае уравниваем число атомов хлора. В состав горючего вещества входят два атома хлора. В составе выделившейся молекулы хлороводорода один атом Cl, поэтому перед молекулой хлороводорода в продуктах реакции ставим коэффициент 2:
1С4Н4Сl2 + (О2 + 3,76 N2) → 4СО2 + Н2О + 2HCl + 3,76 N2
г) Уравниваем число атомов водорода. В составе молекулы горючего вещества четыре атома водорода. Из них два атома водорода уже вошли в состав двух молекул хлороводорода. Оставшиеся два атома водорода перейдут в состав молекулы Н2О. Следовательно, перед молекулой воды ставим коэффициент 1:
1С4Н4Сl2 + (О2 + 3,76 N2) → 4СО2 + 1Н2О + 2HCl + 3,76 N2
д) Уравниваем число атомов кислорода. Для этого рассчитываем число атомов кислорода в правой части уравнения:
в составе четырех молекул углекислого газа: 4 ∙ 2 = 8;
в составе одной молекулы воды: 1 ∙ 1 = 1;
итого: 8 + 1 = 9 атомов кислорода.
Рассчитываем число атомов кислорода в левой части уравнения. В составе молекулы горючего вещества нет атомов кислорода. Следовательно, делим количество атомов кислорода в правой части уравнения на 2 (9 /2 = 4,5) и ставим полученный коэффициент перед воздухом:
1С4Н4Сl2 + 4,5(О2 + 3,76 N2) → 4СО2 + 1Н2О + 2HCl + 3,76 N2
е) коэффициент 4,5, поставленный перед воздухом, ставим перед 3,76N2 в правой части уравнения:
1С4Н4Сl2 + 4,5(О2 + 3,76 N2) = 4СО2 + 1Н2О + 2HCl + 4,5 ∙ 3,76 N2
Пример 3. Составить уравнение реакции горения ацетилена С2Н2 в воздухе.
Решение.
1. В левой части уравнения записываем формулу горючего вещества плюс воздух:
С2Н2 + (О2 + 3,76 N 2 )
2. В правой части уравнения записываем продукты реакции горения, основываясь на составе молекулы горючего вещества (правило 2):
С2Н2 + (О2 + 3,76 N2) → СО2 + Н2О + 3,76 N 2
Таким образом, углерод (С), содержащийся в горючем веществе, перешел в СО2, водород превратился в воду. Азот, содержащийся в воздухе, не участвует в реакции горения и выделяется в неизменном виде – 3,76 N2.
3. Расставляем коэффициенты в схеме реакции горения.
а) Перед формулой горючего вещества всегда ставится коэффициент 1:
1 С2Н2 + (О2 + 3,76 N2) → СО2 + Н2О + 3,76 N2
б) Перед формулой углекислого газа ставим коэффициент 2, равный количеству атомов углерода в молекуле ацетилена:
1 С2Н2 + (О2 + 3,76 N2) → 2СО2 + Н2О + 3,76 N2
в) Уравниваем число атомов элементов, входящих в состав горючего вещества, за исключением Н, О и N. В данном случае таких элементов нет.
г) Уравниваем число атомов водорода. В составе молекулы горючего вещества - два атома водорода. В состав молекулы воды входит также два атома водорода. Следовательно, перед молекулой воды ставим коэффициент 1:
1 С2Н2 + (О2 + 3,76 N2) → 2СО2 + 1Н2О + 3,76 N2
д) Уравниваем число атомов кислорода. Для этого рассчитываем число атомов кислорода в правой части уравнения:
в составе двух молекул углекислого газа: 2 ∙ 2 = 4;
в составе одной молекулы воды: 1 ∙ 1 = 1;
итого: 4 + 1 = 5 атомов кислорода.
Рассчитываем число атомов кислорода в левой части уравнения. В составе молекулы горючего вещества нет атомов кислорода, следовательно, делим количество атомов кислорода в правой части уравнения на 2 (5/2 = 2,5) и ставим данный коэффициент перед воздухом:
1 С2Н2 + 2,5(О2 + 3,76 N2) → 2СО2 + 1Н2О + 3,76 N2
е) коэффициент 2,5, поставленный перед воздухом, ставим перед 3,76N2 в правой части уравнения:
1 С2Н2 + 2,5(О2 + 3,76 N2) = 2СО2 + 1Н2О + 2,5 ∙ 3,76 N2
Пример 4. Составить уравнение реакции горения C6Н8SО3 в воздухе.
Решение.
1. В левой части уравнения записываем формулу горючего вещества плюс воздух: C6Н8SО3 + (О2 + 3,76 N 2 )
2. В правой части уравнения записываем продукты реакции горения, основываясь на составе молекулы горючего вещества (правило 2):
C6Н8SО3 + (О2 + 3,76 N2) → СО2 + Н2О + SO 2 + 3,76 N 2
Таким образом, углерод (С), содержащийся в горючем веществе, перешел в СО2, водород превратился в воду, кислород вошел в состав воды и углекислого газа, сера образовала оксид SO2. Азот воздуха не участвует в реакции горения и выделяется в неизменном виде – 3,76 N2.
3. Расставляем коэффициенты в схеме реакции горения.
а) Перед формулой горючего вещества всегда ставится коэффициент 1:
1 C6Н8SО3 + (О2 + 3,76 N2) → СО2 + Н2О + SO2 + 3,76 N2
б) Перед формулой углекислого газа ставим коэффициент 6, равный количеству атомов углерода в молекуле горючего вещества:
1 C6Н8SО3 + (О2 + 3,76 N2) → 6СО2 + Н2О + SO2 + 3,76 N2
в) Уравниваем число атомов элементов, входящих в состав горючего вещества, за исключением Н, О и N. В данном случае уравниваем число атомов серы. В состав молекулы горючего вещества входит один атом серы. В составе выделившейся молекулы SO2 тоже один атом, поэтому перед молекулой SO2 в продуктах реакции ставим коэффициент 1:
1 C6Н8SО3 + (О2 + 3,76 N2) → 6СО2 + Н2О + 1SO2 + 3,76 N2
г) Уравниваем число атомов водорода. В составе молекулы горючего вещества восемь атомов водорода, а в состав молекулы воды входит только два атома. Следовательно, перед молекулой воды ставим коэффициент 4:
1 C6Н8SО3 + (О2 + 3,76 N2) → 6СО2 + 4Н2О + 1SO2 + 3,76 N2
д) Уравниваем число атомов кислорода. Для этого рассчитываем число атомов кислорода в правой части уравнения:
в составе шести молекул углекислого газа: 6 ∙ 2 = 12;
в составе четырех молекул воды: 4 ∙ 1 = 4;
в составе одной молекулы оксида серы: 1∙ 2 = 2
итого: 12 + 4 + 2 = 18 атомов кислорода.
Рассчитываем число атомов кислорода в левой части уравнения. В составе молекулы горючего вещества имеется 3 атома кислорода. Вычитаем это число из количества атомов кислорода в правой части уравнения (18 – 3 = 15). Делим полученное число на 2 (15 /2 = 7,5) и ставим данный коэффициент перед воздухом:
1 C6Н8SО3 + 7,5(О2 + 3,76 N2) → 6СО2 + 4Н2О + 1SO2 + 3,76 N2
е) коэффициент 7,5, поставленный перед воздухом, ставим перед 3,76N2 в правой части уравнения:
1 C6Н8SО3 + 7,5(О2 + 3,76 N2) = 6СО2 + 4Н2О + 1SO2 +7,5 ∙ 3,76 N2
Примеры решения типовых задач
Тип 1. Расчёт материального баланса процесса горения
Методика расчета объема воздуха, необходимого для сгорания простых
веществ, химических соединений, объема и состава продуктов их горения
А) Твердые вещества (расчет по массе)
1. Составляем уравнение реакции горения вещества в воздухе.
2. Рассчитываем объём, занимаемый 1 кмоль газа при заданных условиях.
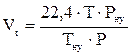 , м3/кмоль;
, м3/кмоль;
где
22,4 м3/кмоль - объем, занимаемый 1 кмоль газа при нормальных условиях.
Рну - атмосферное давление при нормальных условиях, равное 101325 Па.
Тну – температура при нормальных условиях, равная 273К.
Т - заданная температура, К.
Р - заданное давление, Па.
3. Определяем молярную массу горючего вещества (М).
4. Рассчитываем объем воздуха, необходимый для сгорания горючего вещества.
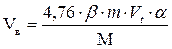 , м3;
, м3;
где
4,76 - число кмоль воздуха (1 кмоль О2 + 3,76 кмоль N2);
β - стехиометрический коэффициент, стоящий перед кислородом в уравнении реакции горения.
m – масса горючего вещества, кг;
Vt – объем, занимаемый 1 кмоль воздуха при заданных условиях, м3/кмоль;
М - молярная масса горючего вещества, кг/кмоль;
a - коэффициент избытка воздуха.
5. Определяем число кмоль кислорода и азота в избытке воздуха.
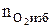 = b(a - 1), кмоль;
= b(a - 1), кмоль;
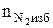 =3,76 × b(a - 1), кмоль.
=3,76 × b(a - 1), кмоль.
6. Рассчитываем общее количество вещества продуктов горения
 , кмоль;
, кмоль;
7. Находим объем продуктов горения по формуле:
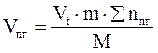 , м3
, м3
где
Vt – объем, занимаемый 1 кмоль продуктов горения при заданных условиях, м3/кмоль;
m - масса горючего вещества, кг;
М - молярная масса горючего вещества, кг/кмоль;
Snпг - количество вещества продуктов горения, кмоль.
8. Рассчитываем объёмы компонентов продуктов горения по формуле:
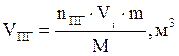
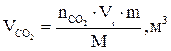
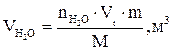
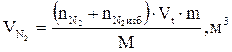
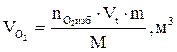 и т.д.
и т.д.
9. Рассчитываем мольный процентный состав продуктов горения, принимая общее число кмоль продуктов горения за 100 %.
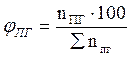 , мол. %;
, мол. %;
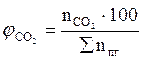 , мол. %;
, мол. %; 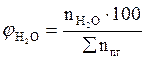 , мол. %;
, мол. %;
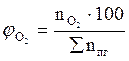 , мол. %;
, мол. %; 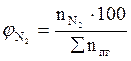 , мол. % и т.д.
, мол. % и т.д.
Аналогично рассчитывается объемный процентный состав продуктов горения. Численное значение объемных процентов при этом будет совпадать с мольным процентным составом продуктов горения.
Б) Газообразные вещества (расчет по объему):
1. Составляем уравнение реакции горения вещества в воздухе.
2. Рассчитываем объем воздуха, необходимого для сгорания вещества.
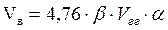 , м3,
, м3,
где
Vв - теоретический объем воздуха необходимый для сгорания вещества, м3.
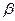 - стехиометрический коэффициент при кислороде в уравнении реакции горения.
- стехиометрический коэффициент при кислороде в уравнении реакции горения.
a - коэффициент избытка воздуха.
Vгг - заданный объем горючего газа, м3.
3. Определяем число кмоль кислорода и азота в избытке воздуха.
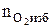 = b(a - 1), кмоль;
= b(a - 1), кмоль;
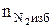 =3,76 × b(a - 1), кмоль.
=3,76 × b(a - 1), кмоль.
4. Рассчитываем общее количество вещества продуктов горения
 , кмоль.
, кмоль.
5. Находим общий объем продуктов горения по формуле:
Vпг = Vгг × ånпг, м3
где
Vгг - заданный объем горючего газа, м3;
ånпг- общее количество вещества продуктов горения, кмоль.
6. Рассчитываем объём компонентов продуктов горения по формуле:
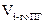 = Vгг×
= Vгг× 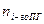 , м3;
, м3;
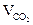 = Vгг×
= Vгг× 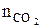 , м3;
, м3; 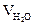 = Vгг×
= Vгг× 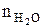 , м3;
, м3;
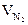 = Vгг×
= Vгг× 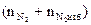 , м3
, м3 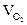 = Vгг×
= Vгг× 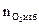 , м3 и т.д.
, м3 и т.д.
7. Рассчитываем мольный процентный состав продуктов горения, исходя из общего числа кмоль продуктов горения.
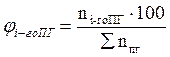 , мол. %;
, мол. %;
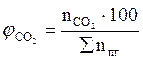 , мол. %;
, мол. %; 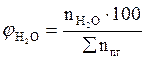 , мол. %;
, мол. %;
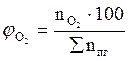 , мол. %;
, мол. %; 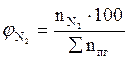 , мол. % и т.д.
, мол. % и т.д.
Методика расчёта объёма воздуха, необходимого для горения сложных веществ переменного состава, расчет объема и состава продуктов их горения
А) Твёрдые и жидкие вещества (расчет по массе).
1. Рассчитываем объём воздуха, необходимый для сгорания заданной массы вещества при нормальных условиях.
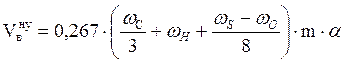 , м3
, м3
где
wС, wН, wS, wO - массовые доли углерода, водорода, серы и кислорода в горючем веществе, %;
m – масса горючего вещества, кг;
a - коэффициент избытка воздуха.
2. Определяем объём воздуха при заданных условиях:
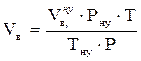 , м3,
, м3,
где
Рну - атмосферное давление при нормальных условиях, Па;
Тну - температура при нормальных условиях, К;
Р - заданное давление, Па;
Т - заданная температура, К.
3. Рассчитываем объём избытка воздуха, находящегося в зоне горения, при нормальных условиях.
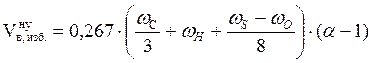 , м3
, м3
4. Используя коэффициенты, указанные в табл. 1 приложения 2, определяем объёмы компонентов продуктов горения (оксида углерода (IV), водяного пара, оксида серы (IV), оксида фосфора (V), азота и кислорода), образующиеся при сгорании 1 кг горючего вещества при нормальных условиях (  , м3).
, м3).
5. Определяем общий объём продуктов горения, выделяющихся при сгорании 1 кг вещества в нормальных условиях, суммируя объёмы компонентов продуктов горения:
 , м3.
, м3.
6. Пересчитываем общий объём продуктов горения при нормальных условиях на заданное количество вещества
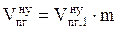 , м3
, м3
где
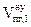 - общий объём продуктов горения, выделяющихся при сгорании 1 кг горючего вещества в нормальных условиях, м3;
- общий объём продуктов горения, выделяющихся при сгорании 1 кг горючего вещества в нормальных условиях, м3;
m - масса горючего вещества, кг.
7. Находим объём продуктов горения при заданных условиях.
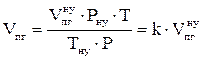 , м3,
, м3,
где
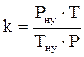 .
.
8. Находим объём компонентов продуктов горения при заданных условиях по формулам:
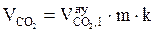 , м3;
, м3; 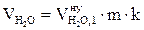 , м3;
, м3; 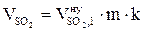 , м3;
, м3;
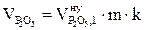 , м3;
, м3; 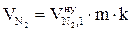 , м3;
, м3; 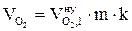 , м3.
, м3.
9. Объемный процентный состав компонентов продуктов горения определяется из следующих соотношений, принимая их общий объём 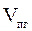 за 100 %.
за 100 %.
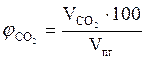 ,об. %;
,об. %; 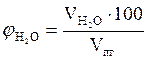 , об. %;
, об. %;
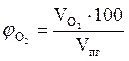 , об. %;
, об. %; 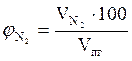 , об. % и т.д.
, об. % и т.д.
Б) Смесь газов (расчет по объему).
1. Составляем уравнения реакций горения горючих компонентов газовой смеси в воздухе и определяем стехиометрические коэффициенты b.
2. Определяем объём воздуха, необходимый для сгорания заданного объёма газовой смеси по формуле:
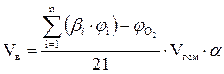 , м3;
, м3;
где
bi- стехиометрический коэффициент перед кислородом i-ого горючего компонента смеси;
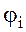 - концентрация i-ого горючего компонента смеси, об. %;
- концентрация i-ого горючего компонента смеси, об. %;
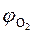 - концентрация кислорода в газовой смеси, об. %;
- концентрация кислорода в газовой смеси, об. %;
Vгсм- заданный объём газовой смеси, м3.
a - коэффициент избытка воздуха.
3. Если заданный коэффициент избытка воздуха α > 1, то определяется объём избытка воздуха при сгорании 1 м3 газовой смеси
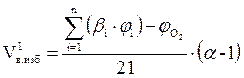 , м3.
, м3.
4. Используя коэффициенты, указанные в табл. 2 приложения 2, находим объём компонентов продуктов горения, образующихся при сгорании 1 м3 смеси ( 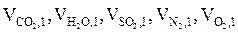 ).
).
5. Рассчитываем общий объём продуктов, выделяющихся при сгорании 1 м3 горючей смеси, суммируя полученные значения объёмов компонентов продуктов горения:
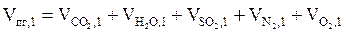 , м3.
, м3.
6. Пересчитываем полученное значение на заданный объём горючей смеси:
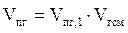 , м3.
, м3.
7. Находим объём каждого из компонентов продуктов горения:
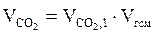 , м3;
, м3;
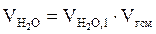 , м3;
, м3;
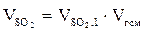 , м3 и т.д.
, м3 и т.д.
8. Рассчитываем объемный состав компонентов продуктов горения по формулам:
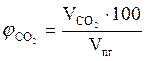 ,об. %, мол. %;
,об. %, мол. %; 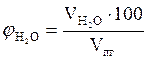 , об. %, мол. %;
, об. %, мол. %;
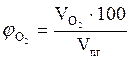 , об. %, мол. %;
, об. %, мол. %; 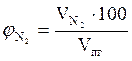 , об. %, мол. % и т.д.
, об. %, мол. % и т.д.
Задача 1. Рассчитать объём воздуха, необходимый для полного сгорания 5 кг хлорбензола; общий объём образовавшихся продуктов горения и их объемный процентный состав, при температуре 12 0С и давлении 101250 Па, если избыток воздуха составляет 15 %.
Дано:
C6H5Cl – хлорбензол;
m = 5 кг;
t = 120С;
Р = 101250 Па;
избыток воздуха = 15%.
Найти: Vв, Vпг, jпг ?
Решение:
1. Используя правила, изложенные в разделе 2 настоящего пособия, составляем уравнение реакции горения хлорбензола в воздухе и определяем коэффициент b (стехиометрический коэффициент перед кислородом).
C6H5Cl + 7(О2 + 3,76N2) ® 6СО2 + 2Н2О + НCl + 7×3,76N2
b = 7
2. Рассчитываем объём, занимаемый 1 кмоль воздуха при заданных условиях.
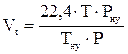 , м3/кмоль;
, м3/кмоль;
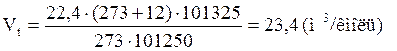
3. Рассчитываем молярную массу хлорбензола.
М (C6H5Cl) = 12 × 6 + 1 × 5 + 35,5 × 1 = 112,5 кг/кмоль
4. Рассчитываем объём воздуха, необходимый для полного сгорания заданной массы хлорбензола.
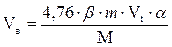 , м3;
, м3;
По условию задачи избыток воздуха составляет 15 %. В этом случае коэффициент избытка воздуха (a) на 0,15 больше единицы. Следовательно, a = 1,15.
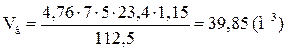
5. Определяем избыточное количество вещества кислорода и азота.
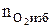 = b(a - 1), кмоль;
= b(a - 1), кмоль; 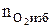 = 7(1,15 - 1) = 1,05 (кмоль)
= 7(1,15 - 1) = 1,05 (кмоль)
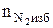 =3,76 × b(a - 1), кмоль;
=3,76 × b(a - 1), кмоль; 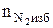 =3,76 × 7(1,15 - 1) = 3,95 (кмоль)
=3,76 × 7(1,15 - 1) = 3,95 (кмоль)
6. Рассчитываем общее количество вещества продуктов горения.
ånп.г= 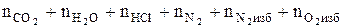 , кмоль;
, кмоль;
ånп.г= 6 + 2 + 1 + 26,32 + 3,95 + 1,05 = 40,32 (кмоль)
7. Определяем общий объём образующихся продуктов горения.
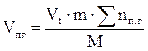 , м3;
, м3;
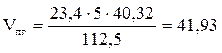 (м3)
(м3)
8. Рассчитываем объём компонентов продуктов горения.
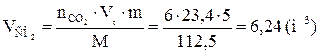
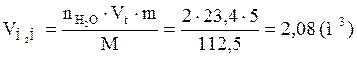
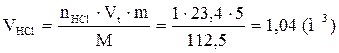
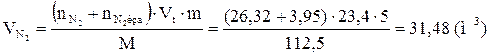
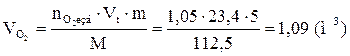
9. Определяем объемный состав компонентов продуктов горения. Принимаем общее количество вещества продуктов горения за 100 %.
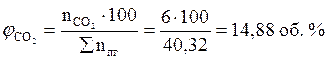
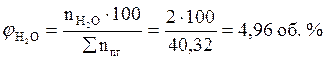
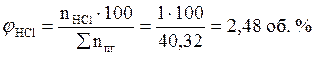
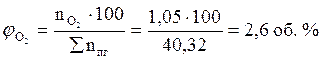
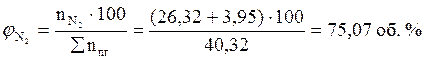
Ответ: для полного сгорания 5 кг хлорбензола в заданных условиях необходимо 39,85 м3 воздуха, при этом выделяется 41,93 м3 продуктов горения состава: оксид углерод (IV) - 6,24 м3 (14,88 %), вода - 2,08 м3 (4,96 %), хлороводород - 1,04 м3 (2,48 %), кислород - 1,09 м3 (2,6 %), азот - 31,48 м3 (75,07 %).
Задача 2. Рассчитать объём воздуха, необходимый для сгорания 17 м3 ацетилена, объём и объемный состав продуктов горения, если коэффициент избытка воздуха составляет 1,5.
Дано:
С2Н2 – ацетилен;
Vг.г. = 17 м3;
a = 1,5.
Найти: Vв, Vп.г., jп.г. ?
Решение:
1. Составляем уравнение реакции горения ацетилена в воздухе и определяем коэффициент b (см. правила составления реакции горения в разделе 2).
C2H2 + (2,5О2 + 3,76N2) ® 2СО2 + Н2О + 2,5×3,76N2
b = 2,5
2. Рассчитываем объём воздуха, необходимый для полного сгорания заданного объёма ацетилена.
Vв = 4,76 × b × Vгг × a, м3;
Vв = 4,76 × 2,5 × 17 × 1,5 = 303,45 (м3)
3. Определяем количество вещества кислорода и азота в избытке воздуха.
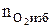 = b× (a - 1) = 2,5× (1,5 - 1) = 1,25 (кмоль)
= b× (a - 1) = 2,5× (1,5 - 1) = 1,25 (кмоль)
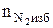 = 3,76×b× (a - 1) =3,76×2,5× (1,5 - 1)= 4,7 (кмоль)
= 3,76×b× (a - 1) =3,76×2,5× (1,5 - 1)= 4,7 (кмоль)
4. Рассчитываем общее количество вещества продуктов горения.
ånпг = 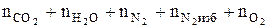 , кмоль;
, кмоль;
ånпг = 2 + 1 + 9,4 + 4,7 + 1,25 = 18,35 (кмоль)
5. Определяем общий объём образующихся продуктов горения.
Vпг = Vгг × Snпг = 17 × 18,35 = 311,95 (м3)
6. Рассчитываем объём компонентов продуктов горения.
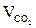 = Vгг ×
= Vгг × 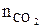 , м3;
, м3; 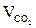 = 17 × 2 = 34 (м3)
= 17 × 2 = 34 (м3)
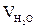 = Vгг ×
= Vгг × 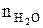 , м3;
, м3; 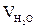 = 17 × 1 = 17 (м3)
= 17 × 1 = 17 (м3)
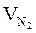 = Vгг ×
= Vгг × 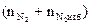 , м3
, м3 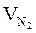 = 17 × (9,4 + 4,7) = 239,7 (м3)
= 17 × (9,4 + 4,7) = 239,7 (м3)
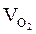 = Vгг ×
= Vгг × 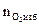 , м3
, м3 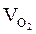 = 17 × 1,25 = 21,25 (м3)
= 17 × 1,25 = 21,25 (м3)
7. Рассчитываем объемный состав продуктов горения, исходя из общего числа кмоль продуктов горения.
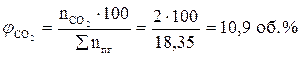 ;
;
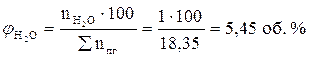 ;
;
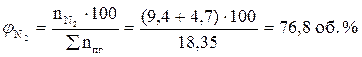 ;
;
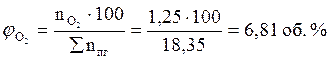 .
.
Ответ: для полного сгорания 17 м3 ацетилена в заданных условиях необходимо 303,45 м3 воздуха, при этом выделяется 311,95 м3 продуктов горения, состава: оксид углерод (IV) – 34 м3 (10,9%), вода – 17 м3 (5,45%), азот - 239,7 м3 (76,8%), кислород - 21,25 м3 (6,81%).
Задача 3. Рассчитать объём воздуха, необходимый для сгорания 2 кг каменного угля, имеющего состав в %: углерод - 79,81; водород - 5,63; кислород - 10,12; сера - 2,71; зола - 1,73. Если температура окружающей среды 17 оС, давление 100658 Па, коэффициент избытка воздуха 1,5. Определить объём и процентный состав продуктов горения.
Дано: каменный уголь состава:
w(С) - 79,81%; w(Н) - 5,63%; w(О) - 10,12%; w(S) - 2,71%; w(зола) - 1,73% .
m = 2 кг;
a = 1,5;
t = 17 оС;
Р = 100658 Па.
Найти:  ;
;  ; j(п.г.)?
; j(п.г.)?
Решение:
1. Рассчитываем объём воздуха, необходимый для сгорания заданной массы каменного угля при нормальных условиях.
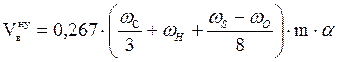 , м3;
, м3;
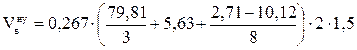 = 25,07 (м3)
= 25,07 (м3)
2. Рассчитываем объём воздуха, необходимый для сгорания каменного угля, при заданных условиях.
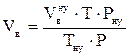 , м3;
, м3;
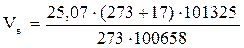 = 26,81 (м3)
= 26,81 (м3)
3. Рассчитываем объём избытка воздуха, находящегося в зоне горения.
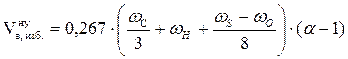 , м3
, м3
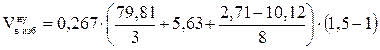 = 4,17 (м3)
= 4,17 (м3)
4. Определяем объём и состав продуктов горения 1 кг каменного угля при нормальных условиях, используя табл.1 приложения 2.
| № п/п | Элементный состав вещества на 1 кг |  ,
м3 ,
м3
|  ,
м3 ,
м3
|  ,
м3 ,
м3
| 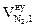 ,
м3 ,
м3
| 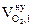 ,
м3 ,
м3
|
| 1 | mC = 0,7981 кг | 1,87 × 0,7981 = 1,492 | ____ | ____ | 7,02 × 0,7981 = 5,603 | ____ |
| 2 | mH = 0,0563 кг | ____ | 11,2 × 0,0563 = 0,6306 | ____ | 21,06 × 0,0563 = 1,186 | ____ |
| 3 | mO = 0,1012 кг | ____ | ____ | ____ | -2,63 × 0,1012 = - 0,266 | ____ |
| 4 | mS = 0,0271 кг | ____ | ____ | 0,7 × 0,0271 = 0,019 | 2,63 × 0,0271 = 0,071 | ____ |
| 5 | Избыток воздуха | ____ | ____ | ____ | 4,17 × 0,79 = 3,29 | 4,17 × 0,21 = 0,88 |
| 6 | Всего | 1,492 | 0,630 | 0,019 | 9,884 | 0,88 |
Примечание: при заполнении графы "элементный состав вещества на 1 кг" следует перевести массовую долю каждого элемента в доли единицы (wС = 79,81 %, что соответствует массе углерода mC = 0,7981 кг); жирным выделены постоянные коэффициенты, которые взяты из таблицы 2 приложения 2.
5. Определяем объём компонентов продуктов горения 1 кг каменного угля при нормальных условиях.
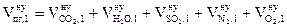 , м3;
, м3;
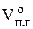 = 1,4924 + 0,6306 + 0,019 + 9,8835 + 0,88 = 12,91 (м3)
= 1,4924 + 0,6306 + 0,019 + 9,8835 + 0,88 = 12,91 (м3)
6. Рассчитываем общий объём продуктов горения, выделившихся при сгорании 2 кг каменного угля при нормальных условиях.
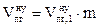 , м3 ;
, м3 ; 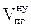 = 12,91 × 2 = 25,81 (м3)
= 12,91 × 2 = 25,81 (м3)
7. Определяем общий объём продуктов горения каменного угля, образующихся при заданных условиях.
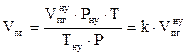 , м3;
, м3; 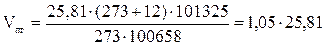 =27,6 (м3)
=27,6 (м3)
8. Рассчитываем объём компонентов продуктов горения каменного угля при заданных условиях.
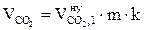 = 1,492 2 1,05 = 3,19 (м3);
= 1,492 2 1,05 = 3,19 (м3);
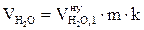 = 0,6306 2 1,05 = 1,35 (м3);
= 0,6306 2 1,05 = 1,35 (м3);
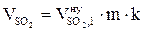 = 0,019 2 1,05 = 0,04 (м3);
= 0,019 2 1,05 = 0,04 (м3);
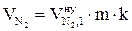 = 9,8835 2 1,05 = 21,14 (м3);
= 9,8835 2 1,05 = 21,14 (м3);
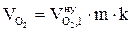 = 0,88 2 1,05 = 1,88 (м3);
= 0,88 2 1,05 = 1,88 (м3);
где
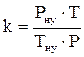 .
.
9. Находим объемный процентный состав компонентов продуктов горения.
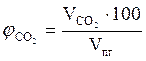 , %;
, %; 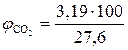 = 11,56 %
= 11,56 %
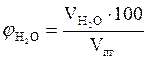 , %;
, %; 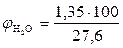 = 4,89 %
= 4,89 %
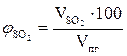 , %;
, %; 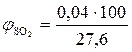 = 0,14 %
= 0,14 %
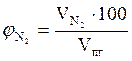 , % ;
, % ; 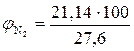 = 76,59 %
= 76,59 %
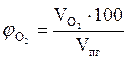 , %
, % 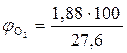 = 6,81 %
= 6,81 %
Ответ. Для полного сгорания 2 кг каменного угля в заданных условиях необходимо 26,81 м3 воздуха, при этом выделяется 27,6 м3 продуктов горения, состава: оксид углерода (IV) - 3,19 м3 (11,56 %), вода - 1,35 м3 (4,89 %), оксид серы (IV) - 0,04 м3 (0,14 %), азот - 21,14 м3 (76,59 %), кислород - 1,88 м3 (6,81 %).
Задача 4. Рассчитать объём воздуха, необходимый для сгорания 23 м3 смеси газов состава в % (об.): метан – 89 %; этан - 4,7 %; пропан – 3,7 %; оксид углерода (IV) - 2,4 %; азот - 0,2 %. Определить объём и процентный состав продуктов горения, если коэффициент избытка воздуха равен 1,5.
Дано: смесь газов следующего состава:
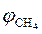 = 89 %;
= 89 %; 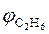 = 4,7 %;
= 4,7 %; 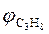 = 3,7 %;
= 3,7 %; 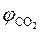 = 2,4 %;
= 2,4 %; 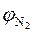 = 0,2 %.
= 0,2 %.
Vгсм = 23 м3,
a = 1,5.
Найти: Vв, Vпг, jпг ?
Решение:
1. Составляем уравнения реакции горения горючих компонентов газовой смеси в воздухе и определяем стехиометрические коэффициенты b. Среди газов, входящих в состав смеси, гореть способны метан СН4 (обозначим его цифрой 1), этан С2Н6 (2) и пропан С3Н8 (3). Азот до 2000 0С в реакцию горения не вступает, углекислый газ также не горит.
СН4 + 2(О2 + 3,76 N2) ® СО2 + 2Н2О + 7.52 N2 b1 = 2
С2Н6 + 3,5(О2+ 3,76 N2) ® 2СО2 + 3Н2О + 3,16 N2 b2= 3,5
С3Н8 + 5(О2 + 3,76 N2) ® 3СО2 + 4Н2О + 18.80 N2 b3= 5
2. Определяем объём воздуха, необходимый для сгорания заданного объёма газовой смеси.
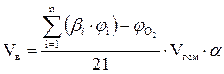 , м3;
, м3;
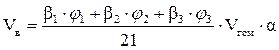 =
= 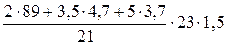 = 349,85 (м3)
= 349,85 (м3)
3. Рассчитываем объём избытка воздуха, находящегося в зоне горения, при сгорании 1 м3 газовой смеси.
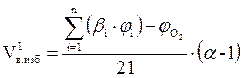 , м3;
, м3;
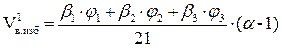 =
= 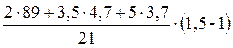 = 5,07 (м3)
= 5,07 (м3)
4. Определяем объём и состав продуктов горения 1 м3 газовой смеси, используя табл. 2 приложения 2. Для этого заполним таблицу:
| № п/п | Состав 1 м3 газовой смеси | 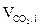 , м3 , м3
| 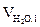 , м3 , м3
| 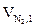 , м3 , м3
| 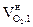 , м3 , м3
|
| 1 | 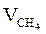 = 0,89 м3 = 0,89 м3
| 1×0,89=0,89 | 2×0,89=1,79 | 7,52×0,89=6,69 | ____ |
| 2 | 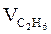 = 0,047м3 = 0,047м3
| 2×0,047=0,09 | 3×0,047=0,14 | 13,16×0,047=0,62 | ____ |
| 3 | 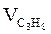 = 0,037м3 = 0,037м3
| 3×0,037=0,11 | 4×0,037=0,15 | 16,8×0,037=0,62 | ____ |
| 4 | 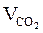 = 0,024 м3 = 0,024 м3
| 1×0,024=0,02 | ____ | ____ | ____ |
| 5 | 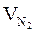 = 0,002 м3 = 0,002 м3
| ____ | ____ | 1×0,002=0,002 | ____ |
| 6 | Избыток воздуха | ____ | ____ | 5,07×0,79=4,01 | 5,07×0,21=1,06 |
| 7 | Всего | 1,11 | 2,08 | 11,94 | 1,06 |
5. Определяем объём продуктов горения 1 м3 смеси газов.
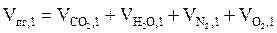 = 1,11 + 2,08 + 11,94 + 1,06 = 16,19 (м3)
= 1,11 + 2,08 + 11,94 + 1,06 = 16,19 (м3)
6. Рассчитываем объём продуктов горения 23 м3 природного газа.
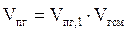 = 16,19 ×23 = 372,37 (м3)
= 16,19 ×23 = 372,37 (м3)
7. Рассчитываем объём каждого из компонентов продуктов горения.
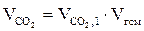 = 1,11 × 23 = 25,53 (м3);
= 1,11 × 23 = 25,53 (м3);
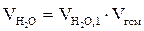 =2,08 × 23 = 47,84 (м3);
=2,08 × 23 = 47,84 (м3);
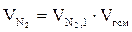 = 11,94 × 23 = 274,62 (м3);
= 11,94 × 23 = 274,62 (м3);
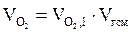 = 1,06 × 23 = 24,38 (м3).
= 1,06 × 23 = 24,38 (м3).
8. Определяем объемный состав компонентов продуктов горения.
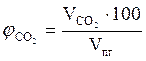 =
= 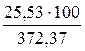 = 6,85 %
= 6,85 %
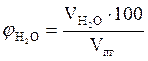 =
= 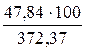 = 12,85 %.
= 12,85 %.
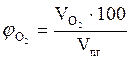 =
= 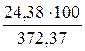 = 6,55 %
= 6,55 %
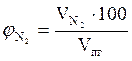 =
= 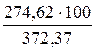 = 73,75 %
= 73,75 %
Ответ. Для полного сгорания 23 м3 газовой смеси в заданных условиях необходимо 349,85 м3 воздуха, при этом выделяется 372,37 м3 продуктов горения, состава: оксид углерода (IV) - 25,53 м3 (6,85 %), вода - 47,84 м3 (12,85 %), азот - 274,62 м3 (73,75 %), кислород - 24,38 м3 (6,55 %).
Дата: 2019-02-24, просмотров: 372.