Составляет 40-42%от массы тела. Основная f-обеспечить подвижность путем сокращения и последующего расслабления. При этом осущ.работа, связанная с превращением химической Е в механическую.
Мышцы: 1)гладкие(непроизвольные) 2)П/п: 1.скелетные(произвольные), 2.сердечная(непроизв.)
Имеют разный механизм регуляции.
Гладкие иннервируются ВНС;представлены в киш.тракте, мочев.пузыре, кров.сосудах, матке, мочеточнике, семявыв.протоке. Клетки одноядерные, веретенообразные, актин(А)расположен прод.тяжами, формируя многочисл.тонкте нити. В расслаб.мышце миозин(М)в неполяриз.форме. Полимеризация М(формирование толстых нитей)просих.в процессе сокращения.
Скелет.мышцы сокр-ся с большей скоростью, иннерв.соматич.НС; кл.серд.мышцы не явл.многоядер. и соед.с помощью вставочн.дисков(близки к z-дискам по f)
Поперечно-полосатые.
До 50мм в длину, толщиной до 50мкм;это многоядерные кл., т.к. возникли в онтогенезе в рез-те слияния неск.кл. Имеют: 1)мембр,(сарколемма) 2)цитоплазму(сарко-), 3)органеллы, ответственные за сокращение=миофибриллы, 4)ЭПР(депо Са), 5)глк и гликолитич.ферменты, АТФ и креатинфостат, 6)Б дистрофин.
Саркомер – повтор.элемент. полоса А, полоса Н, z-линия, М-линия.
Толстые d=15нм, содерж.М; тонкие d=3нм, содерж.А, тропомиозин, тропонин.
К z-пластинке присоед.концы:*ТМ, *Тинина – Б., соед.толстые филаменты с z-дисками, *А, кот.присоед.концы F-актина.
В М-линиях –миомезин – соед. «хвосты» М и КФкиназа.
Химич. состав
75-80%-Н2О
20-25%-сухой остаток: *85%-Б: стромин(коллаген и эластин), саркоплазматич.Б(миоальбумин, миоглобулин, ферменты гликолиза и гликогенолиза), сократит.(А,М,ТМ,Фн); *15%-другие: N-содерж.(глутамин, карнозин, ансерин, креатин, креатинин, своб.АК), Р-содерж. (КФ, АТФ и др.нуклеотиды), Л(фосфоглицериды, ХС), мин.в-ва, У(осн. – глк)
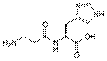
Карнозин:
Мышечные Белки:
- Миозин 520кДа
50% от всех миофибриллярных Б
Гл. f – при физ.значениях ионной силы, pH, Са2+ мол-лы М спонтанно обр.волокна
- обл. АТФ-азной активностью: АТФ+Н2О ⇄ АДФ + Фн + Н
- М связ. F-актин →мыш.сокращение.
Строение: 6 попарно идентич.субъед.; 2 тяж.и 4 легкие цепи
Глоб.головки имеют центры связ-я с АТФ и 2 участка – с лег.цепями. Головки прикреп.с помощью шарнира – деспирализ.участок. В филаменте они обращ.наружу, а хвосты стыкуются в центре линии М.
- А 42 кДа
20% от всех Б мышц
Актин+АТФ⇄ (Mg2+)F-актин –АДФ-Фн(АТФ для конформац.изменений)
- Тропомиозин 65кДа, 4-30%(в п/п мышцах мало, в гл.-много)
1 мол. ТМ на 7 мол.А→устойч.стра-ра тонк.филамент.
Тропониновый комплекс: -Тн-Т→обеспеч.связь с ТМ, -Тн-J→ингибир.АТФазную акт-ть М, -Тн-L→связ.Са2+
Субъед. J,L имеют глобуляр.головку, а Т-длинный хвост, кот.связ. с ТМ и опред.положение всего комплекса на тонкой филаменте.
Механизм мышечного сокращения.
При взаимод.нитей М и А происх.преобр-е хим. Е от макроэрг.связей в механич. Е.
1 стадия: гидролиз АТФ М-ом идет быстро
2 ст.: продукты р-ции – АДФ, Фн – высвоб.мелденно и связаны с головкой М, кот.может вращаться под большими углами.
3 ст.: при поступ.сигнала сокр-я головки М прочно связ.с А-филаментом под углом 90→обр-е актомиозин-АДФ и высвоб-ся Фн.
4 ст.: поскольку наим.Е актомиоз.связь имеет при угле 45, то происх.наклон миоз.головки на 45, что сопровожд.выделением АДФ и скольжением тонк.А-нити вдоль толстой→укорочение саркомера на 10-15нм, а затем новая АТФ связ-ся с М-головками в актомиозине→отсоединение А от М и возвращает систему к 1 фазе.
КПД ок.50% - довольно высок.
Источники АТФ:
Кол-во АТФ такое незначит., что его хватило бы на долю секунды→система регенерации.
1)КФК-реакция: КФ+АДФ(КФК)⇄К+АМФ
2)с помощью аденилаткиназы=миокиназы: АДФ+АДФ(Mg2+)⇄АТФ +АМФ
3)гликолиз и гликогеноллиз – в белых мышцах преобл.анаэробный гликолиз(быстрые мышцы)
4)аэробные процессы, связанные с окислит.фосфорилированием(преобл.в красных – медленных м.): аэробгликолиз, ЦТК, окисление ЖК, исп-е кетоновых тел.
Основные субстраты энегр.обмена:
1. В покоящ.мышцах – своб.ЖК и кет.тела
2. При умер. мыш. нагрузке – в доп.к ним: Глю→ПВК→АцКоА→ЦТК
3. При макс.мыш.наргузке – глк(путем анаэро.гликогенолиза до лактата)
Помогают дипептиды карнозина и ансерина.
БИЛЕТ № 35
Современные представления о строении белков. Уровни структуры белковой молекулы. Видовая специфичность белков. Конформация белковой молекулы (вторичная и третичная структуры). Типы связей в белках. Четвертичный уровень структуры.
Первичная структура белка: последовательность а/к в полипептидной цепи соединенные пептидной связью (ковалентная). Последовательность а/к, их количество, лежат в основе первичной структуры белка, в которой заложена информация о последующих уровнях структуры и биологических функциях белка. Вторичная структура белка: 1) а-спираль имеет жесткие параметры – правозакрученная спираль, шаг спирали между двумя витками 3,6 а/к, высота 0,54 нм, конформация повторяется через 5 витков или 18 а/к, многочисленные Н связи между группами NH и С-О от первой к четвертой а/к-те. 2) бета структура – слоисто-складчатая, удерживается водородными связями, пептидные цепи располагаются антипараллельно. 3) неупорядоченная нерегулярная структура – а+в структуры – перекрест где встречаются а/ альфа и бета. Третичная структура белка: упаковка полипептидной цепи в пространстве. 1) в фибриллярных белках – коллаген и эластин – 3 а-спираль, бета слой (актин, миозин) 2) в глобулярных белках – все три типа вторичных структур. Два типа связи в третичной структуре: 1) ковалентная – пептидная и дисульфидная 2) слабые связи – многочисленные водородные связи, ионные взаимодействия. Упаковка идет таким образом, что гидрофобные связи находятся ниже (по типу жирной капли) – легко разрываются при изменении рН, температуры, ионов. Четвертичная структура – это ассоциация 4х субъединиц, которые определенным образом ориентированны в пространстве относительно друг друга. Для того чтобы Нb удерживался в форме тетрамера возникают связи между одинаковыми полипептидными цепочками, а также между разными полипептидными цепочками. Субъединицы расположены в пространстве таким образом, что в центре Нb образуется центральная полость (впадина), в которой находятся 2,3-дифосфоглицириновая кислота. По мере присоединения кислорода к молекуле гемоглобина конформация четвертичной структуры меняется, при этом альфа цепи сближаются, бета расходятся, т.о. молекула Нb как бы дышит Присоединяется одна молекула кислорода к первой субъединице, что приводит к конформационным изменениям других субъединиц.
Переваривание и всасывание простых и сложных липидов в желудочно-кишечном тракте. Основные этапы: эмульгирование, липолиз, мицеллярная и мукозная стадии, транспорт продуктов гидролиза, их использование.
Расщепление липидов происходит в 12—перстной кишке, куда поступают липаза с соком поджелудочной железы и конъюгированные желчные кислоты в составе желчи. Эмульгирование жира — обязательное условие для переваривания, так как делает гидрофобный субстрат более доступным для действия гидролитических ферментов — липаз. Эмульгирование происходит при участии желчных кислот , которые из—за своей амфифильности, окружают каплю жира и снижают поверхностное натяжение, что приводит к дроблению капли.
Гидролиз жира осуществляется при участии панкреатической липазы , которая, сорбируясь на поверхности капель жира, расщепляет эфирные связи в триацилглицеринах (ТАГ). Жирные кислоты отщепляются прежде всего из —положения. В результате образуется — диацилглицерин, затем —моноацилглицерин, который является основным продуктом гидролиза: 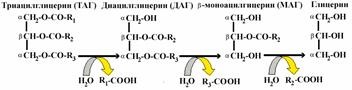
Всасывание происходит также при участии желчных кислот, которые образуют вместе с моноацилглицеринами, холестерином и жирными кислотами смешанные мицеллы — растворимые комплексы, обеспечивающие переход продуктов гидролиза в клетки слизистой кишечника. Желчные кислоты с током крови доставляются в печень, затем снова секретируются желчью в кишечник, то есть повторно используются, циркулируя по кругу: печень — кишечник — печень.
Дата: 2019-02-19, просмотров: 358.