В организме кислотообразование преобл.над образованием соед-й основного характера.
Источники Н+ в организме:
1.летучая кислота Н2СО3, в сутки образ.10-20тыс.ммоль СО2 при окислении белков, Ж, У.
2.нелетучие кислоты в сут.образ. 70 ммоль:
- фосфорная при расщепл.орг.фосфатов(нуклеотидов, ФЛ, фосфопротеидов)
-серная, соляная при окислении Б
3.орг.к-ты:молочная, кетоновые тела, ПВК и др.
рН удерживается на слабощелочном уровне благодаря участию буф.с-м и физиологическому контролю(выделит.ф.почек и дыхат.ф.легких)
Уравнение Гендерсона-Хессельбаха: pH = pKa + lg [акц.протонов]/[донор протонов].
( Соль) ( кислота)
Любая буф.с-ма состоит из сопряженной кислотно-основной пары: донор+акцептор протонов.
Буферная емкость: зависит от абсолютных концентраций компонентов буфера.
1) Бикарбонатная.
10%буф.емкости крови.
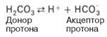
При нормальном значении рН крови (7,4) концентрация ионов бикарбоната НСО3 в плазме крови превышает концентрацию СО2примерно в 20 раз. Бикарбонатная буферная система функционирует как эффективный регулятор в области рН 7,4.
Механизм действия данной системы заключается в том, что при выделении в кровь относительно больших количеств кислых продуктов водородные ионы Н+ взаимодействуют с ионами бикарбоната НСО3–, что приводит к образованию слабодиссоциирующей угольной кислоты Н2СО3. Последующее снижение концентрации Н2СО3 достигается в результате ускоренного выделения СО2 через легкие в результате их гипервентиляции (напомним, что концентрация Н2СО3 в плазме крови определяется давлением СО2 в альвеолярной газовой смеси).
Если в крови увеличивается количество оснований, то они, взаимодействуя со слабой угольной кислотой, образуют ионы бикарбоната иводу. При этом не происходит сколько-нибудь заметных сдвигов в величине рН. Кроме того, для сохранения нормального соотношения между компонентами буферной системы в этом случае подключаются физиологические механизмы регуляции кислотно-основногоравновесия: происходит задержка в плазме крови некоторого количества СО2 в результате гиповентиляции легких.
NaHCO3 + H+ → Na+ + H2CO3
Реабс.в почках ↓карбоангидраза
СО2 + Н2О
↓увеличение вентиляции легких
2) Фосфатная представляет собой сопряженную кислотно-основную пару, состоящую из иона Н2РО4– (донорпротонов) и иона НРО42– (акцептор протонов):
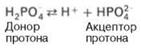 Фосфатная буферная система составляет всего лишь 1% от буферной емкости крови. Во внеклеточной жидкости, в том числе в крови, соотношение [НРО42–]: [Н2РО4–] составляет 4:1. Буферное действие фосфатной системы основано на возможности связывания водородных ионов ионами НРО42– с образованием Н2РО4– (Н+ + + НРО42– —> Н2РО4–), а также ионов ОН– с ионами Н2РО4– (ОН– + + Н2 Р О4– —> HPO42–+ H2O). Буферная пара (Н2РО4––НРО42–) способна оказывать влияние при изменениях рН в интервале от 6,1 до 7,7 и может обеспечивать определенную буферную емкость внутриклеточной жидкости, величина рН которой в пределах 6,9–7,4. В крови максимальная емкость фосфатного буфера проявляется вблизи значения рН 7,2.
Фосфатная буферная система составляет всего лишь 1% от буферной емкости крови. Во внеклеточной жидкости, в том числе в крови, соотношение [НРО42–]: [Н2РО4–] составляет 4:1. Буферное действие фосфатной системы основано на возможности связывания водородных ионов ионами НРО42– с образованием Н2РО4– (Н+ + + НРО42– —> Н2РО4–), а также ионов ОН– с ионами Н2РО4– (ОН– + + Н2 Р О4– —> HPO42–+ H2O). Буферная пара (Н2РО4––НРО42–) способна оказывать влияние при изменениях рН в интервале от 6,1 до 7,7 и может обеспечивать определенную буферную емкость внутриклеточной жидкости, величина рН которой в пределах 6,9–7,4. В крови максимальная емкость фосфатного буфера проявляется вблизи значения рН 7,2.
1 и 2 – выводящие.
3) Белковая имеет меньшее значение для поддержания КОР в плазме крови, чем другие буферные системы. Белки образуют буферную систему благодаря наличию кислотно-основных групп в молекуле белков: белок–Н+ (кислота, донорпротонов) и белок (сопряженное основание, акцептор протонов). Белковая буферная система плазмы крови эффективна в области значений рН 7,2–7,4.
4) Гемоглобиновая буферная система – самая мощная буферная система крови. Она в 9 раз мощнее бикарбонатного буфера; на ее долю приходится 75% от всей буферной емкости крови. состоит из неионизированного гемоглобина ННb (слабая органическая кислота, донорпротонов) и калиевой соли гемоглобина КНb (сопряженное основание, акцептор протонов). Точно так же может быть рассмотрена оксигемоглобиновая буферная система. Система гемоглобина и система оксигемоглобина являются вза-имопревращающимися системами и существуют как единое целое.
Механизм действия:
- в тканях: Н2О + СО2(карбоангидраза) —>Н2СО3—>Н+ + НСО3-(диффундирует в плазму крови)
КНвО2 —>КНв + 4О2
КНв + 2Н+ —> ННв + 2К+ (К-гемоглобин неитрализует ионы Н+)
- в легких: ННв + 4О2 —>2Н+ + НвО2
2Н+ + НвО2 + 2К+ + 2НСО3- —>КНвО2 + 2Н2СО3(карбоангидраза) —>Н2О + 2СО2
рН и концентрация СО2 влияют на освобождение и связывание О2 немоглобином – эфф.Бора.
Повышение концентрации протонов, СО2, способствует освобождению О2, а повышение концентрации О2 стимулирует высвобождение СО2 и протонов.
Дата: 2019-02-19, просмотров: 391.