ВВЕДЕНИЕ
Актуальность. Ускоренное развитие современной мировой промышленности и отставание от него развития экологического мышления и заботы о будущем планеты привили к тому, что экосистемы, веками формирующиеся, приходят в упадок за один век «технологического прорыва» человечества.
Человек успел нанести огромный урон природе, прежде чем осознал, чем рисковал во время погони за добычей ископаемых, масштабным производством вредных для окружающей среды веществ. Однако XXI век характеризуется работой человечества над своими ошибками и поиском новых. Так, например, одной из самых серьезных проблем, стоящей перед планетой, стало ее загрязнение тяжелыми металлами.
Тяжелые металлы – это группа элементов, активно участвующая в биологических процессах, имеющая надежные биогеохимические циклы, на которые практически невозможно повлиять. Группа "тяжелых металлов" во многом совпадает с понятием "микроэлементы". Отсюда свинец, цинк, кадмий, ртуть, молибден, хром, марганец, никель, олово, кобальт, титан, медь, ванадий являются тяжелыми металлами. Тяжелые металлы оказывают токсическое влияние на живые организмы и экосистему, когда концентрация их превышает норму. Риски в связи с их накоплением в природе и в организме человека очень высоки и могут привести к гибели.
Исходя из серьезности данной проблемы, сформулируем цель реферата и задачи, которые нужно решить в процессе изучения темы реферата.
Цель работы: изучить глобальные биогеохимические циклы ионов металлов и их влияние на жизнедеятельность организмов
Задачи работы:
1. Изучить биогеохимические циклы ионов металлов.
2. Определить механизм действия на организм человека необходимых и токсичных металлов и рассмотреть пути попадания токсичных металлов в организм человека.
3. Выяснить возможные пути загрязнения окружающей среды ионами тяжелых металлов и последствия этих загрязнений.
РОЛЬ ИОНОВ МЕТАЛЛОВ В ЖИВОТНОМ ОРГАНИЗМЕ
| Рис. 1. Зависимость ответной реакции (R) от дозы (n) для жизненно необходимых элементов |
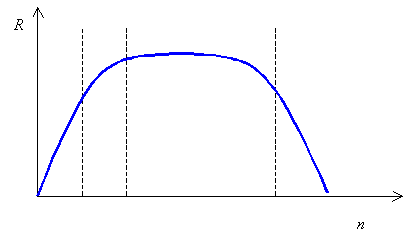 Микроэлементы обязательно должны присутствовать в организме человека. Заметим, что большинство из них - металлы, а из металлов больше половины являются d-элементами. Микроэлементы называют жизненно необходимыми, если при их отсутствии или недостатке нарушается нормальная жизнедеятельность организма. При малом поступлении данного элемента организму наносится существенный ущерб. Он функционирует на грани выживания. В основном это объясняется снижением активности ферментов, в состав которых входит данный элемент. При повышении дозы элемента ответная реакция возрастает и достигает нормы (плато). При дальнейшем увеличении дозы проявляется токсическое действие избытка данного элемента, в результате чего не исключается и летальный исход. Кривую на рис. 1 можно трактовать так: все должно быть в меру и очень мало и очень много вредно.
Микроэлементы обязательно должны присутствовать в организме человека. Заметим, что большинство из них - металлы, а из металлов больше половины являются d-элементами. Микроэлементы называют жизненно необходимыми, если при их отсутствии или недостатке нарушается нормальная жизнедеятельность организма. При малом поступлении данного элемента организму наносится существенный ущерб. Он функционирует на грани выживания. В основном это объясняется снижением активности ферментов, в состав которых входит данный элемент. При повышении дозы элемента ответная реакция возрастает и достигает нормы (плато). При дальнейшем увеличении дозы проявляется токсическое действие избытка данного элемента, в результате чего не исключается и летальный исход. Кривую на рис. 1 можно трактовать так: все должно быть в меру и очень мало и очень много вредно.
В таблице 1 представлены характерные симптомы дефицита химических элементов в организме человека.
Таблица 1
| Дефицит элемента | Типичный симптом |
| Ca | Замедление роста скелета |
| Mg | Мускульные судороги |
| Fe | Анемия, нарушение иммунной системы |
| Zn | Повреждение кожи, замедление роста, замедление полового созревания |
| Cu | Слабость артерий, нарушение деятельности печени, вторичная анемия |
| Mn | Бесплодие, ухудшение роста скелета |
| Mo | Замедление клеточного роста, склонность к кариесу |
| Co | Злокачественная анемия |
| Ni | Учащение депрессий, дерматиты |
| Cr | Симптомы диабета |
Рассмотрим ионы металлов, которые играют роль макроэлементов в организме человека.
Ни один из щелочных металлов не является особенно токсичным. [1]
Калий и натрий
Калий (K+) и натрий (Na+) можно назвать металлами-близнецами – нарушение баланса между ними приводит к заболеванию сердечно-сосудистой системы (ишемической болезни сердца, инфаркта миокарда, гипертонии), нарушения в работе почек.
Калий регулирует водный баланс; регулирует водно-солевой обмен; нормализует кислотно-щелочные показатели организма; важен для активизации ферментов; поддерживает нормальную работу мышечной системы.
Соли калия необходимы для всех мягких тканей организма: сосудов, мышц, капилляров, клеток мозга, почек, печени и сердечной мышцы, а также для желез внутренней секреции. 50% солей нашего организма – это соли калия.
Суточная потребность в калии: суточная доза калия для взрослого человека составляет 1800 – 5000 мг, для детей – 600-1700 мг.
Симптомы недостатка и избытка калия: при недостатке калия в организме может начать развиваться гиперкалемия, нарушиться работы сердечной мышцы и скелетной мускулатуры, а продолжительный недостаток калия может привести к острой невралгии.
Избыток калия может привести к гиперкалиемия, которая проявляется язвой тонкого кишечника. Гиперкалиемия, вовремя не остановленная может привести к остановке сердца.
В каких продуктах содержится калий: больше всего калия содержится в сухофруктах, свежих овощах и фруктах, в ягодах, проросшем зерне, в орехах, картофеле, а также в молочных продуктах и рыбе.
Натрий – это макроэлемент, который обеспечивает проводимость нервных импульсов, входит в состав крови и регулирует баланс воды в организме. Натрием заполнены все межклеточные пространства, то есть он является основой всех межклеточных жидкостей, а вместе с калием он образует нормальный баланс жидкости, предотвращая риск обезвоживания, в следствии чего, роль натрия трудно переоценить. Также натрий влияет на нервную систему: с помощью разности концентрации натрия генерируются электрические сигналы – основа нервной системы. Натрий укрепляет сердечно-сосудистую системы, входя в состав крови, что позволяет регулировать объем крови. Помимо этого, натрий важен для регулировки выделительных систем, для кислотно-щелочного баланса в организме, а также помогает сохранить и накопить многие вещества в крови после их растворения.
Суточная потребность в натрии: натрий – это соль, суточная дозировка которой должна быть определенной и не больше 4-6 г, а это примерно равно 10-15 г поваренной соли.
При жарком климате потребность в натрии увеличивается, а также при обильном потоотделении и физических нагрузках.
Симптомы недостатка и избытка натрия: чаще всего недостатку натрия подвержены те, кто придерживаются вегетарианского рациона, но сам по себе недостаток натрия – явления довольно редкое. А временный недостаток может произойти при обильном употреблении воды.
Избыток натрия может вызвать отеки лица и ног, большую нагрузку на сердца и почки, повышение кровяного давления и выделение калия. Чрезмерное употребление соли, превышающее 20-30 г очень опасно и может вызвать большой избыток натрия, что приведет к более серьезным последствиям, так как почки не будут успевать его перерабатывать.
Магний
В животных организмах Mg2+ представляет собой необходимый кофактор в каждой реакции, протекающей с участием аденозин-трифосфата (АТФ). Он также играет роль и противоиона для стабилизации двойной спирали ДНК, имеющей отрицательно заряженные фосфатные группировки в каждом звене цепи. Присутствие ионов магния увеличивает вероятность правильного спаривания звеньев. Ионы Mg2+ необходимы для нервно-мышечной передачи и мускульного сокращения. Устойчивый гомеостаз поддерживает уровень Mg2+ в плазме крови на уровне 0,9 мМ для практически здоровых людей. Низкие уровни Mg2+могут вызывать гипокальцемию, при которой метаболически лабильный минерал не может быть мобилизован из костей. Уровни и Mg2+ контролируется пара-тироидным гормоном через механизм негативной обратной связи.
Суточная потребность в магнии: для здорового человека суточная потребность составляет 350-500 мг, причем, половина этой дозы поступает в организм из круп или злаков.
Симптомы недостатка магния: недостаток магния в организме наблюдается у 90% населения. Нехватка магния проявляется как: усталость, судороги мышц, онемение конечностей, запоры, проблемы с координацией, ломкость ногтей и выпадение волос, остеопороз, артрит. [2]
2.3. Кальций.
Кальция в форме Ca2+ содержится в организме больше, чем других ионов металлов. Более 99% его входит в состав костей и зубной эмали в виде гидроксоапатита Са5(РО4)3(ОН). Многие из активностей кальций-иона включены во взаимодействия с белковыми макромолекулами, которые ион Ca2+ может стабилизировать, активировать и модулировать. Все известные до сих пор места связывания в белках для ионов Ca2+ состоят из кислородных атомов. Свободная концентрация Ca2+ в межклеточных жидкостях составляет примерно 1,3 мМ. При стимуляции низкая внутриклеточная концентрация может увеличиться в 10 раз, что сопровождается конформационными изменениями в белковых макромолекулах, имеющих константу диссоциации в пределах микромолей. Рекомендованную дневную дозу (800 мг) Ca2+ можно получить при приеме литра молока — единственного богатого кальцием источника. Дефицит кальция выражается в задержке роста, плохих зубах и в других менее очевидных дефектах. Одним из таких скрытых дефектов является повышенная абсорбция нежелаемых или токсичных ионов металлов в Ca2+ - дефицитной системе.
Кальций считается нетоксичным. Отложение костных минералов в мягких тканях вызывается не избытком Ca2+-ионов, а повышенным содержанием витамина D. Однако высокий уровень Ca2+ в диете может ингибировать кишечную абсорбцию других необходимых организму металлов.
Алюминий
Алюминий является необходимым микроэлементом для человеческого организма. Практически все ткани и органы человека содержат алюминий. Этот микроэлемент в умеренных количествах выполняет немаловажные функции, однако большие его дозы представляют существенную опасность для здоровья.
Как и упомянуто выше, алюминий выполняет множество немаловажных функций: способствует построению костной и соединительной ткани; содействует эпителизации кожи; повышает активность некоторых пищеварительных ферментов; повышает переваривающую функцию желудочного сока; участвует в образовании белковых и фосфатных комплексов; положительно влияет на функцию околощитовидных желез
Суточная потребность в алюминии: здоровому взрослому человеку необходимо примерно 30-50 мкг этого микроэлемента.
Симптомы недостатка и избытка алюминия: при недостатке алюминия отсутствуют какие-либо данные о симптомах, проявляющихся у человека.
В каких продуктах содержится алюминий: в основном, алюминий содержится в фруктах и ягодах, овощах, различных хлебопродуктах, а также в питьевой воде.
Железо
Содержание железа в человеческом организме 4 г, из которых около 70%, т.е. 3 г, находятся в составе красных кровяных клеток в виде гемоглобина, большая часть остатка — в железопротеинах, а небольшое количество — в некоторых ферментах. Из рекомендованной ежедневной потребности в железе, равной 10—20 мг, абсорбируется только 10—20%, несколько большее количество — у лиц с дефицитом по железу при хорошем гомеостазе. Почти все целиком 25 мг железа, ежедневно высвобождаемого при распаде гемоглобина, эффективно рециклируются печенью, так что период полужизни железа в человеческом организме превышает 10 лет.
Суточная потребность в железе: в организме человека для осуществления определенных процессов удерживается примерно 4-5 г железа. Из пищи организмом усваивается всего 8 % поступающего железа. Суточная потребность организма человека в железе составляет от 10 до 25 мг.
Симптомы недостатка железа: первое, что может привлечь внимание – это кожа, она становится сухой и чувствительной к холоду, вследствие чего раньше начинает стареть; расстройства органов пищеварения, и даже ожирение; развивается мышечная слабость; активность мозга ослабевает. [3]
Марганец
Такой микроэлемент, как марганец, очень важен в нашем организме для верного развития клеток и тканей. При нем витамин B1, медь и железо способны полноценно усваиваться в организме, осуществляя важные функции. Например, без витамина B1, то есть тиамина, невозможно было бы запустить процесс строительства новых клеток, в том числе и нервных.
Организм взрослых людей содержит в себе примерно десять или двадцать миллиграмма марганца, к тому же, основное его количество находится в печени, почках, мозгу и костной ткани.
Роль марганца в организме человека: роль микроэлемента заключаются в том, чтобы активировать большое количество ферментативных реакций, например, как: формирование структуры костей; улучшение работы нервной системы; для быстрого заживления полученных ран и роста человека; образование «энергоносителя», то есть глюкозы и белков. С помощью него происходит энергетический процесс, в ходе которого окисляется глюкоза и углероды. Благодаря такому активному участию в ЦНС, марганец получил название «микроэлемент менеджер».
Суточная потребность в марганце: Взрослому человеку необходимо от 2 до 5 миллиграммов марганца.
Симптомы недостатка марганца:
Недостаточность этого микроэлемента плохо отражается на нервной системе, не благотворно влияет на функции мозга и некоторых других органов. Люди, страдающие от депрессии, нуждаются в повышенной потребности ферментов марганца. Именно в такие моменты наступает дефицит.
Кобальт
Кобальт (Co2+) известен как необходимый компонент витамина В12, хелатированный в комплексный корриновый макроцикл четырьмя связанными пиррольными кольцами. Известно несколько форм витамина В12, которые служат кофакторами ферментов в реакции переноса метальной группы, а также и в других реакциях, где кобальт подвергается изменению состояния окисления. Кобальт показал кардиотоксичность для некоторых любителей пива, потребляющих более трех литров в день. (В некоторых странах в пиво добавляют соли двухвалентного кобальта в количестве 10-4% для стабилизации пены, чтобы погасить действие остаточных детергентов.)
Суточная потребность в кобальте: В общем можно сказать, что содержание микроэлемента находится в пределах: не менее 8 мкг и не более 200 мкг.
Симптомы недостатка кобальта: ухудшение памяти; нарушение функций ЦНС; атрофия слизистой желудочно-кишечного тракта;
В общем, нарушается работа всех тех органов, в состав которых входит кобальт и на работу которых влияет.
Никель
В теле человека содержится около 10 мг Ni2+, а уровень в плазме крови заключен в довольно узких пределах, что свидетельствует о гомеостазе и, возможно, о необходимости никеля. Он служит как кофактор для растительного фермента уреазы. Совместно с другими ионами металлов Ni2+ активирует определенные ферменты в организме животных. На сегодняшний день роль этого микроэлемента в организме не до конца изучена. Однако без сомнения никель играет существенную роль в следующих функциях: принимает участие в процессах кроветворения в сочетании с железом, медью и кобальтом (воздействует на развитие эритроцитов и способствует повышению уровня гемоглобина); улучшает гипогликемическую деятельность (увеличивает продуктивность работы инсулина); принимает участие в структурном формировании и функционировании белков, ДНК и РНК.
Суточная потребность в никеле: среднесуточная потребность человека в никеле составляет от 100 до 300 мкг в зависимости от пола и возраста.
Медь
Концентрация меди в организме регулируется гомеостазом, и оптимальные ее концентрации находятся в широких пределах. Медь является необходимым кофактором для нескольких ферментов, катализирующих разнообразные окислительно-восстановительные реакции в обоих валентных состояниях, Сu (I) и Сu (II), хорошо связывает сульфгидрильную группу в глутатионе и серосодержащих белках. Сu (II) окисляет незащищенную сульфгидрильную группу до дисульфидной, самовосстанавливаясь до Сu (I), поэтому организм должен связать Сu (И) прежде, чем состоится окисление сульфгидрильной группы. Около 95% меди в плазме крови находится в составе белка церулоплазмина.
У взрослого человека содержание меди в организме равно примерно 100-200мг. Однако основной запас этого микроэлемента хранится в мышцах человека, его костях, крови, сердце, печени, а также в мозгу.
Роль меди в организме человека: Медь принимает участие в синтезе эритроцитов и лейкоцитов; укрепляет стенки кровеносных сосудов; способствует повышению иммунитета и нейтрализации радикалов.
Суточная потребность в меди: потребность в употреблении такого микроэлемента, как медь, составляет от 1 до 3 мг в день.
Цинк
Большая часть ионов Zn2+ в крови найдена в эритроцитах в качестве необходимого кофактора для фермента карбоангидразы. Zn2+ в теле человека находится в его мускулах. Уровень Zn2+ находится под контролем гомеостаза.
Дефицит цинка отмечен у жителей развивающихся стран, диета которых богата волокнистой и вязкой пищей. Дефицит по цинку выражается в нарушении кожных покровов, отставании в росте, нарушении полового развития и половых функций у молодых людей. Добавки цинка могут разбалансировать метаболические равновесия других металлов, поэтому такие вмешательства должны проводиться под строгим медицинским контролем. Подчеркнем этот совет особенно, поскольку гипотеза об отношении Zn2+/ Сu2+ как о главном причинном факторе в развитии ишемической болезни сердца (локальное прекращение артериального тока крови) оказалось вполне корректной. Прием двухвалентного цинка способствует заживлению ран у дефицитных по цинку пациентов, но он не помогает, если в организме имеется адекватное количество Zn2+. [4]
Вывод:
Из изученных данных стало ясно, что макро- и микроэлементы обеспечивают нормальную работу организма человека, выполняют ряд функций, необходимых для обеспечения жизнедеятельности. Однако, избыток этих металлов в организме приводит к нарушению работы внутренних органов или даже целой системы органов. Такое поведение ионов металлов связано с их свойством токсичности, которая не имеет значения в малых дозах, однако сильно подрывает здоровье человека при повышении суточной дозы по каким-либо причинам.
Ртуть
Ртуть относится к I классу опасности. Атмосферные процессы, вулканическая и человеческая деятельность привели к тому, что в мировом океане накопилось около 50 млн.т этого металла. Естественный вынос ртути в океан в результате эрозии 5000 т/год, еще 5000 т/год ртути выносится в результате человеческой деятельности.
Первоначально ртуть попадает в океан в виде Нg2+, затем она взаимодействует с органическими веществами и с помощью анаэробных организмов переходит в токсичные вещества метилртуть (СН3Нg)+ и диметилртуть (СН3-Нg-СН3). Метилртуть особенно опасна для животных и человека, так как она быстро переходит из крови в мозговую ткань, разрушая мозжечок и кору головного мозга. Метилртуть оказывает тератогенное воздействие на человека. Ртуть присутствует не только в гидросфере, но и в атмосфере, так как имеет относительно высокое давление паров. Природное содержание ртути составляет ~0,003-0,009 мкг/м3.
Мировое производство ртути в настоящее время составляет более 10000 т в год, большая часть этого количества используется в производстве хлора. Ртуть проникает в воздух в результате сжигания ископаемого топлива. Анализ льда Гренландского ледяного купола показал, что, начиная с 800 г. н.э. до 1950-х гг., содержание ртути оставалось постоянным, но уже с 50-х гг. нашего столетия количество ртути удвоилось.
Металлическая ртуть опасна, если ее проглотить и вдыхать ее пары.
Неорганические соединения ртути практически нелетучи, поэтому опасность представляет попадание ртути внутрь организма через рот и кожу.
Свинец
Ежегодно в мире в результате воздействия атмосферных процессов мигрирует около 180 тыс. т свинца. При добыче и переработке свинцовых руд теряется более 20 % свинца.
Наиболее серьезным источником загрязнения среды обитания организмов свинцом являются выхлопы автомобильных двигателей. Антидетонатор тетраметил - или тетраэтилсвинец - прибавляют к большинству бензинов, начиная с 1923 г., в количестве около 80 мг/л. При движении автомобиля от 25 до 75% этого свинца в зависимости от условий движения выбрасывается в атмосферу. Основная его масса осаждается на землю, но и в воздухе остается заметная ее часть.
Свинцовая пыль не только покрывает обочины шоссейных дорог и почву внутри и вокруг промышленных городов, она найдена и во льду Северной Гренландии, причем в 1756 г. содержание свинца во льду составляло 20 мкг/т, в 1860 г. уже 50 мкг/т, а в 1965 г. - 210 мкг/т.
Активными источниками загрязнения свинцом являются электростанции и бытовые печи, работающие на угле.
Источниками загрязнения свинцом в быту могут быть глиняная посуда, покрытая глазурью; свинец, содержащийся в красящих пигментах.
Свинец токсичен и относится к I классу опасности. Неорганические его соединения нарушают обмен веществ и являются ингибиторами ферментов (подобно большинству тяжелых металлов. Биологический период полураспада свинца в костях - около 10 лет.
Кадмий и цинк
Около 1 млн. кг кадмия попадает в атмосферу ежегодно в результате деятельности заводов по его выплавке, что составляет около 45 % общего загрязнения этим элементом. 52 % загрязнений попадают в результате сжигания или переработки изделий, содержащих кадмий. Кадмий обладает относительно высокой летучестью, поэтому он легко проникает в атмосферу.
Попадание кадмия в природные воды происходит в результате применения его в гальванических процессах и техники. Наиболее серьёзные источники загрязнения воды цинком – заводы по выплавке цинка и гальванические производства.
Потенциальным источником загрязнением кадмием являются удобрения. При этом кадмий внедряется в растения, употребляемые человеком в пищу, и в конце цепочки переходят в организм человека. Кадмий и цинк легко проникают в морскую воду и океан через сеть поверхностных и грунтовых вод.
Сурьма, мышьяк, кобальт
Самыми сильными источниками загрязнения этим металлом являются гербициды (химические вещества для борьбы с сорными растениями), фунгициды (вещества для борьбы с грибными болезнями растений) и инсектициды (вещества для борьбы с вредными насекомыми).
Кобальт не является широко применяемым. Так, например, его используют в сталелитейной промышленности, в производстве полимеров. При попадании внутрь больших количеств кобальт отрицательно влияет на содержание гемоглобина в крови человека и может вызвать заболевания крови. Предполагают, что кобальт вызывает базедову болезнь. Этот элемент опасен для жизни организмов ввиду его чрезвычайно высокой реакционной способности и относится к I классу опасности.
Медь и марганец
Медь присутствует в небольших количествах в цинковых концентратах и может переноситься на большие расстояния с воздухом и водой. Аномальное содержание меди обнаруживается в растениях и почвах на расстоянии
Природное содержание марганца в растениях, животных и почвах очень высоко. Основные области производства марганца – производство легированных сталей, сплавов, электрических батарей и других химических источников тока. Присутствие марганца в воздухе сверх нормы (среднесуточная ПКД марганца в атмосфере – воздухе населённых мест – составляет 0,01 мг/м3) вредно влияет на организм человека, что выражается в прогрессирующем разрушении центральной нервной системы. Марганец относится ко II классу опасности. [8]
ЗАГРЯЗНЕНИЕ ЭКОСИСТЕМ
Водное пространство
Ионы металлов являются непременными компонентами природных водоемов. В зависимости от условий среды (pH, окислительно-восстановительный потенциал, наличие лигандов) они существуют в разных степенях окисления и входят в состав разнообразных неорганических и металлорганических соединений, которые могут быть истинно растворенными, коллоидно-дисперсными или входить в состав минеральных и органических взвесей. Многие металлы образуют довольно прочные комплексы с органикой; эти комплексы являются одной из важнейших форм миграции элементов в природных водах. Комплексы, образуемые почвенными кислотами с солями железа, алюминия, титана, урана, ванадия, меди, молибдена и других тяжелых металлов, относительно хорошо растворимы в условиях нейтральной, слабокислой и слабощелочной сред. Поэтому металлорганические комплексы способны мигрировать в природных водах на весьма значительные расстояния. Особенно важно это для маломинерализованных и в первую очередь поверхностных вод, в которых образование других комплексов невозможно.
Тяжелые металлы и их соли — широко распространенные промышленные загрязнители. В водоемы они поступают из естественных источников (горных пород, поверхностных слоев почвы и подземных вод), со сточными водами многих промышленных предприятий и атмосферными осадками, которые загрязняются дымовыми выбросами.
В настоящее время существуют две основные группы аналитических методов для определения тяжелых металлов: электрохимические и спектрометрические методы. Среди спектрометрических методов определения тяжелых металлов первое место занимает атомно-абсорбционная спектрометрия с разной атомизацией образцов: атомно-абсорбционная спектрометрия с пламенной атомизацией (FAAS) и атомно-абсорбционная спектрометрия с электротермической атомизацией в графитовой кювете (GF AAS).
Определение содержание тяжёлых металлов в пробе производится путем перевода пробы в раствор – за счет химического растворения в подходящем растворителе (воде, водных растворах кислот, реже щелочей) или сплавления с подходящим флюсом из числа щелочей, оксидов, солей с последующим выщелачиванием водой. После этого соединение искомого металла переводится в осадок добавлением раствора соответствующего реагента – соли или щелочи, осадок отделяется, высушивается или прокаливается до постоянного веса, и содержание тяжёлых металлов определяется взвешиванием на аналитических весах и пересчетом на исходное содержание в пробе.
Для определения содержания тяжёлых металлов электрохимическими методами пробу также необходимо перевести в водный раствор. После этого содержание тяжёлых металлов определяется различными электрохимическими методами – полярографическим (вольтамперометрическим), потенциометрическим, кулонометрическим, кондуктометрическим и другими, а также сочетанием некоторых из перечисленных методов с титрованием. С помощью этих методов можно определять тяжёлые металлы до 10-9 моль/л. [9]
Почвенный покров
Почва является основной средой, в которую попадают тяжёлые металлы, в том числе из атмосферы и водной среды. Продолжительность пребывания загрязняющих компонентов в почве гораздо выше, чем в других частях биосферы, что приводит к изменению состава и свойств почвы как динамической системы и в конечном итоге вызывает нарушение равновесия экологических процессов.
Токсичные элементы в любом состоянии поглощаются листьями или оседают на листовой поверхности. Затем, при опадании листьев, эти соединения попадают в почву.
Определение тяжелых металлов в первую очередь проводят в почвах, расположенных в зонах экологического бедствия, на сельскохозяйственных угодьях, прилегающих к загрязнителям почв тяжелыми металлами, и на полях, предназначенных для выращивания экологически чистой продукции.
В почвенных пробах определяют «подвижные» формы тяжелых металлов или их валовое содержание. Как правило, при необходимости контроля над техногенным загрязнением почв тяжелыми металлами, принято определять их валовое содержание. Определение содержания подвижных форм металлов желательно проводить в случае высоких их валовых количеств в почве, а также, когда необходимо характеризовать миграцию металлов-загрязнителей из почвы в растения.
Если почвы загрязнены тяжелыми металлами и радионуклидами, то очистить их практически невозможно. Пока известен единственный путь: засеять такие почвы быстрорастущими культурами, дающими большую фитомассу. Такие культуры, извлекающие тяжелые металлы, после созревания подлежат уничтожению. На восстановление загрязненных почв требуются десятки лет.
Атмосфера
Часть техногенных выбросов тяжелых металлов, поступающих в атмосферу в виде аэрозолей, переносится на значительное расстояние и вызывает глобальное загрязнение. Другая часть с гидрохимическим стоком попадает в бессточные водоемы, где накапливается в водах и донных отложениях и может стать источником вторичного загрязнения. Соединения тяжелых металлов сравнительно быстро распространяются по объемам водного объекта. Частично они выпадают в осадок в виде карбонатов, сульфатов, частично адсорируются на минеральных и органических осадках. В результате содержание тяжелых металлов в отложениях постоянно растет, и когда абсорбционная способность осадков исчерпывается и тяжелые металлы поступают в воду, возникает особо напряженная ситуация. Этому способствует повышение кислотности воды, сильное зарастание водоемов, интенсификация выделения СО2 в результате деятельности микроорганизмов. Значительное загрязнение тяжелыми металлами, особенно свинцом, а также цинком и кадмием обнаружено вблизи автострад. Ширина придорожных аномалий свинца в почве достигает 100 м и более. [10]
ЗАКЛЮЧЕНИЕ
Проблема глобальных биогеохимических циклов тяжелых металлов, оказывающих токсическое влияние на все живое на планете действительно очень важна и требует от всего человечества немало финансовых и интеллектуальных затрат. Однако нужно отметить, что решение сложившейся ситуации требуется незамедлительно хотя бы потому, что токсичные металлы могут оказаться в организме любого человека, ведь как мы уже выяснили для их внедрения в экологические системы существует множество различных путей.
Задача людей состоит не только в том, чтобы защитить свой организм от негативного влияния токсичных металлов, но также в умении заботиться о благополучии окружающей среды в той же мере, что о себе.
Вполне вероятно, что при должной заинтересованности людей может произойти полном очищении природы от всевозможных токсинов, загрязнителей морей, почв, воздуха, которым мы все с вами дышим.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
1. Руководство по профессиональным заболеваниям, под ред. Н.Ф. Измерова, Москва, “Медицина”, 1983.
2. Ахметов Н.С. Общая и неорганическая химия. - М.: Высшая школа, 1988.
3. Токсичность тяжелых металлов в организме человека и животных // Интернет-ресурс: http://biofile.ru/bio/19957.html (Дата обращения: 03.10.18)
4. Токсическое действие металлов на организм // Интернет-ресурс: https://revolution.allbest.ru/ecology/00400891_1.html (Дата обращения: 03.10.18)
5. Тяжелые металлы — загрязнители природной среды // Интернет-ресурс: http://yznaika.com/notes/197#15 (Дата обращения: 05.10.18)
6. Химия окружающей среды : учебник для СПО / Т. И. Хаханина, Н. Г. Никитина, Л. С. Суханова ; под ред. Т. И. Хаханиной. — 2-е изд., перераб. и доп. — М. : Издательство Юрайт, 2016. — 216 с. — Серия : Профессиональное образование.
7. Токсичные металлы 1 группы опасности // Интернет-ресурс: https://medbe.ru/materials/bioneorganika/toksichnye-metally-1-gruppy-opasnosti/ (Дата обращения: 11.10.18)
8. Отравление токсичными ионами металлов // Интернет-ресурс: https://www.ronl.ru/referaty/bezopasnost_zhiznideyatelnosti/1199/ (Дата обращения: 13.10.18)
9. Тяжелые металлы и их удаление из стоков, почв // Интернет-ресурс: http://masters.donntu.org/2006/feht/mihalskaya/library/art06.htm (Дата обращения: 14.10.18)
10. Рэуце Н., Кырста С. Борьба с загрязнением почвы. - М.: Агропромиздат, 1986
11. Ковда В.А. Биогеохимия почвенного покрова. М.: Наука. 1985. 243 с.
12. Биогеохимические циклы тяжёлых металлов в ландшафтах // Интернет-ресурс: https://knowledge.allbest.ru/chemistry/3c0a65635b2bd79a4d43b894212 (Дата обращения: 16.10.18)
ГЛОССАРИЙ
Биогеохимический цикл – это биогеохимический круговорот веществ, обмен веществом и энергией между различными компонентами биосферы, обусловленный жизнедеятельностью организмов и носящий цикличный характер. (Источник: «Биологический энциклопедический словарь.» Гл. ред. М. С. Гиляров; Редкол.: А. А. Бабаев, Г. Г. Винберг, Г. А. Заварзин и др. — 2-е изд., исправл. — М.: Сов. Энциклопедия, 1986)
Токсичность – это свойство некоторых химических соединений и веществ биологической природы при попадании в определенных количествах в живой организм (человека, животного и растения) вызывать нарушения его физиологических функций, в результате чего возникают симптомы отравления (интоксикации, заболевания), а при тяжелых отравлениях – гибель. (Источники: Методы определения токсичности и опасности химических веществ, под редакцией Саноцкого И.В. –М., 1970)
Кофактор – это небелковое вещество, которое обязательно должно присутствовать в организме в небольших количествах, чтобы соответствующие ферменты смогли выполнить свои функции. В состав кофактора входят коферменты и ионы металлов (например, ионы натрия и калия). (Толковый словарь по медицине. 2013)
Абсорбция – это химический или физический процесс впитывания одного вещества другим.( Научно-технический энциклопедический словарь)
Ингибитор (лат. inhibeo, inhibitum сдерживать, останавливать) – это общее название веществ, подавляющих или задерживающих течение физиологических и физико-химических (главным образом ферментативных) процессов. (Энциклопедический словарь медицинских терминов. — М.: Советская энциклопедия. — 1982—1984 гг.)
Техногенный – это процесс, риск и др., связанный с технической и технологической деятельностью людей. (Словарь экологических терминов и определений, 2010)
Тератогенное действие (от греч. τερατος «чудовище, урод, уродство») — нарушение эмбрионального развития под воздействием тератогенных факторов — некоторых физических, химических с возникновением морфологических аномалий и пороков развития. (Wikimedia Foundation. 2010)
Электрохимические методы анализа – это совокупность методов качественного и количественного анализа, основанных на электрохимических явлениях, происходящих в исследуемой среде или на границе раздела фаз и связанных с изменением структуры, химического состава или концентрации анализируемого вещества. Э. м. а. делятся на пять основных групп: потенциометрию, вольтамперометрию, кулонометрию, кондуктометрию и диэлектрометрию.( Большая советская энциклопедия. — М.: Советская энциклопедия. 1969—1978.)
Спектрометрический метод : Метод, основанный на измерении распределения измеряемой характеристики ионизирующего излучения, обычно энергии частиц или фотонов, по заданному параметру.( Словарь-справочник терминов нормативно-технической документации. academic.ru. 2015.)
Гипергенез – это совокупность процессов химического и физического преобразования минеральных веществ в верхних частях земной коры и на ее поверхности (при температуре ниже 80° С) под воздействием атмосферы, гидросферы и живых организмов. (Экологический энциклопедический словарь. — Кишинев: Главная редакция Молдавской советской энциклопедии. И.И. Дедю. 1989.)
Техногенез – это целенаправленный процесс технической (геологической) деятельности человека в биосфере и околоземном пространстве. ( Экологический энциклопедический словарь. — Кишинев: Главная редакция Молдавской советской энциклопедии. И.И. Дедю. 1989.)
Ари́дный кли́мат (от лат. aridus — сухой) — сухой климат с высокими температурами воздуха, испытывающими большие суточные колебания, и малым количеством атмосферных осадков (100—150 мм/год) или полным их отсутствием.
Биофильные элементы —поглощаемые из геохим. среды (почвы, воды) организмами и используемые в процессах жизнедеятельности. (Геологический словарь: в 2-х томах. — М.: Недра. Под редакцией К. Н. Паффенгольца. 1978.)
Кла́рковое число́ (или кларки элементов, ещё чаще говорят просто кларк элемента) — числа, выражающие среднее содержание химических элементов в земной коре, гидросфере, Земле в целом, космических телах и др. геохимических или космохимических системах.
Иллювиальный горизонт — это горизонт, в котором происходит накопление веществ, вынесенных из вышележащих (элювиальных) горизонтов. Подразделяются по характеру аккумулирующихся в них веществ (карбонаты, полуторные окислы, гипс и т. д.), например гумус иллювиальный, иллювиально-карбонатный. (Толковый словарь по почвоведению. — М.: Наука. Под редакцией А.А. Роде. 1975.)
Технофильные элементы – это рассеянные элементы, не обладающие способностью к концентрированию в земной коре. К ним относятся Rb, Sc, Ga, In, Tl, Hf, Ge, Se, Те, Re, Cd, Br, I и нек-рые др. С технологической точки зрения рассеянными являются элементы, практически не образующие собственных месторождений и добываемые попутно при переработке руд др. элементов или из нерудного сырья (зола углей, отходы коксования и т. п.).( Химическая энциклопедия. — М.: Советская энциклопедия. Под ред. И. Л. Кнунянца. 1988.)
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Что изучает бионеорганическая химия?
2. Какие источники поступления тяжелых металлов бывают?
3. Какие восемь наиболее опасных токсичных металлов попадают в организм человека?
4. Каким образом в организм человека попадает ртуть?
5. Каким образом в организм человека попадает свинец?
6. Каким образом в организм человека поступает кадмий?
7. Назовите источники попадания в организм алюминия.
8. каким образом в человеческий организм поступает мышьяк?
9. Дайте определение тяжелым металлам.
10. Какие основные группы аналитических методов для определения тяжелых металлов существуют?
ОТВЕТЫ К КОНТРОЛЬНЫМ ВОПРОСАМ
1. Бионеорганическая химия изучает в первую очередь поведение десяти металлов жизни в живом организме, а также она изучает биологически функциональные соединения металлов (а также некоторых неметаллов, например, селена).
2. Источники поступления тяжелых металлов делятся на природные (выветривание горных пород и минералов, эрозийные процессы, вулканическая деятельность) и техногенные (добыча и переработка полезных ископаемых, сжигание топлива, движение транспорта, деятельность сельского хозяйства).
3. Контролируется восемь наиболее опасных токсичных примесей: ртуть, свинец, олово, кадмий, медь, цинк, железо, мышьяк.
4. При производстве хлора электролитическим методом возможно образование сточных вод, загрязненных хлором, ртутью и ее солями. Ртутные соединения, сбрасываемые в водоемы, имеют свойство накапливаться в рыбе. Из растительных продуктов ртути более всего содержится в какао-бобах, а, следовательно, и в шоколаде.
5. Свинец поступает в организм из окружающей среды и воды, главным образом, из-за выхлопных газов и выбросов твердых частиц из заводов, сжигания угля, коррозии труб с содержанием свинца, аккумуляторных батарей и сточных вод.
6. Кадмий может попасть в организм с пищей или отравленной тяжелыми металлами водой. Источники попадания в организм человека кадмия: выбросы заводских и фабричных труб; автомобильный смог; работа на тяжелом производстве; лекарственные препараты, в состав которых входят соответствующие химические соединения, также могут послужить источниками заражения.
7. Главными источниками увеличенного поступления алюминия в организм являются алюминиевая посуда, загрязненный воздух, консервированная пища и иногда водопроводная вода.
8. Мышьяк как микроэлемент в организм человека поступает с питьевой, минеральной водой, соками, винами, морепродуктами, пестицидами, гербицидами, медицинскими препаратами.
9. Тяжёлые мета́ллы — химические элементы со свойствами металлов (в том числе и полуметаллы) и значительным атомным весом либо плотностью. К тяжелым металлам относятся более 40 химических элементов периодической системы Д.И. Менделеева, масса атомов которых составляет свыше 50 атомных единиц.
10. В настоящее время существуют две основные группы аналитических методов для определения тяжелых металлов: электрохимические и спектрометрические методы.
ТЕСТ
1. Что изучает бионеорганическая химия?
а) биологически функциональные соединения металлов (а также некоторых неметаллов)
б) соединения углерода, их структуру, свойства, методы синтеза
в) качественный и количественный состав химических веществ с помощью различных методов анализа
г) химические элементы, их простые и сложные вещества, а также закономерности превращения этих веществ
2. Сколько химических элементов периодической системы Д.И. Менделеева относятся к тяжелым металлам?
а) 30
б) 35
в) 40
г) более 40
3. Выберите 2 вида источников поступления тяжелых металлов в окружающую среду?
а) природные
б) антропогенные
в) глобальные
г) техногенные
4. Какой из металлов является высокотоксичным, кумулятивным (т. е. способным накапливаться в организме) ядом?
а) кальций
б) железо
в) ртуть
г) натрий
5. Наиболее опасное для организма органическое соединение ртути.
а) фенилмеркурат
б) метилртуть
в) бутилртуть
г) пентилртуть
6. Какое органическое соединение свинца наиболее опасно для человека?
а) тетраэтилсвинец
б) диэтилсвинец
в) гексаэтилсвинец
г) тетраацетат свинца
7. Какое соединение никеля является чрезвычайно ядовитым?
а) NiAs
б) Ni(CO)4
в) NiSO4
г) NiNO3
8. Какой металл из-за высокой токсичности получил прозвище «химический СПИД»?
а) мышьяк
б) железо
в) таллий
г) цинк
9. Выберите металлы, которые относятся к I классу опасности.
а) марганец
б) барий
в) медь
г) ртуть
10. Наиболее серьезным источником загрязнения окружающей среды свинцом являются
а) электростанции, работающие на угле
б) бытовые печи, работающие на угле
в) выхлопы автомобильных двигателей
г) глиняная посуда
11. Потенциальным источником загрязнением кадмием являются
а) удобрения
б) выхлопные газы
в) электростанции
г) вентиляционные выбросы
12. К какому классу опасности относится марганец?
а) I
б) II
в) III
13. Выберите 2 метода для определения тяжелых металлов, которые существуют в настоящее время.
а) химический
б) электрохимический
в) спектрометрический
г) физический
14. Основная среда, в которую попадают тяжёлые металлы.
а) атмосфера
б) водная среда
в) пиросфера
г) почва
15. В каких почвах накапливается натрий в условиях сухого климата?
а) солончаковых
б) глинястых
в) песчаных
г) известковых
16. Где накапливается магний?
а) в океанах
б) в почве
в) в атмосфере
г) в пиросфере
17. Выберите металл, который наиболее распространен в земной коре.
а) титан
б) алюминий
в) цинк
г) золото
18. Какой металл вызывает замедление роста скелета?
а) алюминий
б) никель
в) кадмий
г) кальций
19. При дефиците какого металла в организме будет наблюдаться повреждение кожи?
а) магний
б) хром
в) цинк
г) железо
20. Какие из перечисленных металлов нетоксичны?
а) кальций
б) кадмий
в) свинец
г) алюминий
21. При недостатке какого металла в организме развивается мышечная слабость?
а) железо
б) алюминий
в) никель
г) хром
22. В результате какого процесса ртуть проникает в воздух?
а) сжигания угля
б) вулканизации
в) сжигания ископаемого топлива
г) кислотных дождей
23. Дефицит какого металла в организме человека вызывает нарушение кровообращения и дефекты костей?
а) кобальт
б) молибден
в) ванадий
г) медь
24. Характерный симптом дефицита марганца в организме человека.
а) анемия
б) нарушение иммунной системы
в) бесплодие
г) склонность к кариесу
25. Выберите правильный вариант определения понятия «Ксенобиотик»:
а) Ксенобиотики – продукты исключительно антропогенной деятельности, способны вызывать нарушение биологических процессов в организмах, в том числе их заболевания и гибель.
б) Ксенобиотики – это химические элементы, имеющие внешнее происхождение, которые относятся практически ко всем биохимическим структурам и системам организма.
в) Ксенобиотики – класс микроорганизмов и веществ микробного и иного происхождения, использующихся в терапевтических целях, а также пищевые продукты и биологически активные добавки, содержащие живые микрокультуры.
26. К ксенобиотикам относятся
а) калий, железо, ртуть
б) кальций, калий, свинец
в) литий, натрий, калий
г) кадмий, свинец, ртуть
27. Какой элемент из лантаноидов считается токсичным?
а) церий
б) тербий
в) гольмий
г) ни один из них не считается токсичным
28. При недостатке какого металла наблюдаются мускульные судороги?
а) марганец
б) магний
в) железо
г) кальций
29. Какой симптом будет наблюдаться при дефиците никеля в организме человека?
а) анемия
б) бесплодие
в) учащение депрессий
г) замедление роста
30. Выберите из перечисленных металлов наиболее токсичный:
а) таллий
б) натрий
в) калий
г) железо
КЛЮЧ К ТЕСТУ
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| а | г | а,г | в | б | а | б | в | г | в | а | б | б,в | г | А |
| 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
| а | б | г | в | а | а | в | г | в | а | г | г | б | в | а |
ВОПРОСЫ К КРОССВОРДУ
По вертикали:
1. Реакции, в результате которых образуются комплексные соединения.
3. Свойство вещества оказывать вредное воздействие.
4. Векторная физическая величина, характеризующая направление изменения концентрации какого-либо вещества в среде.
5. Химические вещества, применяемые для уничтожения сорных растений.
11. Металл в очень измельченном виде.
13. Процесс многократного увеличения концентрации веществ на каждой следующей ступени.
14. Процесс обмена веществ в организме.
15. Минеральное вещество, содержащее металлы.
16. Высокая способность химических элементов к многочисленным связям с другими элементами.
22. Клешневидные соединения, образующие при взаимодействии атомов с полидентатными ионами.
27. Перемещение ионов из одного места в другое.
28. Удобрение, вызывающее повышение уровня содержания в почве типичных металлов.
29. Химические вещества, молекулы которых реагируют со специфическими рецепторами.
30. Металл первого класса опасности. Попадание этого металла в организм происходит через выхлопы автомобилей; красящих пигментов.
32. Нарушение работы (функции) какого-либо органа.
33. Профессиональное заболевание работников промышленности, вызванное вдыханиями пыли, содержащих бериллий.
35. Вещество, которое увеличивает глобальный цикл типичных металлов за счёт непосредственного попадания в почву.
37. Минерал – силикат магния.
39. Горизонт, в котором происходит накопление металлов.
40. Процесс, представляющий собой преобразование минеральных веществ под воздействием экологической пирамиды.
По горизонтали:
2. Раздел геохимии, изучающей химический состав живого вещества и действие элементов на процессы в экосистеме.
6. Число, выражающее среднее содержание химических элементов в экосистеме.
7. Способность открытой системы сохранять постоянство внутреннего состояния.
8. Поглощения сорбата всем объемом сорбента.
9. Ионы металлов, содержание которых в организме необходимо в очень малых концентрациях.
10. Степень насыщенности нахождения чего-либо в системе.
12. «Роль» атома металла в реакции с более электроотрицательным атомом.
17. Металл первой группы опасности, который принимает вид мелких шариков при разбивании термометра.
18. Химическое вещество, ускоряющее химические процессы в организме.
19. Токсичный металл, имеющий свойство накапливаться в организме человека.
20. Минерал, имеющий формулу KCl·MgCl2·6H2O.
21. Вещество, оказывающее стимулирующее влияние на организм.
23. Замедлитель реакции.
24. Нуклиды, ядра которых нестабильны.
25. Целенаправленный процесс геологической деятельности человека в биосфере.
26. Нарушение работы организма в результате загрязнения токсинами.
31. Металл, который из-за высокой токсичности получил прозвище «химический СПИД».
34. Наиболее опасное для организма органическое соединение ртути.
36. Свойство ионов металлов накапливаться (концентрироваться) в живом веществе.
38. Ион металла, связанный с комплексообразователем.
ОТВЕТЫ К КРОССВОРДУ.
По вертикали:
1. комплексообразование; 3. токсичность; 4. градиент; 5. гербицид; 11. тонкодисперсный; 13. аккумуляция; 14. метаболизм; 15. руда; 16. лабильность; 22. хелат; 27. миграция; 28. суперфосфат; 29. медиатор; 30. свинец; 32. дисфункция; 33. бериллиоз; 35. удобрение; 37. галит; 39. иллювиальный; 40. гипергенез.
По горизонтали:
2. биогеохимия; 6. кларк; 7. гомеостаз; 8. абсорбция; 9. микроэлемент; 10. концентрация; 12. донор; 17. ртуть; 18. фермент; 19. кумулятивный; 20. карналлит; 21. биогенное; 23. ингибитор; 24. радионуклид; 25. техногенез; 26. интоксикация; 31. таллий; 34. метилртуть; 36. биофильность; 38. лиганд.
КРОССВОРД. БИОНЕОРГАНИЧЕСКАЯ ХИМИЯ ИОНОВ МЕТАЛЛОВ.
| 14 | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3 | 4 | М | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Т | Г | Е | |||||||||||||||||||||||||||||||||||||||||||||||||||
| О | Р | Т | 15 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 | К | А | 8 | А | Б | С | О | Р | Б | Ц | И | Я | |||||||||||||||||||||||||||||||||||||||||
| К | С | Д | Б | У | |||||||||||||||||||||||||||||||||||||||||||||||||
| 2 | Б | И | О | Г | Е | О | Х | И | М | И | Я | И | О | Д | 32 | ||||||||||||||||||||||||||||||||||||||
| М | Ч | Е | Л | А | Д | ||||||||||||||||||||||||||||||||||||||||||||||||
| П | 5 | Н | Н | И | 29 | 31 | Т | А | Л | Л | И | Й | |||||||||||||||||||||||||||||||||||||||||
| Л | Г | 7 | Г | О | М | Е | О | С | Т | А | З | 16 | М | С | 40 | ||||||||||||||||||||||||||||||||||||||
| Е | Е | С | 9 | М | И | К | Р | О | Э | Л | Е | М | Е | Н | Т | Ф | Г | ||||||||||||||||||||||||||||||||||||
| 6 | К | Л | А | Р | К | Р | Т | 27 | А | Д | У | И | |||||||||||||||||||||||||||||||||||||||||
| С | Б | Ь | М | Б | И | Н | П | ||||||||||||||||||||||||||||||||||||||||||||||
| О | И | 13 | И | И | А | 30 | 33 | К | Е | ||||||||||||||||||||||||||||||||||||||||||||
| 11 | 10 | К | О | Н | Ц | Е | Н | Т | Р | А | Ц | И | Я | Г | Л | Т | С | Б | Ц | 35 | Р | ||||||||||||||||||||||||||||||||
| Т | Б | И | К | 17 | Р | Т | У | Т | Ь | О | В | 34 | М | Е | Т | И | Л | Р | Т | У | Т | Ь | 39 | Г | |||||||||||||||||||||||||||||
| 12 | Д | О | Н | О | Р | Д | К | А | Н | Р | И | Р | Я | Д | И | Е | |||||||||||||||||||||||||||||||||||||
| Н | А | У | Ц | О | Н | И | 36 | Б | И | О | Ф | И | Л | Ь | Н | О | С | Т | Ь | ||||||||||||||||||||||||||||||||||
| К | З | 18 | Ф | Е | Р | М | Е | Н | Т | И | С | 28 | Е | Л | Б | Л | Е | ||||||||||||||||||||||||||||||||||||
| О | О | У | Я | 26 | И | Н | Т | О | К | С | И | К | А | Ц | И | Я | Л | Р | Ю | З | |||||||||||||||||||||||||||||||||
| Д | В | 19 | К | У | М | У | Л | Я | Т | И | В | Н | Ы | Й | Ь | У | И | 37 | Е | В | |||||||||||||||||||||||||||||||||
| И | А | Я | 22 | П | О | 38 | Л | И | Г | А | Н | Д | И | ||||||||||||||||||||||||||||||||||||||||
| С | Н | Ц | Х | 25 | Т | Е | Х | Н | О | Г | Е | Н | Е | З | А | И | А | ||||||||||||||||||||||||||||||||||||
| П | И | 21 | Б | И | О | Г | Е | Н | Н | О | Е | Р | Л | Е | Л | ||||||||||||||||||||||||||||||||||||||
| Е | Е | Я | Л | Ф | И | Ь | |||||||||||||||||||||||||||||||||||||||||||||||
| Р | А | 23 | И | Н | Г | И | Б | И | Т | О | Р | Т | Н | ||||||||||||||||||||||||||||||||||||||||
| С | Т | С | Ы | ||||||||||||||||||||||||||||||||||||||||||||||||||
| 20 | К | А | Р | Н | А | Л | Л | И | Т | Ф | Й | ||||||||||||||||||||||||||||||||||||||||||
| Ы | 24 | Р | А | Д | И | О | Н | У | К | Л | И | Д | |||||||||||||||||||||||||||||||||||||||||
| Й | Т |
КРОССВОРД. БИОНЕОРГАНИЧЕСКАЯ ХИМИЯ ИОНОВ МЕТАЛЛОВ.
| 14 | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3 | 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| 15 | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 | 8 | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2 | 32 | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5 | 29 | 31 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| 7 | 16 | 40 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| 9 | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| 6 | 27 | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| 13 | 30 | 33 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| 11 | 10 | 35 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| 17 | 34 | 39 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| 12 | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| 36 | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| 18 | 28 | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| 26 | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| 19 | 37 | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| 22 | 38 | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| 25 | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| 21 | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| 23 | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| 20 | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| 24 | |||||||||||||||||||||||||||||||||||||||||||||||||||||
ВВЕДЕНИЕ
Актуальность. Ускоренное развитие современной мировой промышленности и отставание от него развития экологического мышления и заботы о будущем планеты привили к тому, что экосистемы, веками формирующиеся, приходят в упадок за один век «технологического прорыва» человечества.
Человек успел нанести огромный урон природе, прежде чем осознал, чем рисковал во время погони за добычей ископаемых, масштабным производством вредных для окружающей среды веществ. Однако XXI век характеризуется работой человечества над своими ошибками и поиском новых. Так, например, одной из самых серьезных проблем, стоящей перед планетой, стало ее загрязнение тяжелыми металлами.
Тяжелые металлы – это группа элементов, активно участвующая в биологических процессах, имеющая надежные биогеохимические циклы, на которые практически невозможно повлиять. Группа "тяжелых металлов" во многом совпадает с понятием "микроэлементы". Отсюда свинец, цинк, кадмий, ртуть, молибден, хром, марганец, никель, олово, кобальт, титан, медь, ванадий являются тяжелыми металлами. Тяжелые металлы оказывают токсическое влияние на живые организмы и экосистему, когда концентрация их превышает норму. Риски в связи с их накоплением в природе и в организме человека очень высоки и могут привести к гибели.
Исходя из серьезности данной проблемы, сформулируем цель реферата и задачи, которые нужно решить в процессе изучения темы реферата.
Цель работы: изучить глобальные биогеохимические циклы ионов металлов и их влияние на жизнедеятельность организмов
Задачи работы:
1. Изучить биогеохимические циклы ионов металлов.
2. Определить механизм действия на организм человека необходимых и токсичных металлов и рассмотреть пути попадания токсичных металлов в организм человека.
3. Выяснить возможные пути загрязнения окружающей среды ионами тяжелых металлов и последствия этих загрязнений.
РОЛЬ ИОНОВ МЕТАЛЛОВ В ЖИВОТНОМ ОРГАНИЗМЕ
| Рис. 1. Зависимость ответной реакции (R) от дозы (n) для жизненно необходимых элементов |
 Микроэлементы обязательно должны присутствовать в организме человека. Заметим, что большинство из них - металлы, а из металлов больше половины являются d-элементами. Микроэлементы называют жизненно необходимыми, если при их отсутствии или недостатке нарушается нормальная жизнедеятельность организма. При малом поступлении данного элемента организму наносится существенный ущерб. Он функционирует на грани выживания. В основном это объясняется снижением активности ферментов, в состав которых входит данный элемент. При повышении дозы элемента ответная реакция возрастает и достигает нормы (плато). При дальнейшем увеличении дозы проявляется токсическое действие избытка данного элемента, в результате чего не исключается и летальный исход. Кривую на рис. 1 можно трактовать так: все должно быть в меру и очень мало и очень много вредно.
Микроэлементы обязательно должны присутствовать в организме человека. Заметим, что большинство из них - металлы, а из металлов больше половины являются d-элементами. Микроэлементы называют жизненно необходимыми, если при их отсутствии или недостатке нарушается нормальная жизнедеятельность организма. При малом поступлении данного элемента организму наносится существенный ущерб. Он функционирует на грани выживания. В основном это объясняется снижением активности ферментов, в состав которых входит данный элемент. При повышении дозы элемента ответная реакция возрастает и достигает нормы (плато). При дальнейшем увеличении дозы проявляется токсическое действие избытка данного элемента, в результате чего не исключается и летальный исход. Кривую на рис. 1 можно трактовать так: все должно быть в меру и очень мало и очень много вредно.
В таблице 1 представлены характерные симптомы дефицита химических элементов в организме человека.
Таблица 1
| Дефицит элемента | Типичный симптом |
| Ca | Замедление роста скелета |
| Mg | Мускульные судороги |
| Fe | Анемия, нарушение иммунной системы |
| Zn | Повреждение кожи, замедление роста, замедление полового созревания |
| Cu | Слабость артерий, нарушение деятельности печени, вторичная анемия |
| Mn | Бесплодие, ухудшение роста скелета |
| Mo | Замедление клеточного роста, склонность к кариесу |
| Co | Злокачественная анемия |
| Ni | Учащение депрессий, дерматиты |
| Cr | Симптомы диабета |
Рассмотрим ионы металлов, которые играют роль макроэлементов в организме человека.
Ни один из щелочных металлов не является особенно токсичным. [1]
Калий и натрий
Калий (K+) и натрий (Na+) можно назвать металлами-близнецами – нарушение баланса между ними приводит к заболеванию сердечно-сосудистой системы (ишемической болезни сердца, инфаркта миокарда, гипертонии), нарушения в работе почек.
Калий регулирует водный баланс; регулирует водно-солевой обмен; нормализует кислотно-щелочные показатели организма; важен для активизации ферментов; поддерживает нормальную работу мышечной системы.
Соли калия необходимы для всех мягких тканей организма: сосудов, мышц, капилляров, клеток мозга, почек, печени и сердечной мышцы, а также для желез внутренней секреции. 50% солей нашего организма – это соли калия.
Суточная потребность в калии: суточная доза калия для взрослого человека составляет 1800 – 5000 мг, для детей – 600-1700 мг.
Симптомы недостатка и избытка калия: при недостатке калия в организме может начать развиваться гиперкалемия, нарушиться работы сердечной мышцы и скелетной мускулатуры, а продолжительный недостаток калия может привести к острой невралгии.
Избыток калия может привести к гиперкалиемия, которая проявляется язвой тонкого кишечника. Гиперкалиемия, вовремя не остановленная может привести к остановке сердца.
В каких продуктах содержится калий: больше всего калия содержится в сухофруктах, свежих овощах и фруктах, в ягодах, проросшем зерне, в орехах, картофеле, а также в молочных продуктах и рыбе.
Натрий – это макроэлемент, который обеспечивает проводимость нервных импульсов, входит в состав крови и регулирует баланс воды в организме. Натрием заполнены все межклеточные пространства, то есть он является основой всех межклеточных жидкостей, а вместе с калием он образует нормальный баланс жидкости, предотвращая риск обезвоживания, в следствии чего, роль натрия трудно переоценить. Также натрий влияет на нервную систему: с помощью разности концентрации натрия генерируются электрические сигналы – основа нервной системы. Натрий укрепляет сердечно-сосудистую системы, входя в состав крови, что позволяет регулировать объем крови. Помимо этого, натрий важен для регулировки выделительных систем, для кислотно-щелочного баланса в организме, а также помогает сохранить и накопить многие вещества в крови после их растворения.
Суточная потребность в натрии: натрий – это соль, суточная дозировка которой должна быть определенной и не больше 4-6 г, а это примерно равно 10-15 г поваренной соли.
При жарком климате потребность в натрии увеличивается, а также при обильном потоотделении и физических нагрузках.
Симптомы недостатка и избытка натрия: чаще всего недостатку натрия подвержены те, кто придерживаются вегетарианского рациона, но сам по себе недостаток натрия – явления довольно редкое. А временный недостаток может произойти при обильном употреблении воды.
Избыток натрия может вызвать отеки лица и ног, большую нагрузку на сердца и почки, повышение кровяного давления и выделение калия. Чрезмерное употребление соли, превышающее 20-30 г очень опасно и может вызвать большой избыток натрия, что приведет к более серьезным последствиям, так как почки не будут успевать его перерабатывать.
Магний
В животных организмах Mg2+ представляет собой необходимый кофактор в каждой реакции, протекающей с участием аденозин-трифосфата (АТФ). Он также играет роль и противоиона для стабилизации двойной спирали ДНК, имеющей отрицательно заряженные фосфатные группировки в каждом звене цепи. Присутствие ионов магния увеличивает вероятность правильного спаривания звеньев. Ионы Mg2+ необходимы для нервно-мышечной передачи и мускульного сокращения. Устойчивый гомеостаз поддерживает уровень Mg2+ в плазме крови на уровне 0,9 мМ для практически здоровых людей. Низкие уровни Mg2+могут вызывать гипокальцемию, при которой метаболически лабильный минерал не может быть мобилизован из костей. Уровни и Mg2+ контролируется пара-тироидным гормоном через механизм негативной обратной связи.
Суточная потребность в магнии: для здорового человека суточная потребность составляет 350-500 мг, причем, половина этой дозы поступает в организм из круп или злаков.
Симптомы недостатка магния: недостаток магния в организме наблюдается у 90% населения. Нехватка магния проявляется как: усталость, судороги мышц, онемение конечностей, запоры, проблемы с координацией, ломкость ногтей и выпадение волос, остеопороз, артрит. [2]
2.3. Кальций.
Кальция в форме Ca2+ содержится в организме больше, чем других ионов металлов. Более 99% его входит в состав костей и зубной эмали в виде гидроксоапатита Са5(РО4)3(ОН). Многие из активностей кальций-иона включены во взаимодействия с белковыми макромолекулами, которые ион Ca2+ может стабилизировать, активировать и модулировать. Все известные до сих пор места связывания в белках для ионов Ca2+ состоят из кислородных атомов. Свободная концентрация Ca2+ в межклеточных жидкостях составляет примерно 1,3 мМ. При стимуляции низкая внутриклеточная концентрация может увеличиться в 10 раз, что сопровождается конформационными изменениями в белковых макромолекулах, имеющих константу диссоциации в пределах микромолей. Рекомендованную дневную дозу (800 мг) Ca2+ можно получить при приеме литра молока — единственного богатого кальцием источника. Дефицит кальция выражается в задержке роста, плохих зубах и в других менее очевидных дефектах. Одним из таких скрытых дефектов является повышенная абсорбция нежелаемых или токсичных ионов металлов в Ca2+ - дефицитной системе.
Кальций считается нетоксичным. Отложение костных минералов в мягких тканях вызывается не избытком Ca2+-ионов, а повышенным содержанием витамина D. Однако высокий уровень Ca2+ в диете может ингибировать кишечную абсорбцию других необходимых организму металлов.
Алюминий
Алюминий является необходимым микроэлементом для человеческого организма. Практически все ткани и органы человека содержат алюминий. Этот микроэлемент в умеренных количествах выполняет немаловажные функции, однако большие его дозы представляют существенную опасность для здоровья.
Как и упомянуто выше, алюминий выполняет множество немаловажных функций: способствует построению костной и соединительной ткани; содействует эпителизации кожи; повышает активность некоторых пищеварительных ферментов; повышает переваривающую функцию желудочного сока; участвует в образовании белковых и фосфатных комплексов; положительно влияет на функцию околощитовидных желез
Суточная потребность в алюминии: здоровому взрослому человеку необходимо примерно 30-50 мкг этого микроэлемента.
Симптомы недостатка и избытка алюминия: при недостатке алюминия отсутствуют какие-либо данные о симптомах, проявляющихся у человека.
В каких продуктах содержится алюминий: в основном, алюминий содержится в фруктах и ягодах, овощах, различных хлебопродуктах, а также в питьевой воде.
Железо
Содержание железа в человеческом организме 4 г, из которых около 70%, т.е. 3 г, находятся в составе красных кровяных клеток в виде гемоглобина, большая часть остатка — в железопротеинах, а небольшое количество — в некоторых ферментах. Из рекомендованной ежедневной потребности в железе, равной 10—20 мг, абсорбируется только 10—20%, несколько большее количество — у лиц с дефицитом по железу при хорошем гомеостазе. Почти все целиком 25 мг железа, ежедневно высвобождаемого при распаде гемоглобина, эффективно рециклируются печенью, так что период полужизни железа в человеческом организме превышает 10 лет.
Суточная потребность в железе: в организме человека для осуществления определенных процессов удерживается примерно 4-5 г железа. Из пищи организмом усваивается всего 8 % поступающего железа. Суточная потребность организма человека в железе составляет от 10 до 25 мг.
Симптомы недостатка железа: первое, что может привлечь внимание – это кожа, она становится сухой и чувствительной к холоду, вследствие чего раньше начинает стареть; расстройства органов пищеварения, и даже ожирение; развивается мышечная слабость; активность мозга ослабевает. [3]
Марганец
Такой микроэлемент, как марганец, очень важен в нашем организме для верного развития клеток и тканей. При нем витамин B1, медь и железо способны полноценно усваиваться в организме, осуществляя важные функции. Например, без витамина B1, то есть тиамина, невозможно было бы запустить процесс строительства новых клеток, в том числе и нервных.
Организм взрослых людей содержит в себе примерно десять или двадцать миллиграмма марганца, к тому же, основное его количество находится в печени, почках, мозгу и костной ткани.
Роль марганца в организме человека: роль микроэлемента заключаются в том, чтобы активировать большое количество ферментативных реакций, например, как: формирование структуры костей; улучшение работы нервной системы; для быстрого заживления полученных ран и роста человека; образование «энергоносителя», то есть глюкозы и белков. С помощью него происходит энергетический процесс, в ходе которого окисляется глюкоза и углероды. Благодаря такому активному участию в ЦНС, марганец получил название «микроэлемент менеджер».
Суточная потребность в марганце: Взрослому человеку необходимо от 2 до 5 миллиграммов марганца.
Симптомы недостатка марганца:
Недостаточность этого микроэлемента плохо отражается на нервной системе, не благотворно влияет на функции мозга и некоторых других органов. Люди, страдающие от депрессии, нуждаются в повышенной потребности ферментов марганца. Именно в такие моменты наступает дефицит.
Кобальт
Кобальт (Co2+) известен как необходимый компонент витамина В12, хелатированный в комплексный корриновый макроцикл четырьмя связанными пиррольными кольцами. Известно несколько форм витамина В12, которые служат кофакторами ферментов в реакции переноса метальной группы, а также и в других реакциях, где кобальт подвергается изменению состояния окисления. Кобальт показал кардиотоксичность для некоторых любителей пива, потребляющих более трех литров в день. (В некоторых странах в пиво добавляют соли двухвалентного кобальта в количестве 10-4% для стабилизации пены, чтобы погасить действие остаточных детергентов.)
Суточная потребность в кобальте: В общем можно сказать, что содержание микроэлемента находится в пределах: не менее 8 мкг и не более 200 мкг.
Симптомы недостатка кобальта: ухудшение памяти; нарушение функций ЦНС; атрофия слизистой желудочно-кишечного тракта;
В общем, нарушается работа всех тех органов, в состав которых входит кобальт и на работу которых влияет.
Никель
В теле человека содержится около 10 мг Ni2+, а уровень в плазме крови заключен в довольно узких пределах, что свидетельствует о гомеостазе и, возможно, о необходимости никеля. Он служит как кофактор для растительного фермента уреазы. Совместно с другими ионами металлов Ni2+ активирует определенные ферменты в организме животных. На сегодняшний день роль этого микроэлемента в организме не до конца изучена. Однако без сомнения никель играет существенную роль в следующих функциях: принимает участие в процессах кроветворения в сочетании с железом, медью и кобальтом (воздействует на развитие эритроцитов и способствует повышению уровня гемоглобина); улучшает гипогликемическую деятельность (увеличивает продуктивность работы инсулина); принимает участие в структурном формировании и функционировании белков, ДНК и РНК.
Суточная потребность в никеле: среднесуточная потребность человека в никеле составляет от 100 до 300 мкг в зависимости от пола и возраста.
Медь
Концентрация меди в организме регулируется гомеостазом, и оптимальные ее концентрации находятся в широких пределах. Медь является необходимым кофактором для нескольких ферментов, катализирующих разнообразные окислительно-восстановительные реакции в обоих валентных состояниях, Сu (I) и Сu (II), хорошо связывает сульфгидрильную группу в глутатионе и серосодержащих белках. Сu (II) окисляет незащищенную сульфгидрильную группу до дисульфидной, самовосстанавливаясь до Сu (I), поэтому организм должен связать Сu (И) прежде, чем состоится окисление сульфгидрильной группы. Около 95% меди в плазме крови находится в составе белка церулоплазмина.
У взрослого человека содержание меди в организме равно примерно 100-200мг. Однако основной запас этого микроэлемента хранится в мышцах человека, его костях, крови, сердце, печени, а также в мозгу.
Роль меди в организме человека: Медь принимает участие в синтезе эритроцитов и лейкоцитов; укрепляет стенки кровеносных сосудов; способствует повышению иммунитета и нейтрализации радикалов.
Суточная потребность в меди: потребность в употреблении такого микроэлемента, как медь, составляет от 1 до 3 мг в день.
Цинк
Большая часть ионов Zn2+ в крови найдена в эритроцитах в качестве необходимого кофактора для фермента карбоангидразы. Zn2+ в теле человека находится в его мускулах. Уровень Zn2+ находится под контролем гомеостаза.
Дефицит цинка отмечен у жителей развивающихся стран, диета которых богата волокнистой и вязкой пищей. Дефицит по цинку выражается в нарушении кожных покровов, отставании в росте, нарушении полового развития и половых функций у молодых людей. Добавки цинка могут разбалансировать метаболические равновесия других металлов, поэтому такие вмешательства должны проводиться под строгим медицинским контролем. Подчеркнем этот совет особенно, поскольку гипотеза об отношении Zn2+/ Сu2+ как о главном причинном факторе в развитии ишемической болезни сердца (локальное прекращение артериального тока крови) оказалось вполне корректной. Прием двухвалентного цинка способствует заживлению ран у дефицитных по цинку пациентов, но он не помогает, если в организме имеется адекватное количество Zn2+. [4]
Вывод:
Из изученных данных стало ясно, что макро- и микроэлементы обеспечивают нормальную работу организма человека, выполняют ряд функций, необходимых для обеспечения жизнедеятельности. Однако, избыток этих металлов в организме приводит к нарушению работы внутренних органов или даже целой системы органов. Такое поведение ионов металлов связано с их свойством токсичности, которая не имеет значения в малых дозах, однако сильно подрывает здоровье человека при повышении суточной дозы по каким-либо причинам.
Дата: 2019-02-19, просмотров: 341.