ВОПРОС № 107
Принцип, лежащий в основе Международной Денверской классификации хромосом человека
Принципы: 1) различия в длине хромосом
2) расположение центромеры
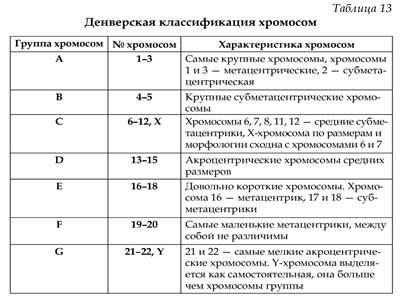
Хромосомы располагаются в порядке уменьшения их длины. Все пары хромосом распределены на 7 групп и пронумерованы арабскими цифрами: группа А(1-3) – большие метацентрические, В(4-5) – большие субметацентрические, С(6-12) – средние субметацентрические и Х-хромосома, D(13-15) – средние акроцентрические, Е(16-18) – небольшие мета- и субцентрические, F(19- 20) – самые короткие метацентрические, G(21-22) – самые мелкие акроцентрические, Y-хромосома.
Центромерный индекс отражает длину короткого плеча к длине всей хромосомы.
ОСНОВНАЯ ЧАСТЬ
Основы существующей унифицированной классификации хромосом были заложены в 1960 году в Денвере. В основу классификации положены различия в длине хромосом и расположении центромеры. На основании различий в длине выделены 23 пары хромосом, при этом парам, имеющим наибольшую длину, дан наименьший номер (самыми длинными являются хромосомы 1- и 2-й пары). Выделяют группы метацентрических, субметацентрических и акроцентрических хромосом. Отнесение хромосом к тому или иному типу производится на основе расчета центромерного индекса - отношения длины короткого плеча к длине всей хромосомы. В группе метацентрических хромосом короткое и длинное плечи приблизительно равны, и центромерный индекс приближается к 0,5. В субметацентрических хромосомах центромерный индекс снижен и составляет от 0,25 до 0,35, в акроцентрических хромосомах он часто не превышает 0,2. На основании комбинации этих двух основных признаков хромосомы сгруппированы в 7 групп, обозначаемых буквами английского алфавита (от А до G).

| 
|
108. Международная Парижская классификация хромосом человека.
Краткий обзор:
Латинскими буквами р и q обозначаются соответственно короткое и длинное плечо хромосомы. От центромеры к теломере по имеющимся отчетливым морфологическим указателям (маркерам) в каждом плече выделяют районы, обозначаемые арабскими цифрами. В пределах районов идентифицируют сегменты — регулярные участки, отличающиеся по интенсификации окраски. Они также обозначаются арабскими цифрами.
Основная часть:
Парижская классификация. В1971 году в Париже на IV международном конгрессе по генетике человека была согласована единая система идентификации хромосом человека, учитывавшая дифференцировку хромосом по длине.Каждая хромосома набора человека при дифференциальной окраске характеризуется уникальным для нее сочетанием темно окрашенных сегментов или полос , чередующихся с неокрашенными участками или светлыми сегментами. Именно такое специфическое для данной хромосомы сочетание сегментов позволяет четко ее идентифицировать и отличить от других хромосом набора. В пределах короткого (р) и длинного (q) плеча каждой хромосомы выделяют ряд четко идентифицируемых областей или регионов, которые нумеруются арабскими цифрами начиная от центромеры к теломерному участку или терминальному концу хромосомы. Каждая область хромосомы включает определенное число сегментов, нумерация которых (второй арабской цифрой) также идет в направлении от центромерного к теломерному участку. Таким образом, обозначение хромосомного сегмента 2q34 означает хромосому №2, длинное плечо, 3 регион и 4 сегмент. Сама центромера обозначается сочетанием цифр 1 и 0, т.е. часть центромеры в пределах короткого плеча обозначается как- р10, а часть, включающая длинное плечо -q10
Открытие в середине 70-х годов того факта, что профазные и про-метафазные хромосомы позволяют достичь большего числа сегментов, чем метафазные хромосомы, и, следовательно, повысить разрешающие возможности цитогенетического исследования, привело к разработке методов получения хромосом высокого разрешения и потребовало дополнения цитогенетической номенклатуры новыми принципами анализа таких хромосом. В1980 году по этому поводу в Париже было достигнуто международное соглашение, которое было опубликовано в 1981 году под названием "Международная система цитогенетической номенклатуры хромосом человека - сегментация хромосом высокого разрешения" или ISCN (1981). Так, если сегмент в пределах какой-либо хромосомы подразделяется на отдельные субсегменты, то после номера сегмента ставится точка, после которой указывается номер субсегмента. Например, если оригинальный сегмент 1 р31 подразделяется на 3 разных субсегмента, то они обозначаются как 1р31.1, 1р31.2и 1р31.3, причем субсегмент 1р31.1 является проксимальным, а 1 р31.3 - дистальным по отношению к центромере. Дополнительное деление субсегментов на другие сегменты, например субсегмента 1 р31.1, соответственно обозначается как 1p31.11,1р31.12 ит.д.
Вопрос №109
Вопрос №115
В чём заключаются трудности и преимущества изучения генетики человека?
Изучение генетики человека связано с биологическими и социально-этическими трудностями.
Биологические:
1) позднее половое созревание
2) малочисленное потомство у одной пары родителей
3) в основном моноплодная беременность (исключение - близнецы)
4) большой срок беременности
5) медленная смена поколений (20 - 25 лет)
6) особенности кариотипа (большое число хромосом и др.)
7) фенотипический полиморфизм (многообразие фенотипов).
Социально-этические:
1) невозможность направленных скрещиваний в интересах исследователя (невозможность применения гибридологического метода)
2) отсутствие точной регистрации наследственных признаков (проводится не всегда и не везде)
3) невозможность создания одинаковых условий жизни для всех людей.
Однако у человека есть и преимущества перед другими генетическими объектами:
1) способность воспринимать информацию и абстрактно мыслить
2) высокая численность популяций, доступных для изучения
3) возможность регистрации наследственных признаков в течение длительного времени
4) использование гибридизации соматических клеток для генетического анализа.
_____________________________________________________________________________
Антропогенетика (генетика человека) - раздел генетики, изучающий наследственность и изменчивость у человека. Из генетики человека выделяется медицинская генетика, исследующая механизмы развития наследственных болезней, возможности их лечения и профилактики.
116.Клинико-гениалогический метод.
Кратко:
Клинико-генеалогический метод включает три основных этапа: клиническое обследование, составление родословной и генеалогический анализ. При составлении родословных принято использовать унифицированные символы. При составлении родословной желательно получить сведения о максимальном количестве родственников 3-4 поколений. Далее, внизу под родословной записывается легенда (данные о состоянии здоровья родственников, причинах и возрасте смерти и др.) и указывается дата составления этого документа. Использование клинико-генеалогического метода предполагает плательное клиническое обследование всех членов родословной с целью выявлена у них стертых или атипичных признаков заболевания. Сбор анамнестических данных проводится по определенной схеме:
1. Сведения о пробанде — анамнез заболевания, включающий начальные признаки и возраст их манифестации, последующее течение болезни; если это ребенок - сведения о раннем психомоторном и последующем умственном и физическом развитии.
2. Данные о сибсах (братьях и сестрах) и родителях пробанда — возраст, здоровы или больны, проведение аналогии с заболеванием пробанда в случае болезни.
3. Сведения о родственниках со стороны матери (родители, их дети, внуки).
4. Сведения о родственниках со стороны отца (родители, их дети, внуки).
Полученные данные записываются в этой последовательности в медико-генетическую карту. При составлении родословных необходимо учитывать наличие и характер профессиональных вредностей (особенно для родителей, имеющих детей с врожденными пороками развития или хромосомной патологией), факторов, влияющих на возникновение патологии плода и новорожденного (прием лекарственных препаратов, заболевания матери, воздействие химических и радиационных мутагенов), время их действия (до или во время беременности). Заключительный этап - анализ родословной.
Полный ответ:
Клинико-генеалогический метод включает три основных этапа: клиническое обследование, составление родословной и генеалогический анализ. При составлении родословных принято использовать унифицированные символы. Составление родословной начинается с пробанда (от англ. probe - зондирование), т.е. с лица, первым попавшего в поле зрения исследователя. Чаще всего им оказывается больной или носитель признака. Однако им может быть и любой родственник больного, обратившийся за медико-генетической консультацией. Всех детей одной супружеской пары называют сибсами (от англ. аббревиатуры SIBS: Sisters - BrotherS). Если общим у братьев и сестер является только один из родителей, их называют полусибсами. В родословной сибсы располагаются в порядке рождения горизонтально слева направо, начиная со старшего. При составлении родословной желательно получить сведения о максимальном количестве родственников 3-4 поколений. Чаще всего родословная бывает представлена последовательными, соединенными между собой горизонтальными рядами, однако, втом случае, если членов родословной оказывается очень много, эти ряды могут быть представлены в виде концентрических окружностей. Все члены одного поколения располагаются строго в одном ряду. Ряды поколений обозначают римскими цифрами. Представители одного поколения нумеруются арабскими цифрами, последовательно — слева направо. Таким образом, каждый член родословной имеет свой шифр двоичной системы, например- 1-1,II-1, II-2 и т.д. Необходимо указывать возраст всех членов родословной, так как некоторые заболевания проявляются в различные периоды жизни. Супруги родственников пробанда, если они здоровы, могут не изображаться. При рассмотрении нескольких признаков прибегают к буквенным или штриховым изображениям внутри символов. Далее, внизу под родословной записывается легенда (данные о состоянии здоровья родственников, причинах и возрасте смерти и др.) и указывается дата составления этого документа. Использование клинико-генеалогического метода предполагает плательное клиническое обследование всех членов родословной с целью выявлена у них стертых или атипичных признаков заболевания. Иногда это оказывается возможным только с помощью дополнительных параклинических методов исследования (например, рентгенологических, биохимических, электрофизилогических, морфологических и других). При невозможности обследования всех членов родословной сбор информации о наличии в семье пробанда заболеваний или признаков, указывающих на таковое, можно проводить разными методами. Например, путем опроса или анкетирования. К сожалению, в настоящее время составление родословных представляет собой сложную задачу, вследствие того, что люди зачастую имеют скудные, отрывочные или неточные сведения о своих родственниках и состоянии их здоровья. Все это затрудняет постановку диагноза. Сбор анамнестических данных проводится по определенной схеме:
1. Сведения о пробанде — анамнез заболевания, включающий начальные признаки и возраст их манифестации, последующее течение болезни; если это ребенок - сведения о раннем психомоторном и последующем умственном и физическом развитии.
2. Данные о сибсах (братьях и сестрах) и родителях пробанда — возраст, здоровы или больны, проведение аналогии с заболеванием пробанда в случае болезни.
3. Сведения о родственниках со стороны матери (родители, их дети, внуки).
4. Сведения о родственниках со стороны отца (родители, их дети, внуки).
Полученные данные записываются в этой последовательности в медико-генетическую карту. Чем больше родственников пробанда будет непосредственно опрошено или обследовано, тем выше шансы на получение более достоверных и полезных сведений, так как наследственные заболевания в семье часто скрываются или неправильно диагностируются. Необходимо внимательно анализировать сообщения об инфекциях и травмах, характер течения которых может указывать на сопутствующее наследственное заболевание или предрасположенность к нему. Важно учитывать генетическую гетерогенность и варьирующую экспрессивность наследственных заболеваний. При сборе анамнестических данных необходимо выяснять акушерский анамнез у женщин: как протекала беременность, на каком фоне она наступила, подробности о всех случаях спонтанных абортов, мертворождений, наличии бесплодных браков и ранней детской смертности, что наиболее важно при подозрении на хромосомную патологию. Следует отмечать девичьи фамилии женщин и место жительства семьи и предков, национальность, что помогает выявить кровно-родственные браки, которые увеличивают вероятность рождения детей с АР наследственным заболеванием. Если родители пробанда родом из одного небольшого по числу жителей населенного пункта (особенно изолированного геофафически), можно предположить, что они имеют общих предков, а, следовательно, и общие патологические гены (случайный инбридинг). При составлении родословных необходимо учитывать наличие и характер профессиональных вредностей (особенно для родителей, имеющих детей с врожденными пороками развития или хромосомной патологией), факторов, влияющих на возникновение патологии плода и новорожденного (прием лекарственных препаратов, заболевания матери, воздействие химических и радиационных мутагенов), время их действия (до или во время беременности). Заключительный этап - анализ родословной - требует хорошего знания критериев типов наследования, которые представлены в наших статьях. Кроме того, необходимо учитывать возможность фенокопий наследственных заболеваний.
117. Современные методы цитогенетики.
Краткий обзор:
Цитогенетика - раздел генетики, изучающий закономерности наследственности во взаимосвязи со строением и функциями органоидов, в особенности хромосом. Методы цитогенетики включают в себя анализ G-бэндинга, флуоресцентную in situ гибридизацию, сравнительную геномную гибридизацию и другие. Часто задачей цитогенетического анализа является определение патологического кариотипа.
Полный ответ:
Цитогенетический метод исследования – анализ, с помощью которого можно установить имеющиеся изменения в хромосомном аппарате. В первую очередь выясняются аномалии в самом наборе хромосом, а также наличие разнообразных структурных перестроек. Такое цитогенетическое исследование чаще всего применяется для своевременной диагностики врожденных и опасных приобретенных заболеваний.
К стандартным процедурам цитогенетического анализа крови относится кариотипирование. С его помощью выявляют нарушения в количестве и структуре хромосом. Для анализа кариотип, забор клеток крови держат в питательной среде на протяжении 3 суток. Затем происходит фиксация полученного материала и изучение под микроскопом. На данных этапах нужно тщательно проследить за качеством специальных окрашивающих препаратов и уровнем подготовки персонала. Существует также цитогенетическое исследование плода, его назначают при различных подозрениях на генетические отклонения или при неправильном раннем внутриматочном развитии. Цитогенетическое исследование костного мозга назначают пациентам с различными видами злокачественных заболеваний в органах системы кроветворения. Во время этого анализа оценивается не менее 20 клеток. На ранних сроках беременности может потребоваться цитогенетическое исследование хориона. Его проводят на 10-14 неделе беременности с целью исключения хромосомных болезней плода, таких как синдром Дауна, болезнь Хантера, b-талассемия и еще около 50 различных отклонений и заболеваний.
Вопрос №118
Вопрос №119
Хромосомная гибридизация in situ
(Краткий обзор) Метод флуоресцентной гибридизации in situ позволяет выявлять индивидуальные хромосомы или их отдельные участки на препаратах метафазных хромосом или интерфазных ядрах на основе комплементарного взаимодействия ДНК-зонда , конъюгированного с флуоресцентной меткой(флуорохромом) и искомого участка на хромосоме.
ДНК-зонды:
· Цельнохромосомные(транслокации)
· Теломерные(делеции, транслокации)
· Локус-специфичные(амплификации, делеции, транслокации)
· Центромерные(анеуплоидии)
(Основная часть) Технология FISH использует ДНК-зонд, который связывается или ренатурирует специфические последовательности ДНК внутри хромосомы. Денатурированный зонд инкубируется с нативной ДНК клетки, также денатурированной до одноцепочечного состояния. Зонд замещает биотин-дезоксиуридинтрифосфат или дигоксигенин-уридинтрифосфат на тимидин. После ренатурации зондом нативной ДНК комплекс «зонд-ДНК» можно обнаружить при добавлении меченного флюорохромом авидина, связывающегося с биотином, или меченного флюорохромом антидигоксигенина. Пометив несколькими различными флюорохромами разные ДНК-зонды, можно одновременно визуализировать несколько хромосом или хромосомных сегментов внутри одной клетки в виде разноцветных сигналов.
Возможность определения специфических генных сегментов, имеющихся или отсутствующих на хромосомах, позволила диагностировать синдромы генных последовательностей на уровне ДНК, как, впрочем, и транслокации в интерфазных ядрах, зачастую — в отдельных клетках. Материалом для FISH могут служить или метафазные хромосомы, полученные из делящихся клеток, или интерфазные ядра из клеток, не находящихся в стадии деления. Срезы предварительно обрабатывают РНКазой и протеиназой для удаления РНК, которая может вступать в перекрестную гибридизацию с зондом и хроматином. Затем их нагревают в формамиде, чтобы денатурировать ДНК, и фиксируют ледяным спиртом. Затем зонд подготавливают к гибридизации путем нагревания. После этого зонд и хромосомный препарат смешивают и герметизируют покровным стеклом при 37 °С для гибридизации. Изменяя температуру инкубации или солевой состав раствора для гибридизации, можно повысить специфичность связывания и уменьшить фоновую маркировку.
Вопрос №120
Краткий обзор
ДНК – зонд - это короткий фрагмент ДНК, конъюгированный с флуоресцеином, ферментно, или радиоактивным изотопом, который используется для гибридизации с комплементарным участком молекулы ДНК – мишени.
Основная часть
Системы ДНК-диагностики
Информация о всем многообразии свойств организма заключена в его генетическом материале. Так, патогенность бактерий определяется наличием у них специфического гена или набора генов, а наследственное генетическое заболевание возникает в результате повреждения определенного гена. Сегмент ДНК, детерминирующий данный биологический признак, имеет строго определенную нуклеотидную последовательность и может служить диагностическим маркером.
В основе многих быстрых и надежных диагностических методов лежит гибридизация нуклеиновых кислот — спаривание двух комплементарных сегментов разных молекул ДНК. Процедура в общих чертах состоит в следующем.
1. Фиксация одноцепочечной ДНК-мишени на мембранном фильтре.
2. Нанесение меченой одноцепочечной ДНК-зонда, которая при определенных условиях (температуре и ионной силе) спаривается с ДНК-мишенью.
3. Промывание фильтра для удаления избытка несвязавшейся меченой ДНК-зонда.
4. Детекция гибридных молекул зонд/мишень.
В диагностических тестах, основанных на гибридизации нуклеиновых кислот, ключевыми являются три компонента: ДНК-зонд, ДНК-мишень и метод детекции гибридизационного сигнала. Система детекции должна быть в высшей степени специфичной и высокочувствительной.
*Флуоресцеин (диоксифлуоран, уранин А) — органическое соединение, флуоресцентный краситель. В аналитической химии флуоресцеин используется в качестве люминесцентного кислотно-основного индикатора. В биохимии и молекулярной биологии изотиоцианатные производные флуоресцеина в качестве биологических красок для определения антигенов и антител.
* Детекция – это обнаружение, выявление, нахождение чего либо.
*конъюгирование=сопряжение
*Если в одной "пробирке" провести плавление и отжиг смеси ДНК, например, человека и мыши, то некоторые участки цепей ДНК мыши будут воссоединяться с комплементарными участками цепей ДНК человека с образованием гибридов. Число таких участков зависит от степени родства видов. Чем ближе виды между собой, тем больше участков комплементарности нитей ДНК. Это явление называется гибридизация ДНК-ДНК.
122. Методы и условия применения прямой ДНК-диагностики.
Краткий обзор:
С помощью прямых методов выявляются нарушения в первичной нуклеотидной последовательности ДНК (мутации и их типы). Прямые методы отличаются точностью, достигающей почти 100 %.
Целью прямой диагностики является идентификация мутантных аллелей (нарушения в первичной нуклеотидной последовательности ДНК, мутации и их типы).
Недостатком метода прямой ДНК-диагностики является необходимость знания точной локализации гена и спектра его мутаций. Методы прямой ДНК-диагностики показаны для таких заболеваний, как фенилкетонурия (мутация R408W), муковисцидоз - (наиболее частая мутация delF508), хорея Гентингтона (экспансия тринуклеотидных повторов-CTG-повторы) и др.
Полный ответ:
С помощью прямых методов выявляются нарушения в первичной нуклеотидной последовательности ДНК (мутации и их типы). Прямые методы отличаются точностью, достигающей почти 100 %. Однако на практике указанные методы могут применяться при определенных условиях:
1) известной цитогенетической локализации гена, ответственного за развитие наследственного заболевания,
2) должен быть клонированным ген заболевания и известна его нуклеотидная последовательность.
Целью прямой диагностики является идентификация мутантных аллелей (нарушения в первичной нуклеотидной последовательности ДНК, мутации и их типы). Высокая точность метода прямой ДНК-диагностики в большинстве случаев не требует ДНК-анализа всех членов семьи, так как выявление мутации в соответствующем гене позволяет почти со 100-процентной точностью подтвердить диагноз и определить генотип всех членов семьи больного ребенка, включая гетерозиготных носителей.
Недостатком метода прямой ДНК-диагностики является необходимость знания точной локализации гена и спектра его мутаций.
Методы прямой ДНК-диагностики показаны для таких заболеваний, как фенилкетонурия (мутация R408W), муковисцидоз - (наиболее частая мутация delF508), хорея Гентингтона (экспансия тринуклеотидных повторов-CTG-повторы) и др.
Однако к настоящему времени гены многих заболеваний не картированы, неизвестна их экзонно-интронная организация, и многие наследственные болезни отличаются выраженной генетической гетерогенностью, что не позволяет в полной мере использовать прямые методы ДНК-диагностики. Поэтому информативность метода прямой ДНК-диагностики широко варьирует. Так, при диагностике хореи Гентингтона, ахондроплазии она составляет 100 %, при фенилкетонурии, муковосицидозе, адреногенитальном синдроме - от 70 до 80 %, а при болезни Вильсона-Коновалова и миопатии Дюшенна/Бекера — 45-60 %. В связи с этим используются косвенные методы молекулярно-генетической диагностики наследственных болезней.
Вопрос №123
Методы и условия применения косвенной ДНК-диагностики.
Краткий обзор :1)Метод ПДРФ-анализа и гипервариабельных сателлитных повторов 2)Косвенная ДНК-диагностика проводится в следующих случаях:
1) когда ген не идентифицирован, а лишь картирован на определенной хромосоме,
2) когда методы прямой ДНК-диагностики не дают результата (например, в силу большой протяженности гена или широком спектре мутационных изменений,
3) при сложной экзонно-интронной организации гена. 3) При использовании косвенных методов ДНК-диагностики требуется семейный анализ аллелей полиморфных маркеров. 4) Косвенные методы ДНК-диагностики могут использоваться в пренаталньой диагностике практически для всех моногенных заболеваний
Основная часть :Косвенные методы ДНК-диагностики основаны на анализе сцепления с исследуемым геном определенного полиморфного локуса (маркера), с помощью которого можно производить маркировку как мутантиых, так и нормальных аллелей и проанализировать их передачу в поколениях, т.е. среди родственников обследуемого лица. Метод ПДРФ-анализа включает проведение нескольких этапов исследования: выделение геномной ДНК; рестрикция выделенной ДНК с помощью специфических эндонуклеаз; электрофоретическое разделение фрагментов ДНК; идентификация фрагментов ДНК, содержащая полиморфный сайт рестрикции с помощью блот-гибридизации по Саузерну. При отсутствии рестрикции ДНК по данным радиоавтографии будет выявляться крупный (неразрезанный фрагмент, или бэнд). При наличии рестрикции будет выявляться меньший по размерам фрагмент. У лиц, гомозиготных по данному наследственному заболеванию, будет выявляться один бэнд, в то время как у лиц, гетерозиготных по данному наследственному моногенному дефекту, будут определяться оба фрагмента. ПДРФ-анализ значительно упрощается, если имеется возможность специфической амплификации участка ДНК, содержащего полиморфный сайт рестрикции. Проведение в этом случае ПЦР-реакции и рестрикции амплифицированного фрагмента позволяет провести тестирование состояния этого локуса. Таким образом, косвенная ДНК-диагностика проводится в следующих случаях:
1) когда ген не идентифицирован, а лишь картирован на определенной хромосоме,
2) когда методы прямой ДНК-диагностики не дают результата (например, в силу большой протяженности гена или широком спектре мутационных изменений,
3) при сложной экзонно-интронной организации гена.
При использовании косвенных методов ДНК-диагностики требуется семейный анализ аллелей полиморфных маркеров.
Для косвенной диагностики могут использоваться так называемые гипервариабельные сателлитные повторы. Они являются более информативными методами, чем ПДРФ-анализ, поскольку обладают высоким уровнем гетерозиготности и плотно расположены в каждой из хромосом. В последние годы используются короткие тандемные повторы (STR-повторы, short tandem repeates), которые стабильно наследуются и обладают большим уровнем полиморфизма, а также короткие секвенированные последовательности ДНК с известной генной локализацией, так называемые STS-повторы (sequence tagged sites).
Последние обладают выраженной индивидуальной специфичностью, стабильно наследуются по законам Менделя и находят широкое применение для молекулярно-генетической диагностики моногенных болезней. Они могут также использоваться в качестве молекулярных маркеров мутантных хромосом в семьях высокого риска. Косвенные методы ДНК-диагностики могут использоваться в пренаталньой диагностике практически для всех моногенных заболеваний. Однако для этого необходимо иметь знания о том, что локус является высокополиморфным и находится вблизи от мутантного гена или внутри него. Поэтому для диагностики требуется обследование как можно большего числа родственников (в первую очередь родители—дети), чтобы проследить путь передачи маркеров потомству. Это повышает информативность выбранного маркера.
Вопрос №126
Принцип метода блоттинга по Саузерну. Применение в биологии и медицине.
Блоттинг по Саузерну - метод, применяемый в молекулярной биологии для выявления определенной последовательности ДНК в образце.
Краткий обзор.
Блоттингом (буквально - промакивание) называют перенос фрагментов макромолекул (ДНК, РНК или белка), разделенных с помощью электрофореза в геле, на твердую подложку - мембрану.
Зонд - короткая цепь одноцепочечной РНК, имеющая комплементарную определенному участку ДНК последовательность
Гибридизация нуклеиновых кислот — соединение in vitro комплементарных одноцепочечных нуклеиновых кислот в одну молекулу.
В исследованиях генома человека часто используют метод блоттинга, разработанный Саузерном, при котором олигонуклеотидный зонд, находящийся в растворе, гибридизуется с ДНК, адсорбированной на мембране (Саузерн-блот гибридизация, Southern blot hybridization).
Геномную ДНК расщепляют на короткие фрагменты, разделяют их в агарозном геле, переносят на мембрану, после чего идентифицируют специфические участки с помощью гибридизации с олигонуклеотидными зондами. Этим методом выявляют уникальные фрагменты ДНК, размер которых составляет приблизительно одну миллгенома часть генома.
Метод.
1. Рестрикция эндонуклеазами рестрикции для разрезания высокомолекулярной ДНК на более мелкие фрагменты.
2. Фрагменты ДНК подвергаются электрофорезу в агарозном геле для разделения по длине.
3. В случае, если некоторые фрагменты ДНК длиннее 15 кб, перед переносом гель обрабатывают, например, соляной кислотой, которая вызывает депуринизацию ДНК и облегчает перенос на мембрану.
4. В случае, когда используют щелочной метод переноса, агарозный гель помещают в щелочной раствор, при этом двойная спираль ДНК денатурирует и облегчает связывание отрицательно заряженной ДНК с положительно заряженной мембраной для дальнейшей гибридизации. При этом разрушаются и остатки РНК.
5. Листок нитроцеллюлозной (или нейлоновой) мембраны помещают сверху или снизу от агарозного геля. Давление осуществляют непосредственно на гель или через несколько слоев бумаги. Для успешного переноса необходим плотный контакт геля и мембраны. Буфер переносится капиллярными силами из участка с высоким содержанием воды в зону с низким содержанием воды (мембрана). При этом осуществляется перенос ДНК из геля на мембрану. Полианионная ДНК связывается с положительно заряженной мембраной силами ионообменных взаимодействий.
6. Для окончательного закрепления ДНК на мембране, последняя нагревается в вакууме до температуры 80 °C в течение двух часов или освещается ультрафиолетовым излучением (в случае нейлоновых мембран).
7. Осуществляют гибридизацию радиоактивно (флюоресцентно) меченной пробы с известной последовательностью ДНК с мембраной.
8. После гибридизации избыток пробы отмывают с мембраны и визуализируют продукты гибридизации путём авторадиографии (в случае радиоактивной пробы) или оценивают окраску мембраны (в случае использования хромогенного окрашивания).
Вопрос №129
Клонирование генов.
Краткий ответ:
Клонирование генов – это процедура, включающая выделение и амплификацию отдельных генов в реципиентных клетках, про- или эукариотических. С информационной РНК, выделяемой из однотипных клеток организма, снимают ДНК-копии (кДНК), которые затем вводят в реципиентные клетки, и амплифицируют. Клонирование ДНК in vivo включает 4 этапов:
1) получение фрагментов ДНК, в том числе генов или их частей с помощью ферментов рестрикции;
2) рекомбинация фрагментов,
3) вставка фрагмента ДНК в вектор;
4) трансформация с помощью вектора организма хозяина;
5) скрининг на рекомбинантный вектор
6) отбор интересующих исследователя клонов.
Основная часть:
Реципиентные клетки – клетки, выбранные для клонирования гена, могут быть как про-, так и эукариотическими.
мРНК выделяют из клеток или тканей, в которых экспрессируется искомый ген.
Синтез ДНК - копий осуществляется ферментом РНК-зависимой ДНК-полимеразой. Чтобы этот фермент начал работать, требуется короткая одноцепочечная ДНК-затравка; для этой цели, как правило, используют oligo(dT). Затравочная ДНК самопроизвольно образует двухцепочечный комплекс с отрезком poly(dA).
Деполимеризацию исходной РНК-цепочки осуществляют путем щелочного гидролиза. Цепи ДНКустойчивы к обработке щелочью, а РНК полностью деполимеризуется. Получившаяся в результате ДНК является одноцепочечной.
Двухцепочечную (дц) кДНК получают путем достраивания оц-кДНК до двухцепочечной формы, выполняемого ферментом ДНК-полимеразой I. Такую кДНК можно встраивать в вектор.
Существует два основных типа векторов: бактериальные плазмиды и бактериофаги.
Плазмиды — это встречающиеся в клетках внехромосомные элементы, представляющие собой замкнутые кольцевые молекулы дц-ДНК. Чтобы включить кДНК в плазмиду, замкнутое кольцо плазмиды надо «разомкнуть». Для этого плазмиды подвергают воздействию рестриктаз.
Рестриктаза - разрезает дц-ДНК по определенным нуклеотидным последовательностям, называемым участками рестрикции.
Сшивание (лигирование) — процедура, в ходе которой чужеродная ДНК встраивается между (или сшивается с двумя концами плазмидной ДНК с помощью фермента, называемого ДНК-лигазой.
Трансформация происходит после того, как рекомбинантную плазмиду добавляют к бактерии-реципиенту: плазмида проникает внутрь бактерии и включается в ее жизненный цикл.
Скрининг («просеивание») — это процедура, необходимость применения которой обусловлена тем, что в исходном препарате кДНК представлено много разных мРНК и лишь часть плазмид несет нужный нам ген.
Амплификация осуществляется благодаря тому, что в одной бактериальной клетке может синтезироваться много копий интересующей нас плазмиды, а также за счет получения большого количества клеток с такими плазмидами. После выделения и очистки плазмиды обрабатывают соответствующей рестриктазой, которая вырезает встроенные в них копии искомого гена. Амплифицированный таким образом ген можно использовать для дальнейших экспериментов в области генной инженерии.
Вопрос №130
Генетически модифицированные организмы.
Краткий обзор:
Генетически модифицированный организм (ГМО) - организм, генотип которого был искусственно изменён при помощи методов генной инженерии (растения, животные и микроорганизмы).
Генная инженерия - совокупность приёмов, методов и технологий получения рекомбинантных РНК и ДНК, выделения генов из организма, осуществления манипуляций с генами и введения их в другие организмы. В отличие от традиционной селекции, в ходе которой генотип подвергается изменениям лишь косвенно, генная инженерия позволяет непосредственно вмешиваться в генетический аппарат, применяя технику молекулярного клонирования.
Основным видом генетической модификации в настоящее время является использование трансгенов для создания трансгенных организмов.
Трансген — фрагмент ДНК, переносимый при помощи генно-инженерных манипуляций в геном определённого организма с целью модификации его свойств. Трансген может быть выделен из биологического объекта или синтезирован искусственно.
Трансге́нный органи́зм — живой организм, в геном которого искусственно введен ген, который не может быть приобретен при естественном скрещивании.
Основная часть:
Основные этапы создания ГМО:
1. Получение изолированного гена.
2. Введение гена в вектор для переноса в организм.
Вектор - молекула нуклеиновой кислоты, чаще всего ДНК, используемая в генетической инженерии для передачи генетического материала другой клетке. Чтобы встроить ген в вектор, используют ферменты — рестриктазы и лигазы. С помощью рестриктаз ген и вектор можно разрезать на кусочки. С помощью лигаз такие кусочки можно «склеивать», соединять в иной комбинации, конструируя новый ген или заключая его в вектор.
3. Перенос вектора с геном в модифицируемый организм.
4. Преобразование клеток организма.
5. Отбор генетически модифицированных организмов и устранение тех, которые не были успешно модифицированы.
Применение:
В медицине: при помощи трансгенной бактерии производится человеческий инсулин.
В фармацевтической промышленности: выпускается большое количество лекарственных средств на основе рекомбинантных белков человека
В сельском хозяйстве: для создания новых сортов растений, устойчивых к неблагоприятным условиям среды и вредителям, повышение урожайности.
А также: разрабатываются генетически модифицированные бактерии, способные производить экологически чистое топливо.
Генетически модифицированная пища - это продукты питания, полученные из генетически модифицированных организмов (ГМО). Большинство культивируемых генно-модифицированных организмов обладают устойчивостью к возбудителям болезней (к вирусам и грибам), насекомым-вредителям или к гербицидам.
131. Структура генома.
Краткий ответ:
Геном - вся совокупность молекул ДНК клетки (в случае ряда вирусов говорят о геномной РНК).
Существует ядерный геном, митохондриальный геном и геном пластид. Мы будем рассматривать только ядерный геном. Соматические клетки содержат диплоидный (2n) геном, половые - гаплоидный (n).
Размер генома
| Объект | Размер гаплоидного генома в парах нуклеотидов |
| Микоплазмы | 104-106 |
| Эубактерии (E.coli) | 105-107 |
| Грибы | (2-5)х107 |
| Водоросли | (5-7)х107 |
| Черви | ~108 |
| Моллюски | 5х108-5х109 |
| Насекомые | 108-5х109 |
| Ракообразные | ~ 109 |
| Иглокожие | 2х108-2х109 |
| Рыбы | 3х108-1010 |
| Амфибии | 7х108-7х1010 |
| Рептилии | (2-3)х109 |
| Птицы | 109 |
| Млекопитающие | 3х109 |
| Цветковые растения | 2х108-1011 |
Полный ответ:
Геном - вся совокупность молекул ДНК клетки (в случае ряда вирусов говорят о геномной РНК).
Существует ядерный геном, митохондриальный геном и геном пластид. Соматические клетки содержат диплоидный (2n) геном, половые - гаплоидный (n).
Прямой корреляции между количеством ДНК и эволюционной продвинутостью организма нет.
Так, например, у малярийного плазмодия 0.06 пг ДНК в ядре, а у амебы 490 пг. Большое количество ДНК не обязательно приносит качественно новую информацию. Амеба пошла на увеличение количества ДНК для увеличения размеров ядра и самой клетки. Генов у нее меньше, чем у плазмодия, но они копированы много раз. У малярийного плазмодия генов больше, чем у амебы, а ДНК меньше для максимальной компактности. Малые размеры ядра и самого одноклеточного организма позволяют ему быть внутриклеточным паразитом.
"Избыточность" эукариотического генома
На ~ 106 пар нуклеотидов у бактерий приходится ~5 тыс. генов. На ~109 пар нуклеотидов у млекопитающих ~50 тыс. генов.
Минусы "избыточной" ДНК:
- увеличение времени синтеза ДНК;
- cложнее организовывать удвоение ДНК;
- высокая энергоемкость - на 1 нуклеотид для включения в цепь ДНК нужно затратить ~60 молекул АТФ.
Неопределенное следствие:
- благодаря зависимости размера ядра от количества ДНК происходит увеличение размеров клетки.
Плюсы "избыточной" ДНК:
- возникает возможность создания сложного регуляторного аппарата, позволяющего поднять организм на более высокий эволюционный уровень.
Причины избыточности:
1. Большой размер генов (за счет наличия интронов).
2. Присутствие повторенных последовательностей. Повторяются и гены, и некодирующие участки. У эукариот некоторые последовательности повторены сотни и тысячи раз.
3. Наличие большого числа некодирующих последовательностей, часть из которых выполняет регуляторную функцию при транскрипции, а часть - необходима для компактизации генома.
Вопрос №134
Полиморфизм генов.
Краткий обзор:
Полиморфизм ДНК-существование в популяции двух или большего числа альтернативных аллелей определенного локуса гена, которые различаются нуклеотидной последовательностью.
Аллель-серия двух или более генов занимающие одинаковые позиции в гомологичных хромосомах. Соматические клетки содержат два аллеля одного гена(по числу гомологичных хромосом),половые по одному аллелю.
Основная часть:
Большинство генов в каждом организме представлено двумя аллелями один от отца другой от матери. Если аллели идентичны- то организм -гомозиготен если разные- гетерозиготен.В ходе эволюции разные аллели произошли от единого аллеля предшественника.Таким образом гены представленные в популяции несколькими аллелями –полиморфные. Мутации ведут к возникновению новых аллелий.И лежат в основе генетической изменчивости живой природы.Пример молчащей мутации замена нуклеотида, при которой новый кодон имеет прежний смысл.(кодирует ту же аминокислоту- НЕ МЕНЯЕТ СТРУКТУРУ БЕЛКА)Такие нейтральные мутации –нормальные полиморфизмы.Патологические мутации приводят к нарушению механизма трансляции транскрипции, либо к синтезу аномального белка.
Полиморфизмы обнаружены во всех структурных элементах генома:экзонах интронах регуляторных участков. Полиморфизм ДНК БОЛЕЕ выражен в некодирующей части генома→изменение уровня экспрессии мРНК.Если один и тот же ген у разных людей отличается на один нуклеотид –однонуклеотидный полиморфизм.(В геноме человека встречается 1 на 300 нуклеотидов)Такая высокая плотность позволяет использовать однонуклеотидные полиморфизм ы в качестве генетического маркера. Еще один вид генетического полиморфизма –вариация числа копий.В этом случае наблюдатся вариации числа копий протяженных участков ДНК. Происходит ЭТО в результате ДЕЛЕЦИИ И ДУПЛИКАЦИИ.
Ген считается полиморфным если его самый распространенный аллель встречается менее чем у 99%людей,или частота редкого аллеля должна быть менее чем 1%В науке и медицине полиморфизм используют в качестве генетического маркера для поисков генов ответственных за генетические заболевания
Транспозон
Кратко:
Транспозон – мобильная последовательность ДНК, способная к перемещениям (транспозиции) внутри генома.
Полный ответ:
Транспозоны, встраиваяст в геном, могут вызвать мутации и хромосомные перестройки. Транспозоны активно участвуют в процессах переноса лекарственной устойчивости среди микроорганизмов, в рекомбинации, в обмене генетическим материалом между различными видами. Основу структуры транспозона составляют две повторяющиеся последовательности ДНК, необходимые для транспозиции, между которыми находятся белок-кодирующие гены.
141. Значение проекта «Геном человека» для медицины
Краткий обзор:
Геном человека - международная программа, конечной целью которой является определение нуклеотидной последовательности (секвенирование) всей геномной ДНК человека, а также идентификация генов и их локализация в геноме (картирование).
Полный ответ:
В ходе проекта создают последовательно три типа карт хромосом: генетические, физические и секвенсовые (от англ. слова sequence - последовательность). Выявление всех генов, присутствующих в геноме человека, и установление хотя бы примерного расстояния между ними позволят локализовать каждый ген в хромосомах. Такие генетические карты помимо инвентаризации генов и указания места их расположения ответят на исключительно важный вопрос о вовлеченности генов в образование отдельных признаков организма. Ведь многие признаки формируются под контролем нескольких генов, часто расположенных в разных хромосомах, и знание локализации каждого из них будет способствовать лучшему распознаванию законов дифференцировки клеток, органов и тканей, а также лучшему лечению болезней.
Появляется возможность применения результатов секвенирования генома человека для лечения генетических заболеваний. К настоящему времени в мире идентифицировано множество генов, ответственных за многие болезни человека, в том числе и такие серьезные, как болезнь Альцгеймера, муковисцидоз, мышечная дистрофия Дюшенна, хорея Гентингтона, наследственный рак молочной железы и яичников. Структуры этих генов полностью расшифрованы, а сами они клонированы
Примеры:
Разные аллели одного гена могут обуславливать разные реакции людей на лекарственные препараты. Фармацевтические компании планируют использовать эти данные для производства определенных лекарств, предназначенных различным группам пациентов. Это поможет устранить побочные реакции от лекарств, точнее, понять механизм их действия, снизить миллионные затраты. Целая новая отрасль – фармакогенетика – изучает, как те или иные особенности строения ДНК могут ослабить или усилить воздействие лекарств.
Выяснилось, что существуют гены, обуславливающие предрасположенность к развитию профессиональных заболеваний на вредных производствах. Так, на асбестовых производствах одни люди болеют и умирают от асбестоза, а другие устойчивы к нему. В будущем возможно создание специальной генетической службы, которая будет давать рекомендации по поводу возможной профессиональной деятельности с точки зрения предрасположенности к профессиональным заболеваниям.
Расшифровка геномов бактерий позволяет создавать новые действенные и безвредные вакцины и качественные диагностические препараты.
142. Закон Харди-Вайнберга.
Закон Харди-Вайнберга формулируется следующим образом:
в идеальной популяции соотношение частот аллелей генов и генотипов из поколения в поколение является величиной постоянной и соответствует уравнению:
p2 +2pq + q2 = 1
где p2 — доля гомозигот по одному из аллелей
p — частота этого аллеля
q2 — доля гомозигот по альтернативному аллелю
ВОПРОС № 107
Принцип, лежащий в основе Международной Денверской классификации хромосом человека
Принципы: 1) различия в длине хромосом
2) расположение центромеры
Хромосомы располагаются в порядке уменьшения их длины. Все пары хромосом распределены на 7 групп и пронумерованы арабскими цифрами: группа А(1-3) – большие метацентрические, В(4-5) – большие субметацентрические, С(6-12) – средние субметацентрические и Х-хромосома, D(13-15) – средние акроцентрические, Е(16-18) – небольшие мета- и субцентрические, F(19- 20) – самые короткие метацентрические, G(21-22) – самые мелкие акроцентрические, Y-хромосома.
Центромерный индекс отражает длину короткого плеча к длине всей хромосомы.
ОСНОВНАЯ ЧАСТЬ
Основы существующей унифицированной классификации хромосом были заложены в 1960 году в Денвере. В основу классификации положены различия в длине хромосом и расположении центромеры. На основании различий в длине выделены 23 пары хромосом, при этом парам, имеющим наибольшую длину, дан наименьший номер (самыми длинными являются хромосомы 1- и 2-й пары). Выделяют группы метацентрических, субметацентрических и акроцентрических хромосом. Отнесение хромосом к тому или иному типу производится на основе расчета центромерного индекса - отношения длины короткого плеча к длине всей хромосомы. В группе метацентрических хромосом короткое и длинное плечи приблизительно равны, и центромерный индекс приближается к 0,5. В субметацентрических хромосомах центромерный индекс снижен и составляет от 0,25 до 0,35, в акроцентрических хромосомах он часто не превышает 0,2. На основании комбинации этих двух основных признаков хромосомы сгруппированы в 7 групп, обозначаемых буквами английского алфавита (от А до G).

| 
|
108. Международная Парижская классификация хромосом человека.
Краткий обзор:
Латинскими буквами р и q обозначаются соответственно короткое и длинное плечо хромосомы. От центромеры к теломере по имеющимся отчетливым морфологическим указателям (маркерам) в каждом плече выделяют районы, обозначаемые арабскими цифрами. В пределах районов идентифицируют сегменты — регулярные участки, отличающиеся по интенсификации окраски. Они также обозначаются арабскими цифрами.
Основная часть:
Парижская классификация. В1971 году в Париже на IV международном конгрессе по генетике человека была согласована единая система идентификации хромосом человека, учитывавшая дифференцировку хромосом по длине.Каждая хромосома набора человека при дифференциальной окраске характеризуется уникальным для нее сочетанием темно окрашенных сегментов или полос , чередующихся с неокрашенными участками или светлыми сегментами. Именно такое специфическое для данной хромосомы сочетание сегментов позволяет четко ее идентифицировать и отличить от других хромосом набора. В пределах короткого (р) и длинного (q) плеча каждой хромосомы выделяют ряд четко идентифицируемых областей или регионов, которые нумеруются арабскими цифрами начиная от центромеры к теломерному участку или терминальному концу хромосомы. Каждая область хромосомы включает определенное число сегментов, нумерация которых (второй арабской цифрой) также идет в направлении от центромерного к теломерному участку. Таким образом, обозначение хромосомного сегмента 2q34 означает хромосому №2, длинное плечо, 3 регион и 4 сегмент. Сама центромера обозначается сочетанием цифр 1 и 0, т.е. часть центромеры в пределах короткого плеча обозначается как- р10, а часть, включающая длинное плечо -q10
Открытие в середине 70-х годов того факта, что профазные и про-метафазные хромосомы позволяют достичь большего числа сегментов, чем метафазные хромосомы, и, следовательно, повысить разрешающие возможности цитогенетического исследования, привело к разработке методов получения хромосом высокого разрешения и потребовало дополнения цитогенетической номенклатуры новыми принципами анализа таких хромосом. В1980 году по этому поводу в Париже было достигнуто международное соглашение, которое было опубликовано в 1981 году под названием "Международная система цитогенетической номенклатуры хромосом человека - сегментация хромосом высокого разрешения" или ISCN (1981). Так, если сегмент в пределах какой-либо хромосомы подразделяется на отдельные субсегменты, то после номера сегмента ставится точка, после которой указывается номер субсегмента. Например, если оригинальный сегмент 1 р31 подразделяется на 3 разных субсегмента, то они обозначаются как 1р31.1, 1р31.2и 1р31.3, причем субсегмент 1р31.1 является проксимальным, а 1 р31.3 - дистальным по отношению к центромере. Дополнительное деление субсегментов на другие сегменты, например субсегмента 1 р31.1, соответственно обозначается как 1p31.11,1р31.12 ит.д.
Вопрос №109
Назовите основные виды хромосомных аберраций.
Краткий обзор:
Хромосомные аберрации (хромосомные мутации, хромосомные перестройки) — изменения структуры хромосом.
Классифицируют делеции (удаление участка хромосомы), инверсии (изменение порядка генов участка хромосомы на обратный), дупликации (повторение участка хромосомы), транслокации (перенос участка хромосомы на другую). Хромосомные перестройки носят, как правило, патологический характер и нередко приводят к гибели организма. Показано значение хромосомных перестроек в видообразовании и эволюции
Основная часть:
Делеции (от лат. deletio — уничтожение) — хромосомные перестройки, при которых происходит потеря участка хромосомы. Делеция может быть следствием разрыва хромосомы или результатом неравного кроссинговера. По положению утерянного участка хромосомы делеции классифицируют на внутренние (интерстициальные) и концевые (терминальные).
Инверсия - изменение структуры хромосомы, вызванное поворотом на 180° одного из внутренних её участков.
Дупликация (лат. duplicatio — удвоение) — мутация, нарушающая структуру хромосом, представляет собой удвоение участка хромосомы, содержащего гены. Может произойти в результате ошибки при гомологичной рекомбинации, Ретротранспозиции, или из-за дубликации всех хромосомы.[1] Вторая копия гена часто не подвергается давлению селекции — так, мутация одной из копий гена не несет вреда организму. Следовательно, копии накапливают мутации быстрее, чем гены, существующие в одном экземпляре.
Транслока́ция — тип хромосомных мутаций, при которых происходит перенос участка хромосомы на негомологичную хромосому.
Отдельно выделяют реципрокные транслокации, при которых происходит взаимный обмен участками между негомологичными хромосомами, и Робертсоновские транслокации, или центрические слияния, при которых происходит слияние акроцентрических хромосом с полной или частичной утратой материала коротких плеч.
Особый вид реципрокных транслокаций представляют собой так называемые робертсоновские транслокации. В этом случае разрывы в двух акроцентрических хромосомах локализуются в области центромер или в непосредственной близости от них. Длинные плечи хромосом сливаются, а короткие теряются. Поскольку короткие плечи акроцентрических хромосом содержат гены рРНК, то их потеря никак не проявляется, так как множественные копии этих генов содержатся также в других акроцентрических хромосомах. Поэтому робертсоновская транслокация функционально является сбалансированной.
Реципрокные транслокации являются сбалансированной хромосомной перестройкой, при их формировании не происходит потери генетического материала.
110. Генные мутации. Механизмы их возникновения.
Краткий ответ:
Генные точечные мутации характеризуются искажением порядка следование нуклеотидов в составе гена-мишени, что может выразиться прекращением трансляции белковой молекулы, синтезом мутантного белка с нарушенной функцией или токсическими свойствами, недостаточным или избыточным синтезом белка.
По последствиям генных мутаций их классифицируют на нейтральные и динамические, а также на миссенс- и нонсенс-мутации. (см. ниже)
Полный ответ:
По характеру изменений в составе гена различают следующие типы мутаций:
· Делеции — утрата сегмента ДНК размером от одного нуклеотида до гена.
· Дупликации — удвоение или повторное дублирование участка ДНК от одного нуклеотида до целых генов.
· Инверсии — встраивание от двух до нескольких нуклеотидов на прежнее место ДНК после поворота на 180
· Инсерции — вставка фрагментов ДНК размером от одного нуклеотида до целого гена.
· Трансверсии — замена пуринового (А,Г) основания на пиримидиновое (Ц,У,Т) или наоборот в одном из кодонов.
· Транзиции — в нуклеотидном остатке замена одного пуринового основания на другое пуриновое или одного пиримидинового на другое в структуре кодона.
o Нейтральная мутации (молчащая мутация) — мутация не имеет фенотипического выражения (например, в результате вырожденности генетического кода).
o Миссенс-мутация — замена нуклеотида в кодирующей части гена, что приводит к замене аминокислоты в полипептиде.
o Нонсенс-мутация — замена нуклеотида в кодирующей части гена — приводит к образованию стоп-кодона и прекращению трансляции.
o Динамические мутации — мутации, обусловленные увеличением числа тринуклеотидных повторов в функционально значимых частях гена. Такие мутации могут привести к торможению или блокаде транскрипции, приобретению белковыми молекулами свойств, нарушающих их нормальный метаболизм.
111. Генные мутации.
Краткий ответ:
Генные мутации – изменение строения одного гена. Это изменение в последовательности нуклеотидов: выпадение, вставка, замена и т.п. Например, замена А на Т. Причины – нарушения при удвоении (репликации) ДНК. Примеры: серповидноклеточная анемия, фенилкетонурия.
Генные, или точечные, мутации бывают в основном 3 видов:
· замены, при которых одно азотистое основание в ДНК замещается на другое;
· вставки, обеспечивающие внедрение в молекулу ДНК одного или нескольких дополнительных нуклеотидов;
· делеции (или выпадения) одного или нескольких нуклеотидов, при которых происходит укорочение молекулы ДНК.
Полный ответ:
Генные мутации – изменение строения одного гена. Это изменение в последовательности нуклеотидов: выпадение, вставка, замена и т.п. Например, замена А на Т. Причины – нарушения при удвоении (репликации) ДНК. Примеры: серповидноклеточная анемия, фенилкетонурия.
По характеру изменений в составе гена различают следующие типы мутаций:
Делеции — утрата сегмента ДНК размером от одного нуклеотида до гена.
Дупликации — удвоение или повторное дублирование сегмента ДНК от одного нуклеотида до целых генов.
Инверсии — поворот на 180° сегмента ДНК размером от двух нуклеотидов до фрагмента, включающего несколько генов.
Инсерции — вставка фрагментов ДНК размером от одного нуклеотида до целого гена.
Трансверсии — замена пуринового основания на пиримидиновое или наоборот в одном из кодонов.
Транзиции — замена одного пуринового основания на другое пуриновое или одного пиримидинового на другое в структуре кодона.
По последствиям генных мутаций их классифицируют на нейтральные, регу-ляторные и динамические, а также на миссенс- и нонсенс-мутации. Нейтральная мутации (молчащая мутация) — мутация не имеет фенотипи-ческого выражения (например, в результате вырожденности генетического кода).
Миссенс-мутация — замена нуклеотида в кодирующей части гена — приводит к замене аминокислоты в полипептиде.
Нонсенс-мутация — замена нуклеотида в кодирующей части гена — приводит к образованию кодона-терминатора (стоп-кодона) и прекращению трансляции.
Регуляторная мутация — мутация в 5'- или З'-нетранслируемых областях гена, такая мутация нарушает экспрессию гена.
Динамические мутации — мутации, обусловленные увеличением числа три-нуклеотидных повторов в функционально значимых частях гена. Такие мутации могут привести к торможению или блокаде транскрипции, приобретению белковыми молекулами свойств, нарушающих их нормальный метаболизм.
Дата: 2019-02-02, просмотров: 2452.